ABCG1基因啟動子區甲基化與急性腦梗死的相關分析
張廣煒,劉 丹
腦梗死是中老年人常見病、多發病,是全球中老年人長期殘疾的首要原因。盡管診療技術不斷進步,但大部分患者仍遺留有不同程度的后遺癥,針對腦梗死進行積極有效的預防治療,可降低腦梗死的發生[1,2]。ABCG1是ABCG家族的跨膜半轉運蛋白,可在多個組織中高表達,同時也可參與脂質代謝過程,在巨噬細胞膽固醇的逆轉運中間過程中,ABCG1可以防止過多的脂質聚集,減少動脈粥樣硬化(AS)的形成,可起到保護血管避免動脈粥樣硬化損傷的作用。
DNA甲基化是指S-腺苷甲硫氨酸上的甲基在DNA甲基轉移酶的催化作用下,與胞嘧啶的C5位結合形成甲基胞嘧啶的化學修飾過程[3]。有研究提示,ABCG1的啟動子區甲基化后,抑制了ABCG1的血管保護作用,使得AS的形成增加,同時也加重了動脈粥樣硬化相關的心腦血管疾病的發生。據此,本課題主要研究ABCG1基因啟動子區甲基化與急性腦梗死之間的相關性,為腦梗死的基因診治提供一定的理論支持。
1 對象與方法
1.1 研究對象 病例組為隨機篩選2017年7月-2018 年11月我院神經內科就診的急性腦梗死患者,均為漢族 ,彼此無親緣關系,共計84例;對照組為2017年7月-2018 年11月我院診治的非腦梗死患者,共計90例。
病例組入選標準:(1)年齡≥18 歲;(2)發病時間≤7 d;(3)腦梗死診斷符合1996年全國第四屆腦血管病學術會議修訂的動脈粥樣硬化性腦梗死的診斷標準,且經部CT或MRI檢查證實。 排除標準:(1)既往曾有腦出血病史或CT顯示存在腦出血;(2)有明顯的心、肝、腎功能不全及惡性腫瘤;(3)存在心房顫動等嚴重心律失常;(4)心源性栓塞所致的卒中、腔隙性腦梗死及無癥狀性腦梗死。
1.2 方法與分組 病例組與對照組于入院次日清晨采集肘靜脈血共計2 ml,用抗凝管留置并編號,置-20 ℃低溫冰箱保存。進行亞硫酸氫鹽修飾基因組DNA和基因組DNA純化回收,甲基化特異性PCR(Methylation-specific polymerase chain reaction,MSP)檢測和瓊脂糖凝膠電泳判定甲基化結果,同時行血常規、生化等常規實驗室檢查,以及頸部血管彩超、CT、MRI等相關檢查。
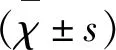
2 結 果
2.1 病例組和對照組的一般資料和臨床實驗指標對比 經獨立樣本t檢驗或χ2檢驗,結果顯示年齡、性別、空腹血糖、TC、TG、LDL-C的組間P>0.05,差異無統計學意義;而收縮壓、舒張壓、抽煙史、飲酒史、HDL-C的組間P<0.05,差異有統計學意義(見表1)。
2.2 ABCG1基因甲基化特異性PCR檢測結果 采用甲基化和非甲基化特異性引物擴增被亞硫酸氫鹽修飾轉化后的對照組和病例組DNA時,ABCG1甲基化引物與非甲基化引物擴增得到預期大小的擴增片段。在檢測的病例組樣本中,ABCG1因子啟動子區有66人顯示甲基化陽性,甲基化陽性率為78.6%;對照組中有43人顯示甲基化陽性,甲基化陽性率為47.78%,P<0.01差異有統計學意義。
2.3 病例組與對照組一般資料、臨床實驗指標、ABCG1基因啟動子區甲基化的相關性分析 分別對病例組與對照組和年齡、性別、抽煙、飲酒、血壓、血脂及ABCG1基因甲基化情況進行Pearson線性相關或Spearman秩相關分析,結果顯示:急性腦梗死與抽煙(r=0.349,P<0.01)、飲酒(r=0.162,P=0.033)、收縮壓(r=0.259,P=0.001)、ABCG1基因啟動子甲基化陽性情況(r=0.318,P<0.01)均為正相關,而與HDL-C(r=-0.255,P=0.001)為負相關,表明抽煙、飲酒、高血壓、ABCG1基因啟動子區甲基化均為急性腦梗死發病的危險因素,HDL-C為保護因素。而年齡、性別、空腹血糖、TG、TC、LDL-C、病例組和對照組未見明顯相關(見表2)。
2.4 急性腦梗死發病危險因素的Logistic回歸分析 以急性腦梗死的發生情況為因變量,以抽煙、飲酒、收縮壓、HDL-C、ABCG1基因啟動子區甲基化與ACI發病相關的指標為自變量,采用二元Logistic回歸分析的進入法進行分析,在校正其他危險因素后,結果顯示:抽煙史、收縮壓、HDL-C、ABCG1基因啟動子區甲基化有統計學意義(P<0.05)。并且從上述指標的OR值可以看出收縮壓、抽煙史、ABCG1基因啟動子區甲基化是ACI發病的獨立危險因素,這些指標每升高一個單位,ACI發病風險分別為原來的1.028倍、3.449倍、3.047倍(收縮壓:OR=1.028,95%CI1.009~1.046,P<0.01;抽煙史OR=3.449,95%CI1.631~7.293,P<0.01;ABCG1:OR=3.047,95%CI1.439~6.454,P<0.01),而HDL-C是急性腦梗死發病的保護性因素,該指標每升高一個單位,發病風險為原來的0.211倍(HDL-C:OR=0.211,95%CI0.067~0.665,P<0.01)(見表3)。
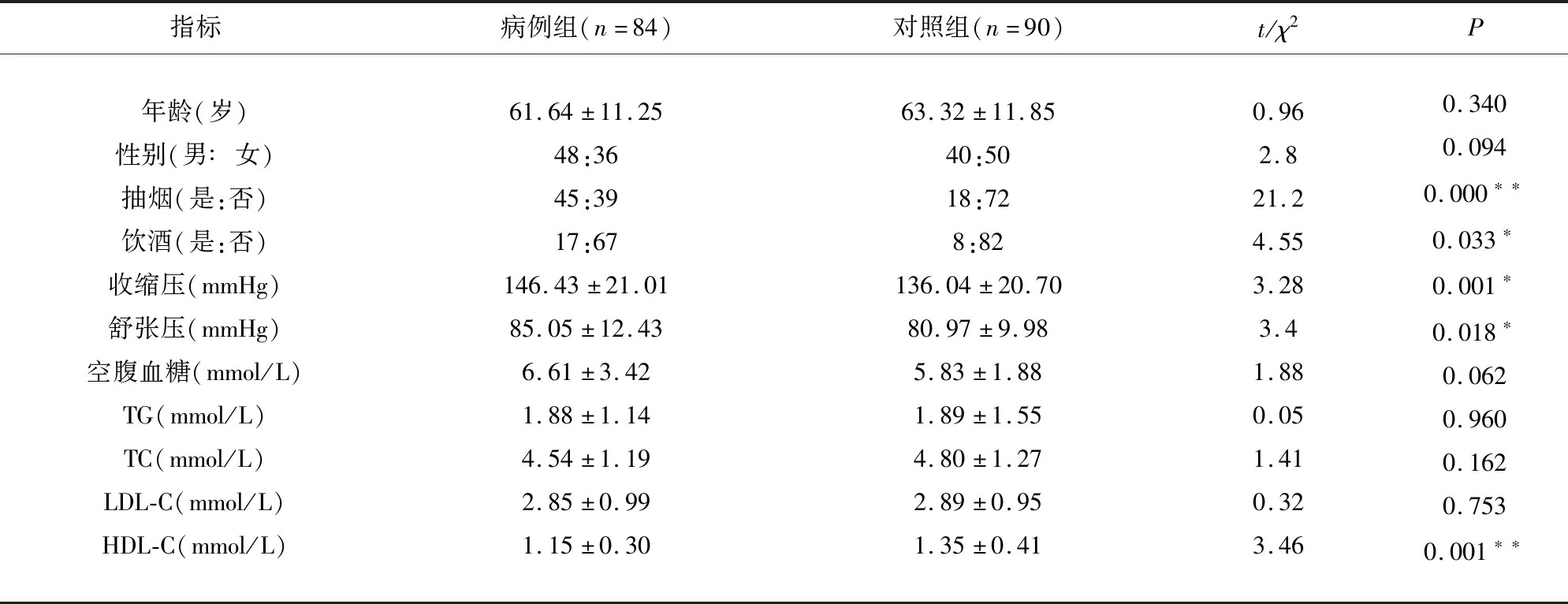
表1 病例組和對照組的一般資料與臨床實驗指標對比
病例組與對照組比較*P<0.05,**P<0.01

表2 病例組與對照組臨床檢驗和實驗指標的相關分析
病例組與對照組比較r為相關系數*P<0.05,**P<0.01
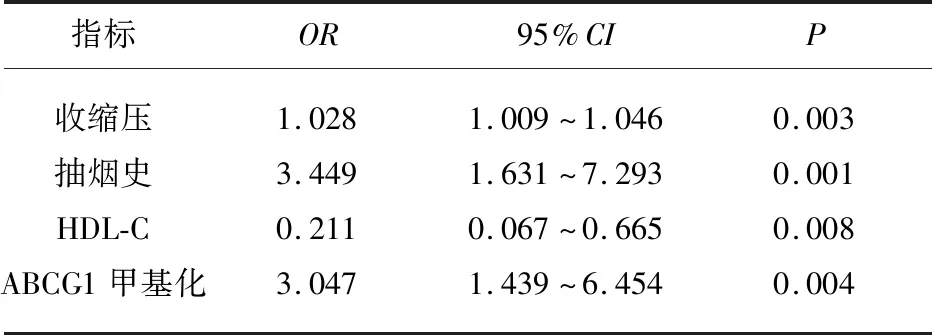
表3 急性腦梗死發病危險因素的Logistic 回歸分析
3 討 論
本研究選取急性腦梗死患者84例(病例組)與同期來我科就診的非腦梗死患者90例(對照組),檢測病例組與對照組外周血中的ABCG1基因啟動子區甲基化的表達情況,同時探討其與腦梗死的相關性。結果顯示:一般資料對比顯示,病例組相較對照組,血壓、吸煙史、空腹血糖以及HDL-C之間,存在統計學差異。病例組的ABCG1啟動子區甲基化陽性率為78.6%;對照組甲基化陽性率為47.8%,前者明顯升高。腦梗死與吸煙、血壓、空腹血糖、ABCG1基因啟動子甲基化陽性均呈正相關,而與HDL-C呈負相關。并且Logistic回歸分析發現:抽煙史、收縮壓、ABCG1基因啟動子區甲基化陽性是腦梗死發病的獨立危險因素,HDL-C為腦梗死發病的獨立保護因素。其中ABCG1基因啟動子區甲基化每增加一倍,急性腦梗死發病率可增加2.959倍(OR=3.047;95%CI1.439~6.454;P=0.004)。
高血壓、糖尿病、血脂異常、吸煙等是腦梗死發病的常見危險因素[4~10],其中,由于動脈粥樣硬化(AS)所導致的大動脈粥樣硬化性腦梗死是腦梗死中常見且重要的一種類型,而血脂代謝異常是動脈粥樣硬化發生發展中的重要環節:當各種理化因素使血管內皮受損后,血液中的低密度脂蛋白可以滲入血管內皮下,并且在血管內膜酶類的作用下發生氧化,進而導致血管內皮細胞黏附分子的激活,從而調節單核細胞進入血管內皮下,分化成巨噬細胞[11],吞噬修飾后的脂蛋白顆粒,最終形成充滿脂肪顆粒的泡沫細胞,導致了動脈粥樣硬化的形成[12]。控制血脂異常有助于預防腦梗死的發生,因此對于如何調控血脂代謝異常仍是腦梗死防治的研究要點。
目前,對于血脂異常的調控,大量的研究集中在基因水平,其中有報道顯示ABCG1參與了血脂代謝的過程,可能對血脂異常起到調控作用。ABCG1基因啟動子區的甲基化與高密度脂蛋白膽固醇(high density lipoprotein cholesferol,HDL-C)呈負相關,ABCG1能夠促進細胞內的膽固醇流出,并與HDL-2、HDL-3、成熟HDL-C和其他富含脂質的載脂蛋白結合,在去除多余膽固醇的過程中起著重要的作用。ABCG1通過增加細胞內、外層之間膽固醇的運動來增強巨噬細胞的趨化性,最終使 HDL-C的作用加強從而促進AS的逆轉,所以可以通過改變DNA甲基化的狀態調節脂代謝紊亂,從而減緩 AS形成。
三磷酸腺苷結合盒(ATP-binding cassette,ABC)轉運體是一類保守的跨膜蛋白,通過與ATP的結合、介導膽固醇從外周組織巨噬細胞中的流出。三磷酸腺苷結合盒轉運體 G1(ATP-binding cassette G1,ABCG1)是ABCG家族的跨膜半轉運體[13,14],ABCG1在巨噬細胞中高表達,介導胞內膽固醇(尤其是氧化固醇)向HDL轉運,維持細胞內外脂質的平衡[15],最終使 HDL的作用加強從而促進AS的逆轉,減緩AS形成。
DNA甲基化(DNA methylation)是在DNA甲基化轉移酶的作用下,不改變DNA序列的情況下,對生物體的基因組功能進行調控,DNA甲基化是一種常見的表觀遺傳修飾,CpG 二核苷酸序列中的碳-5位置被甲基修飾,影響基因的表達,抑制調控基因的活性[16,17]。因此,ABCG1可能通過甲基化修飾來調節特異性基因的表達,引起動脈粥樣硬化,從而導致腦梗死的發生。本研究采用的DNA甲基化檢測方法為MSP法,相較于基因測序,該方法簡便、經濟,適合大樣本檢測。
已有動物研究表明,缺乏ABCG1的小鼠可出現膽固醇在巨噬細胞和肝細胞大量積累[18]。ABCG1在巨噬細胞中呈高表達,并在巨噬細胞的膽固醇逆轉運過程中起關鍵作用。12/15-LOX基因啟動子區甲基化可調控大鼠的AS的形成[19],而在AS的發生發展中,TFPI-2基因的甲基化修飾,可能導致斑塊的快速進展,同時增加了斑塊的不穩定性,進而可導致腦梗死的發生,維持膽固醇水平的平衡對于AS的發生發展都起到至關重要的作用[20,21]。
有證據顯示,ABCG1的表達可降低HDL和甘油三酯水平,而ABCG1啟動子區甲基化可能通過增加甘油三酯水平,進而導致與血管阻塞相關疾病的發生[22],另外,肥胖及糖尿病均為腦梗死的危險因素,而ABCG1啟動子區甲基化與糖尿病發病呈正相關[23,24]。
在本研究中還發現抽煙史是ACI發病的獨立危險因素(OR3.449;95%CI1.631~7.293;P=0.001),有可能是因為煙草中的尼古丁、一氧化碳及焦油會使內皮細胞受損,引起內皮功能紊亂,進而加速AS的形成,從而引起急性腦梗死的發生。
綜上所述,在急性腦梗死患者中ABCG1基因啟動子區存在DNA甲基化,且與急性腦梗死的發生有關。提示ABCG1基因可以引起脂質代謝紊亂,同時還有可能成為急性腦梗死的發病的獨立危險因素,為急性腦梗死的基因治療和預防提供了新思路。
本實驗的不足之處:在已知疾病中,如糖代謝異常、舒張壓的異常,均為腦梗死發病的危險因素[25,26],本課題未得出此結論,可能與患者通過藥物控制血壓、血糖等情況有關,亦或是樣本量少有關,并且血壓為非連續性檢測所得,僅為入院時兩次血壓結果的均值,因此,有可能會影響研究的結果,在今后的研究中,可以通過擴大樣本量,完善研究方法,進一步證明。

