FOXO1 和FOXO3a 基因靶向轉導對缺氧/復氧小鼠心肌細胞的作用研究
李繼紅 阿爾祖古麗·米爾阿卜杜拉 金曉倩 黃鶯(通訊作者) 馬依彤 馬翔 劉芬 陳邦黨 劉成
(1 新疆醫科大學第一附屬醫院冠心病二科 新疆 烏魯木齊 830054)
(2 新疆心血管病研究所 新疆 烏魯木齊 830054)
心肌梗死是心力衰竭是主要原因之一。研究其發病機制,有助于尋找新的干預措施,來提高預防及治療效率,達到提高患者的生存率及生活質量、改善冠心病心肌梗塞預后的目的。與衰老有關的氧化應激是缺血性心力衰竭的發病機制之一,氧化應激所產生的機體活性氧簇(ROS)促使動脈硬化斑塊破裂,導致冠狀動脈血栓形成;急性心肌梗塞發生時,ROS 會參與到組織損傷反應[1-2]。研究顯示,ROS 的不良作用可能被抗氧化應激反應所抑制,起到改善缺血性心力衰竭預后的作用。叉形頭轉錄因子O 亞族(forkhead box transcription factor O,FoxO)是重要的抗氧化應激調節因子,過表達FOXO1 可以抑制ROS 并減少心肌細胞死亡[3],但轉基因的方法會導致胚胎致死,因此需要尋找合適的載體進行靶向基因轉導。據報道,Fox O1、Fox O3a 及 Fox O4 對維持心功能和調節心臟應力有至關重要的作用[4]。其中,FoxO3a 能夠抑制腫瘤進展,調節血管內皮細胞、心肌細胞及血管平滑肌的生物學功能,同時有明確的抗氧化應激作用,因此,可能可用于心血管疾病的診治。因此本研究擬通過觀察重組腺病毒靶向轉導Fox O1、Fox O3a基因對缺氧/復氧(H/R)心肌細胞的作用,探討其抗氧化作用及由此帶來的細胞功能變化,報告如下。
1.資料與方法
1.1 一般資料
將H9C2 小鼠的心肌細胞先缺氧(H)3h 后,復氧(R)6h,然后建立缺氧/復氧損傷模型;然后隨機分為5 個組:A 組為Control 組,B 組為缺氧/復氧(H/R)組),C 組為缺氧/復氧+FOXO1 組,D 組為缺氧/復氧+FOXO3a 組、E 組為缺氧/復氧+FOXO1+FOXO3a 組。
1.2 方法
1.2.1 檢測細胞中的蛋白表達情況 細胞裂解后進行蛋白定量,20μg/孔,加上樣緩沖液沸水浴后離心取上清上樣,PAGE膠放入電泳槽并加緩沖液,加樣,80V 20min;電泳后膠移入轉膜緩沖液,剪下PVDF 膜,甲醇浸泡3min,水洗2min,剪6 塊濾紙與PVDF 膜,然后在轉膜緩沖液中平衡15min。轉膜裝置設定為恒流200mA,40min。膜洗1 次(放入TBST 中),然后置于麗春紅染色液中,5min 后水洗膜至水變清無色蛋白條帶清晰。5% BSA 室溫封閉1 h,一抗和膜4 ℃中孵育過夜。孵育一抗的膜洗滌(實驗室TBST)3 次后按1 ∶5000 稀釋二抗,與膜37℃孵育1 h。洗滌3 次,于化學發光儀中進行拍照。
1.2.2 氧化應激相關指標活性氧的水平 稀釋好的蛋白0.1ml 加入,4℃放置一夜。次晨,清洗。在已包被好的反應孔加 0.1ml稀釋好的標本,37℃培育1h。將稀釋好的酶標抗體 0.1ml加入到實驗孔,37℃培育0.5 ~1h。把TMB 溶液滴人各反應孔中,培養(在37℃,10 ~30 min)后使用 H2SO4( 0.05ml)終止實驗。對其吸光度OD 值進行測量:調整ELISA 檢測儀波長為450nm,或用波長為410nm 的ABTS 顯色。見圖1。
圖1 組織細胞中T-AOC 能力
1.2.3 檢測細胞凋亡情況 爬片細胞固定(4%多聚甲醛)20 ~30min,進行室溫(用百分之一TritonX-100)通透3 ~5min;滴加100μl DNase I 反應液,37℃30min,并且配制TdT 酶反應液: 37 度避光反應60 min,每個樣本中滴加50μl Streotavidin-Fluorescein 標記液后放入濕盒,37 度避光反應30min,Hoechst 復染細胞核:用pH7.4 的PBS 洗滌3 次,去除PBS 后,加入Hoechst 染液。孵育10min(避光室溫)。鏡下觀察并拍照。
1.2.4 Brdu 法檢測細胞增殖活力 H9C2 細胞以5×104cells/ml細胞數接種于24孔板中,1ml/孔,溫度為37 ℃,培養(在5% CO2培養箱中)24h。對各組細胞進行不同處理,在48h 后終止細胞培養之前,加入BRDU(50μM),37℃孵育40min。吸棄培養液,靜置5min 后吸出液體,重復5 次。甲醇/醋酸固定10min。經固定的玻片空氣干燥,用0.3% H2O2-甲醇30min 滅活內源性氧化酶。用封閉(5%的BSA)。變性核酸5min(100℃的甲酰胺)。冷卻。使用PBS 洗滌,加入抗大鼠BrdU 單抗,4℃過夜孵育。加PBS 洗滌,并重復5 次。加熒光二抗,在37℃中孵育1h。加PBS洗滌,再重復5 次。使用Hoechst 33258 染液孵育30min(室溫避光)后,鏡下觀察拍照保存。
2.結果
2.1 轉染后H9C2 細胞蛋白表達
WB 結果顯示:FOXO1 在B 組表達最低,FOXO1 病毒作用后表達會明顯的上升,且高于A 組;FOXO3a 病毒基本不會影響FOXO1表達;FOXO3a 蛋白在B 組中表達也是會最低,FOXO3a 病毒作用后其表達則會明顯的上升,且高于A 組,FOXO1 病毒對FOXO1 蛋白的表達有一定影響。見圖2。
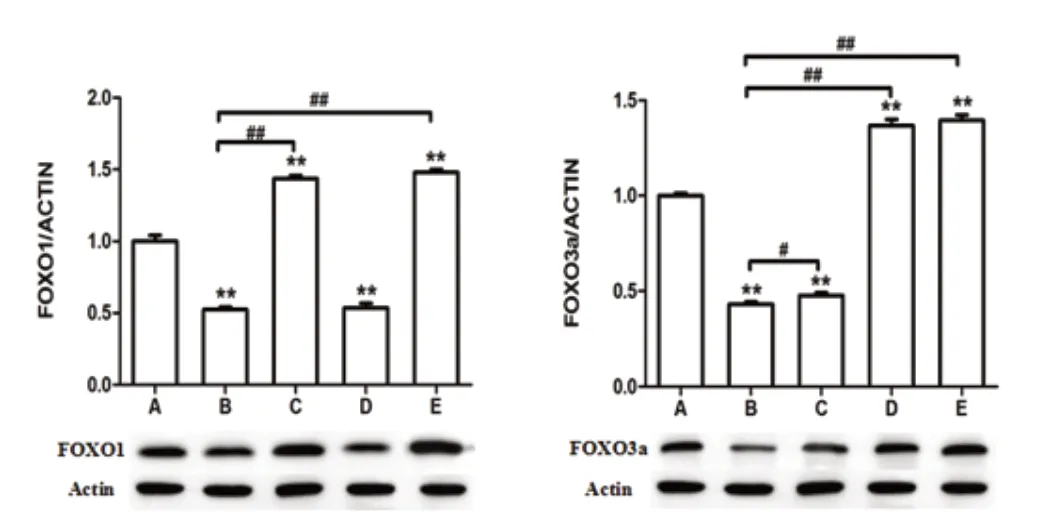
圖2 Western blot 檢測細胞中FOXO1 與FOXO3a 的表達
2.2 FOXO1 與FOXO3a 對H9C2 細胞缺氧/復氧時氧化應激相關指標的影響
ELISA實驗結果提示:SOD與T-AOC活性的表達趨勢基本相同,均為B 組中表達最低。FOXO1 與FOXO3a 基因轉導后表達升高明顯;MDA 含量、ROS 活性及NO 含量檢測趨勢基本相同,均為B 組中表達最高,FOXO1 或/與FOXO3a 基因轉導后表達降低明顯。見圖3。
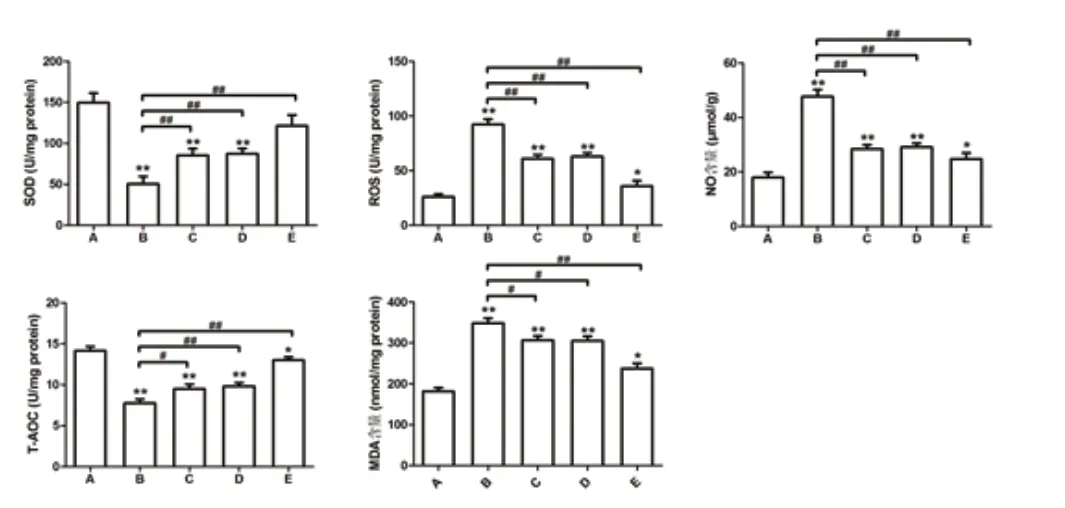
圖3 用ELISA 法檢測細胞氧化應激相關指標的水平
2.3 FOXO1 與FOXO3a 的基因轉導對缺氧/復氧H9C2 細胞凋亡的影響
TUNEL 結果提示:藍光代表正常細胞核,綠光代表凋亡的細胞核;A 組的凋亡是最少的,B 組的凋亡情況最多,C 和D 組的凋亡率顯著低于B組,而E組的凋亡進一步下降,但仍高于A組。見圖4。
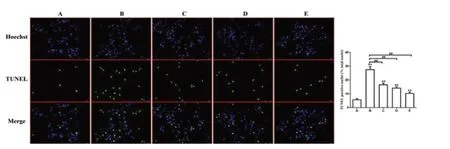
圖4 TUNEL 檢測H9C2 細胞的凋亡情況
2.4 FOXO1 與FOXO3a 基因轉導對于缺氧/復氧H9C2 細胞增殖活力的影響
Brdu 檢測結果提示:藍光代表正常的細胞核,紅光代表增殖的細胞核,A 組的增殖能力顯著高于其他四組;B 組的增殖能力最低;C、D 組的增殖能力要顯著高于B 組,但比A 組低;E 組的增殖能力高于C 組及D 組,比A 組略低。見圖5。
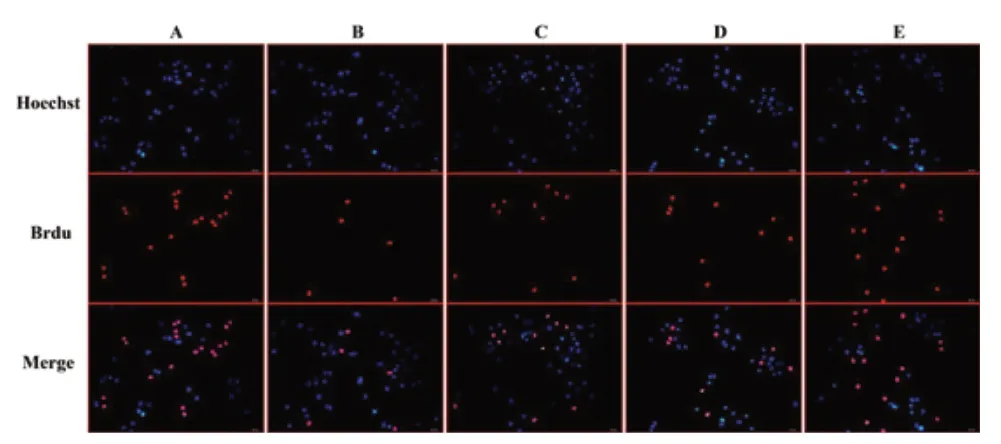
圖5 Brdu 法檢測缺氧/復氧H9C2 細胞的增殖活力
3.討論
目前,缺血性心肌損害已成為心力衰竭的首要病因,而氧化應激反應在心力衰竭的發生及進展中起到了至關重要的作用。FoxO 是重要的抗氧化應激調節因子。既往研究顯示:在肝細胞中,通過上調FOXO1 的蛋白的表達,可抑制裸鼠皮下移植性肝腫瘤的生長[3];成骨細胞中增強FOXO1 的活性可降低Bcl-2 表達,使成骨細胞生長受到抑制。有研究表明,FOXO1 還可激活FasL、CD95、Bim 促凋亡蛋白的表達[5-6],提示了FOXO1 重新激活可能是細胞存活與凋亡的關鍵調節因子之一。而通過調節FOXO3 的表達,能夠阻礙缺血性損傷和心肌梗死患者病情的進展。FoxO3a轉錄因子已被證實可抑制 VSMCs 增殖并有抗氧化應激作用,繼而可能會降低高血壓對機體的影響[7]。心血管疾病中Fox O3a 有保護和損傷的雙重作用,如何更好地利用其調控機制治療心血管疾病值得進一步研究。
本研究顯示,FoxO1、FoxO3a 被重組腺病介導后轉染缺氧/復氧心肌細胞,有效的減少了細胞的凋亡。據此得出結論,FOXO1 與FOXO3a 的基因轉導,減輕了氧化應激反應對H9C2 心肌細胞的損傷。H9C2 心肌細胞的增殖、存活能力明顯的改善。此研究結果,為缺血性心臟病心力衰竭的基因治療提供了新的研究數據,并開拓了新的研究領域,為藥物研究提供了新的靶點。

