“新篩”干血斑在耳聾基因檢測中的應用
高 鵬, 覃詩琪, 唐美芳
(1.武漢華大醫學檢驗所有限公司技術中心,湖北 武漢 430074;2.中國科學院大學華大教育中心,廣東 深圳 518083)
目前,干血斑除被廣泛應用于各種新生兒遺傳代謝病篩查(“新篩”)檢測,在基于飛行質譜或測序平臺的人乳頭瘤病毒(human papillomavirus,HPV)、耳聾、地中海貧血等基因檢測領域也有所應用。我國每年有1‰~3‰的新生兒存在聽力損失,而其中約50%因遺傳導致[1],新生兒耳聾基因檢測對指導和干預遲發性和藥物性耳聾具有重要意義[2]。目前,“新篩”在我國東部地區已實現普及,西部地區的普及率也快速提高,部分地區的“新篩”費用已被納入各類醫保體系中[3]。因此,通常需要處理大量需要同時做“新篩”和耳聾基因檢測的干血斑樣本,因此同一個采血卡樣本會被反復打孔取樣以完成不同類型的檢測,極大地增加了試驗人員的工作量,甚至會出現因頻繁取樣使樣本不足而無法完成檢測的現象,為疾病篩查帶來諸多不便。
“新篩”需要提取血斑中的氨基酸和肉堿等胞外物質,耳聾基因檢測需要提取細胞內的核酸,兩者的目標檢測物及其分布場所互不相同,因此本研究提出按先后順序依次提取同一個干血斑中胞外和胞內產物,提取產物分別用于“新篩”和耳聾檢測。然而,基于串聯質譜的“新篩”檢測通常先用甲醇提取干血斑中的代謝產物[4],而甲醇可穩固細胞結構[5],使細胞裂解的難度增大,給后續耳聾基因提取帶來一定困難。因此,為避免反復取樣,本研究在堿水煮沸法提取干血斑DNA的基礎上進一步優化提取條件,以期實現用1個血斑先后完成“新篩”和耳聾的產物提取和檢測,從而提高篩查中心的檢測效率,促進自動化檢測平臺的搭建。
1 材料和方法
1.1 研究對象
收集2018年9—11月江縣人民醫院、貞豐縣婦幼保健計劃生育服務中心和汝州市婦幼保健院用采血卡采集的出生24~72 h內的新生兒足跟血樣本28例,其中陽性樣本8例,陰性樣本20例。主要檢測包括耳聾基因GJB2、GJB3、12S rRNA、PDS在內的20個相關基因位點。測試通過華大基因生命倫理評估,并與新生兒家屬簽訂知情同意書。
1.2 方法
1.2.1 驗證用現有方法提取“新篩”干血斑DNA的效果 現有提取方法:用打孔鉗打取直徑為3.20 mm的干血斑,加入100 μL無菌水洗滌血斑后去除上清,加入120 μL pH值為10的堿水,并在100 ℃條件下孵育12 min。實驗組用該方法提取“新篩”干血斑中的核酸,對照組為用該方法提取同一樣本的新鮮血斑的核酸,每組完成6個重復。用QubitTM dsDNA HS Asaay Kit(美國Invitrogen公司)檢測提取的DNA濃度。將提取產物進行多重聚合酶鏈反應(polymerase chain reaction,PCR)獲得1975G>C、1174A>T、1226G>A、2027T>A、235delC、IVS7-2A>G、1494C>T、281C>T、1555A>G、299_300delAT、167delT、2162C>T、176_191del16、1229C>T、538C>T、2168A>G、547G>A、IVS15+5G>A、589G>A靶序列產物,酶解去除體系中多余的脫氧核糖核苷酸,加入單核苷酸多態性(single nucleotide polymorphism,SNP)序列特異延伸引物,在SNP位點上延伸1個與突變位點互補的堿基,將產物進行陽離子交換樹脂純化和飛行質譜檢測,質譜儀器為MassARRAY Analyzer 4(美國Agena Bioscience公司),比對2個組核酸提取濃度以及質譜檢測情況。
1.2.2 測試堿水pH值和甲醇對“新篩”干血斑DNA提取和檢測的影響 將“新篩”干血斑用120 μL pH值分別為9、10、11、12 4個梯度的堿水煮沸12 min,每個梯度重復6次。此外,每個樣本補充1組提取前通過水洗去除干血斑上殘留的甲醇、氨基酸和肉堿等雜質的對照,用于研究干血斑上殘留的雜質對DNA提取以及最終檢測結果的影響。檢測所有樣本的提取濃度和質譜結果。
1.2.3 測試堿水體積對“新篩”干血斑DNA提取和檢測的影響 分別用60、70、80、90 μL的上述實驗確定的最佳pH值的堿水提取“新篩”干血斑DNA并進行質譜檢測,每個體積梯度完成4個平行測試;另用120 μL pH值為10的堿水從新鮮血斑中提取DNA并進行質譜檢測,并以此為對照。綜合pH值梯度測試情況確定出針對“新篩”干血斑進行DNA提取的優化方案。
1.2.4 驗證優化方案對不同陽性、陰性樣本的提取和檢測情況 選取已知為雜合陽性、純合陽性、弱陽性、復合陽性、疑似雜合陽性實為陰性、陰性的6種臨床檢測中出現過的樣本,每種類型的樣本各選取2例,按優化方案進行DNA提取,對照用120 μL pH值為10的堿水從新鮮血斑中提取DNA,提取產物經多重PCR和質譜檢測后,分析不同類型樣本DNA的質譜檢測結果。
1.3 統計學方法
采用SPSS 19.0軟件進行獨立樣本t檢驗分析提取濃度差異情況,用Excel 2016軟件分析變量之間的相關性。以P<0.05為差異有統計學意義。
2 結果
2.1 用現有方法提取“新篩”干血斑DNA的結果
現有方法“新篩”干血斑和新鮮血斑核酸提取濃度的差異有統計學意義(t=3.262,P=0.022),該方法下的新鮮血斑的各位點全部被正常檢出,而6例“新篩”干血斑中有4例存在未被檢出的位點。見表1。
2.2 堿水pH值和甲醇等雜質對“新篩”干血斑DNA提取和檢測的影響
干血斑中DNA的提取濃度隨堿水pH值的增大而增大(r=0.906,P=0.094),表明堿性環境有利于細胞破裂釋放核酸(表2)。所有位點與對照的檢測結果完全一致,用pH值分別為9、10、11的堿水提取的產物均僅有1個位點(167delT)的信號響應偏弱,而對照有2個位點信號響應偏弱,表明“新篩”干血斑提取的產物檢測效果優于新鮮血斑。此外,雖然在不洗的情況下,用pH值為12的堿水提取的DNA濃度比用pH值為11的堿水提取的DNA濃度顯著提高(t=4.089,P=0.002),但用pH值為12的堿水提取的產物信號響應弱的基因位點數明顯增多(表2、表3)。用pH值為12的堿水提取的產物的各位點信號響應值整體偏低(圖1)。因此,用pH值為12的堿水提取的產物檢測質量明顯下降,而pH值為11的堿水是提取“新篩”干血斑DNA較理想的條件。
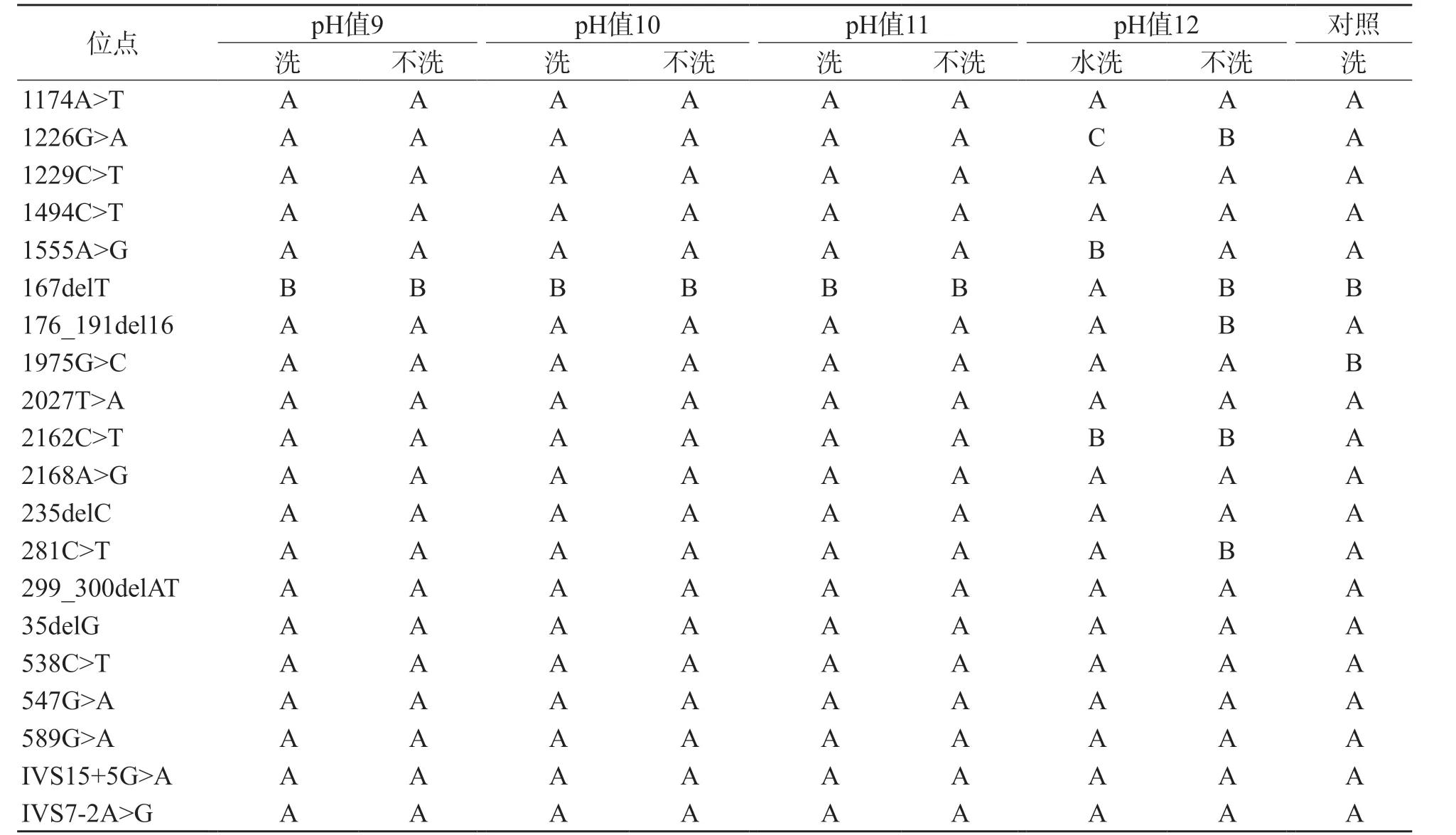
表2 用不同pH值堿水從6個“新篩”干血斑中提取的DNA位點信號強度
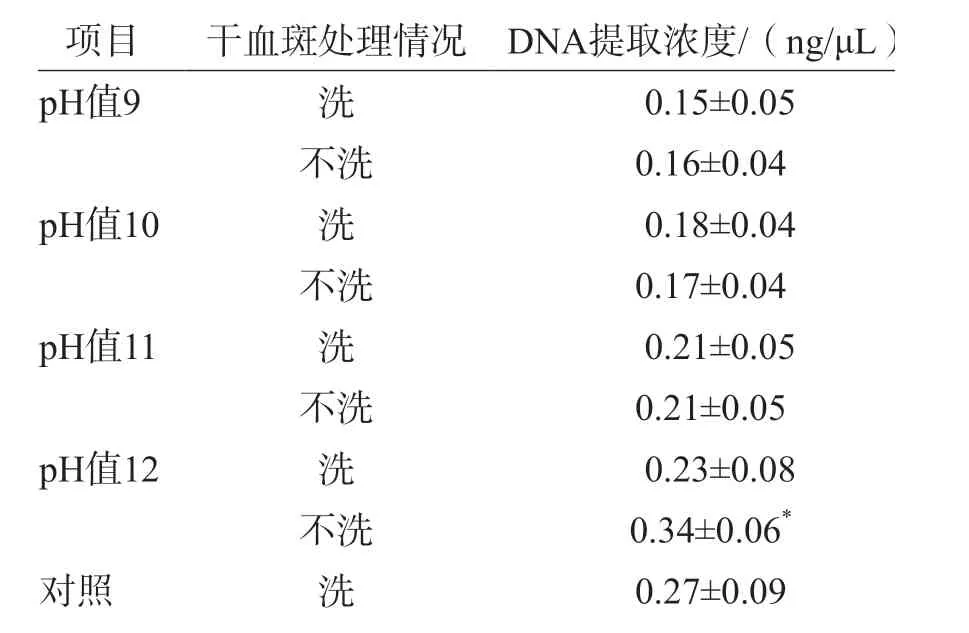
表3 不同pH值堿水從6個“新篩”干血斑中提取的DNA濃度
“新篩”檢測后的干血斑上有甲醇、氨基酸和肉堿等殘留的物質,用pH值為9、10、11的堿水提取DNA前,這些雜質會影響DNA的提取以及酶反應[6]。表3中的提取濃度顯示,對“新篩”干血斑水洗除雜的6組樣本和不水洗的6組樣本的提取濃度之間差異均無統計學意義[pH值9(t=0.350,P=0.733),pH值10(t=0.228,P=0.824),pH值11(t=0.012,P=0.991)]。此外,圖1中的質譜峰圖顯示,對干血斑水洗除雜和不水洗的處理中各位點質譜結果高度一致,表明“新篩”干血斑上的雜質不會顯著影響DNA提取和質譜結果。
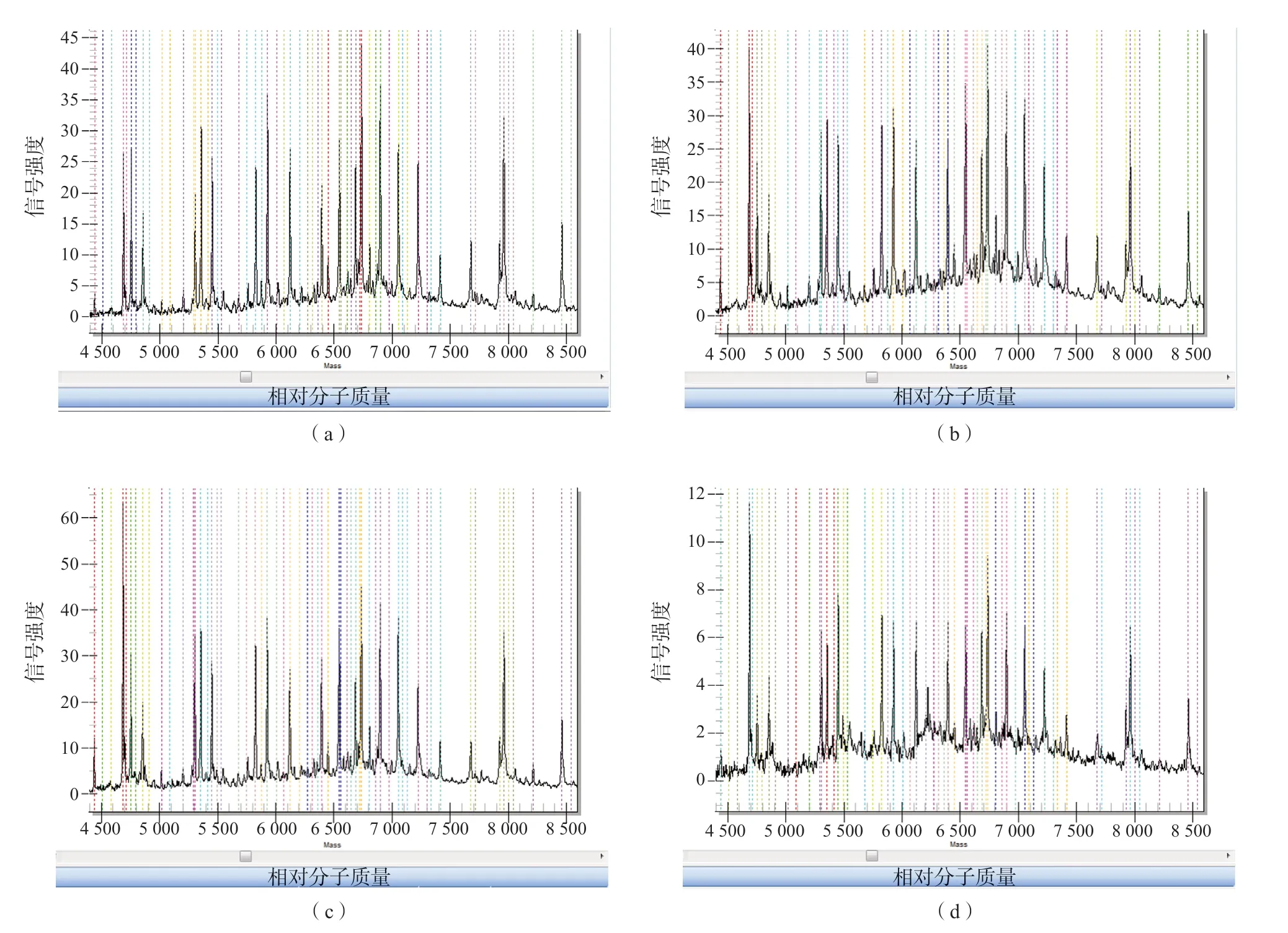
圖1 不同pH值的堿水從“新篩”干血斑中提取的產物的各位點質譜信號響應結果
2.3 堿水體積對“新篩”干血斑DNA提取和檢測結果的影響
當堿水體積分別為60、70、80、90 μL時,“新篩”干血斑的DNA濃度分別為(0.34±0.08)、(0.30±0.09)、(0.26±0.08)、(0.24±0.05)ng/μL,用不同堿水體積提取的DNA濃度差異有統計學意義(P<0.05)。堿水體積為80 μL時,提取的“新篩”干血斑的DNA濃度與對照[(0.25±0.08)ng/μL]比較,差異無統計學意義(P>0.05)。用60、70、80 μL堿水提取的DNA的各位點質譜結果與對照完全一致。如圖2(a)所示,用90 μL堿水從樣本1~4中提取的DNA產物的547G>A位點,因信號響應極弱而未被檢出;圖2(b)顯示同一樣本的新鮮血斑的547G>A位點雖然被檢出,但信號響應同樣較弱,表明該樣本的547G>A位點本身較難被檢出。對含有較難被檢出的位點的樣本,用體積超過90 μL的堿水從“新篩”干血斑中提取總DNA進行耳聾基因檢測時,檢測失敗的風險增大;圖2(c)為其他樣本新鮮血斑的547G>A位點峰圖,可見信號響應較強,此時引物峰較低,表明引物峰和產物峰的信號響應強度的比值可影響儀器的判讀結果。80 μL pH值為11的堿水是提取“新篩”干血斑DNA的較理想的條件。
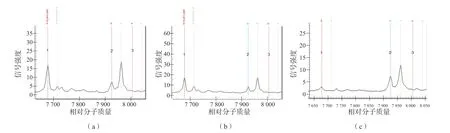
圖2 547G>A位點引物峰和產物峰信號強度的關系
2.4 優化方案對不同陽性及陰性樣本的提取和檢測情況
優化方案下“新篩”干血斑分別為0.26和0.28 ng/μL,兩者之間差異無統計學意義(t=0.617,P=0.545)。此外,表4顯示,所有類型的樣本的質譜結果和對照一致,其中對照中12個新鮮血斑所有位點的總未檢出率為1.0%,而“新篩”干血斑為0.5%,表明優化方案從干血斑中提取的產物檢測結果優于從對照中提取的產物的檢測結果。
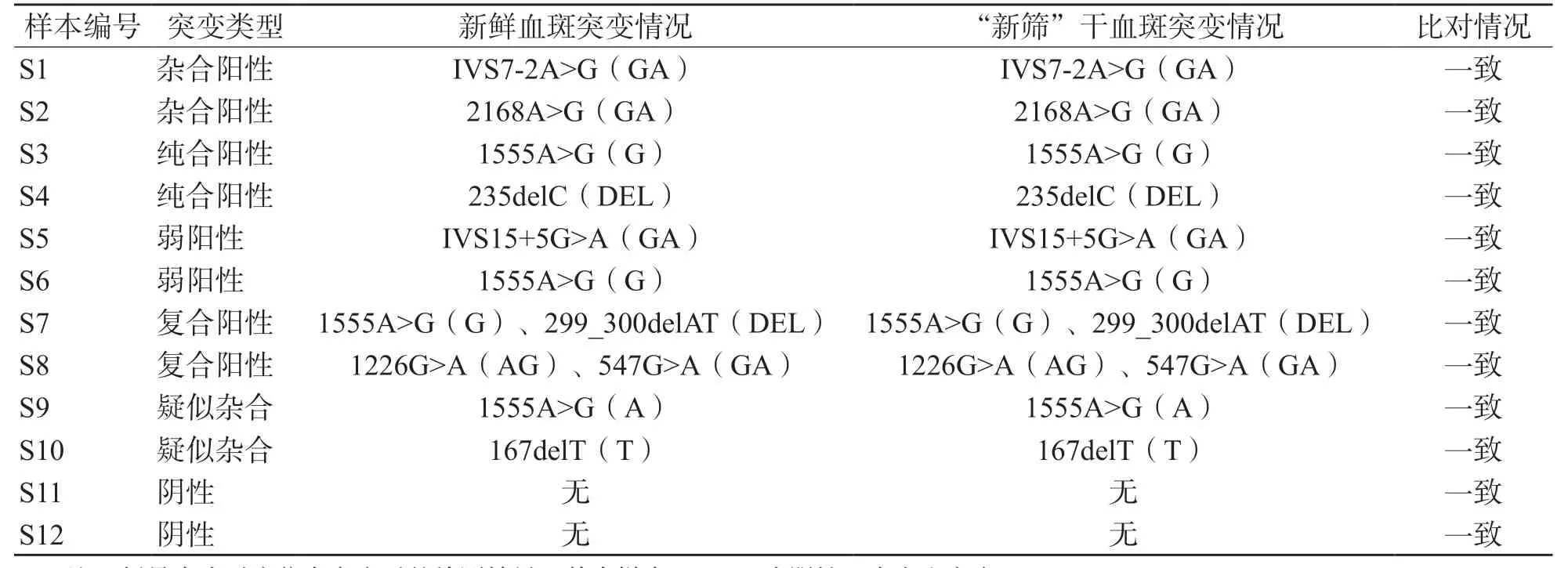
表4 優化方案下不同突變類型的2種血斑的質譜檢測情況
3 討論
水洗“新篩”干血斑可去除大部分甲醇、鹽離子、氨基酸和肉堿等雜質,有利于后續的提取和擴增反應。本研究結果顯示,pH值為9、10、11 時,水洗和不水洗干血斑均不影響DNA提取濃度,而pH值為12時不水洗和水洗處理的DNA提取濃度間差異有統計學意義(t=2.620,P=0.026),導致這種現象的因素有待進一步實驗加以探明。此外,用pH值為12的堿水提取時,DNA濃度雖高,但樣本的各位點信號響應值均較低,而在擴增時模板的體積占整個體系的20%,模板可能導致擴增體系堿性偏大,進而抑制體系中酶的反應效率[7],最終導致檢測結果有偏差。
在擴增反應中,引物二聚體的形成和非特異性擴增是限制PCR敏感性的重要因素[8],引物用量大、片段長等一些特殊因素會使擴增體系出現大量引物二聚體[9],導致目標序列擴增產量降低,目前針對引物二聚體的形成因素已經產生了包括用熱啟動酶在內的許多嘗試[10]。從圖2可以看出:547G>A位點信號響應值低時,引物峰高而產物峰低;而該位點響應值高時,對應的產物峰高而引物峰低。質譜峰圖信號強度與體系中對應的產物的含量呈正相關,引物峰高表明在擴增過程中產生了大量的引物二聚體。本研究發現,用60、70、80 μL堿水提取DNA時各位點信號響應正常,用90 μL堿水提取DNA時547G>A位點未被檢出,而用90 μL堿水提取的DNA濃度也最低。因此,擴增模板量低可能是形成引物二聚體的一個重要因素[11],即模板DNA濃度偏低造成547G>A位點基因與引物分子碰撞結合的概率降低,引物自身結合概率相對增大并形成二聚體,二聚體進一步競爭結合酶、脫氧核糖核苷酸等,最終導致547G>A位點基因擴增產量不足。
隨著我國鼓勵生育政策的持續推廣,以及醫保體系的快速覆蓋[12],新生兒數量在未來一段時期內會不斷增長,而包括“新篩”在內的許多其他篩查項目也會逐步被納入醫保范圍,“新篩”也將覆蓋更多的地區和人群。然而,基于我國較大的人口基數,各地的篩查中心將迎來龐大的“新篩”樣本量,尤其是在人口密集且醫療條件相對滯后的地區,篩查中心將面臨高負荷的運營狀態。因此,在保證篩查質量的同時,簡化流程和引進自動化設備,從而提升篩查效率將成為未來的發展趨勢。本研究用同一干血斑先后完成“新篩”和耳聾基因檢測,一定程度上縮短了耳聾檢測周期,同時減輕了取樣環節帶來的較大工作負擔。此外,在完成耳聾基因檢測后,從“新篩”干血斑中提取的DNA仍有大量剩余,在后期仍有用于其他類型基因檢測的潛力。

