幽門螺桿菌Tipα蛋白經激活NF-kB對巨噬細胞分泌細胞因子誘導機制分析
李杰,熊禮杭,嚴潔
(1永州職業技術學院,湖南 永州 425100;2.永州職業技術學院附屬醫院,湖南 永州 425100)
0 引言
有研究發現,重組Tipα蛋白(rTipα)經激活NF-kB會誘導THP-1細胞產生分泌IL-1β以及IL-6細胞因子。而IL-1β以及IL-6細胞因子在THP-1細胞中的生產與分泌均與激活酶半胱天冬酶-1(Caspase-1)活化相關,Caspase-1活化過程受胞漿內多蛋白復合體NLRP3炎性小體的調控[1]。本研究以探討幽門螺桿菌Tipα蛋白經激活NF-kB對巨噬細胞分泌細胞因子誘導機制。探究幽門螺桿菌持續性感染以及對導致發生胃黏膜炎癥反應機制提供參考依據。
1 材料與方法
1.1 一般材料
菌株選擇E.coli BL21菌株,載體選擇pET-30a(+),THP-1細胞、H.pylori-26695標準株為本研究保存樣本。選用細菌基因組提取試劑盒及配套試劑,DNA快速純化試劑盒及配套試劑,BCA蛋白濃度檢測試劑盒及配套試劑,高純質粒小提取試劑盒及配套試劑,康為世紀公司生產ECL化學發光顯色試劑盒及配套試劑,廈門市鱟試劑實驗廠生產去內毒素試劑盒,欣博盛生物科技有限公司生產人TNF-α、人IL-1β以及人IL-6的ELISA檢測試劑盒及配套試劑。
1.2 主要試劑
Tipα蛋白目的基因引物;康為公司生產Supper DNA Marker,Dye公司生產2×Es Taq MasterMix;Thermo公司生產Barn-HI限制性內切酶、Xho-I限制性內切酶以及T4連接酶;鼠抗His、兔抗β-actin、兔抗Caspase-1、羊抗鼠IgG(+)HRP、羊抗兔IgG(+)HRP以及兔抗NLRP3 p20亞單位抗體;10%濃度胎牛血清;碧云天生物公司生產PDTC;Fermentas公司生產蛋白預染Mark-er、RI-PA緩沖液、LPS、N-乙酰半胱氨酸(NAC)、多黏菌素B、兩性霉素B、萬古霉素以及三甲氧芐氨嘧啶(TMP)[2]。
1.3 對Tipα重組蛋白的鑒定及純化處理
將Tipα重組蛋白置于1 mmol/L濃度的IPTG,于30℃溫度下進行誘導表達4 h,經Western Blot對表達結果進行鑒定,通過His純化樹脂對重組蛋白進行去內毒素純化處理。
1.4 對THP-1的細胞培養及建立模型
應用胎牛血清制作RPMI-1640培養基,對THP-1細胞進行培養,并且通過PMA誘導分化巨噬細胞。分別用0-200 μg/mL的Tipα重組純化蛋白激活細胞,設置200 ng/mL的LPS作為陽性結果對照組、設置PBS作為陰性結果對照組,對每組均設置3個復孔,置于37℃的恒溫培養箱當中分別培養0-24 h,取各孔的上清液進行試驗
1.5 ELISA法與Western Blot檢測
ELISA法檢測TNF-α、IL-1β以及IL-6等 炎癥細胞因子的表達水平,對預處理前后的Tipα誘導細胞的促炎細胞因子水平進行檢測對比,通過Western Blot法對NLRP3、Caspase-1分子表達水平進行檢測。ELISA法與Western Blot檢測依據各檢測試劑盒操作說明書進行規范操作[3]。
1.6 統計學處理
數據通過SPSS 16.0進行分析。
2 結果
不同濃度Tipα蛋白誘導巨噬細胞在24 h時的TNF-α、IL-1β以及IL-6表達水平不同。隨Tipα蛋白濃度提高,TNF-α、IL-1β以及IL-6表達水平也相應提高,當Tipα含量增加至200μg/ mL時,尚未有明顯細胞毒性出現,見表1。
3 討論
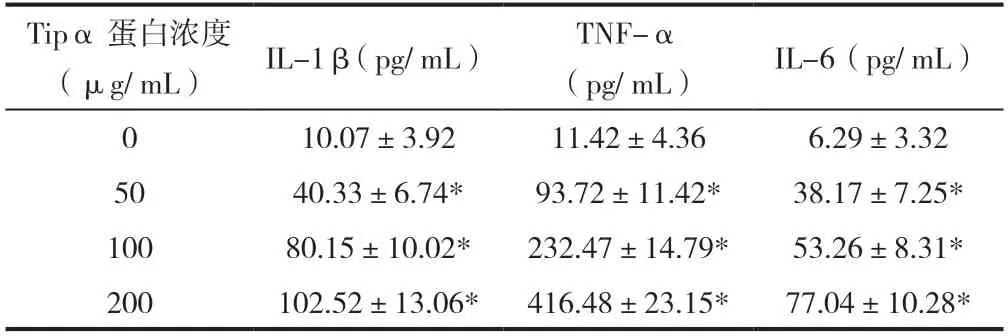
表1 不同濃度Tipα蛋白誘導TNF-α、IL-1β以及IL-6表達水平
本研究通過分子克隆技術,以Hp基因組DNA作模板,對 Tipα基因的原核表達載體pET30a-Tipα進行構建,再經PCR、位點酶切以及基因測序后驗證插入Tipα基因的序列與Genebank的基因序列相符,確保純化所得到蛋白是Tipα蛋白[4-6]。而在蛋白的提純及純化過程當中,菌內毒素污染是常見的問題,尤其對于巨噬細胞而言,即使是極低劑量的內毒素都可即可促使其分泌出高水平炎癥因子,導致蛋白的自身作用被掩飾。在本研究中,對純化后蛋白進行去內毒素處理。對細胞因子的分泌水平進行檢測時,也采通過多黏菌素B作為對照。研究提示多黏菌素B對LPS誘導的巨噬細胞分泌TNF-α產生顯著抑制作用(P<0.05)。對于Tipα誘導所產生TNF-α則無明顯的影響(P>0.05)。為驗證Tipα蛋白對誘導巨噬細胞分泌炎癥因子能力,本研究以不同劑量的經去內毒素處理Tipα蛋白刺激THP-1源性巨噬細胞,通過ELISA法檢測,在30-200μg/mL濃度范圍內,Tipα蛋白濃度提高,TNF-α、IL-1β以及IL-6表達水平也相應提高,當Tipα含量增加至200μg/mL時,尚未有明顯細胞毒性出現。研究提示,Tipα蛋白可在一定程度上起到誘導THP-1細胞產生并分泌TNF-α、IL-1β以及IL-6。
綜上所述,研究初步表明Tipα蛋白經激活NF-κB誘導巨噬細胞產生TNF-α、IL-1β以及IL-6等炎癥因子。

