栝樓桂枝湯通過抑制小膠質細胞活化改善大鼠腦缺血/再灌注損傷
謝風帆,張玉琴,賴文芳,陳亞萍,程偉能,南麗紅,黃 枚
(福建中醫藥大學藥學院,福建 福州 350122)
腦卒中是一種急性腦血管疾病,據其發病機制可分為缺血性腦卒中和出血性腦卒中,其中缺血性腦卒中占腦卒中病例數的80%。缺血性腦卒中是由于腦的供血動脈狹窄或閉塞,腦供血不足導致的腦組織缺血性壞死。目前研究認為,腦缺血后的急性炎癥反應是導致腦組織損傷加劇的重要因素,對腦缺血后神經元細胞死亡和神經重構具有重要影響[1]。小膠質細胞是大腦組織中固有的免疫細胞,其在腦卒中后的迅速激活是啟動腦缺血炎癥反應的關鍵[2],因此,抑制小膠質細胞的過度激活及其引起的一系列反應是缺血性腦卒中重要的治療靶點。最新研究發現,神經元與小膠質細胞存在相互作用,小膠質細胞的活化程度受到神經元的嚴密調控[3]。近期的研究發現,神經元也可以釋放趨化因子[4],在缺血性腦損傷發生后,受損的神經元表達的趨化因子是神經元-小膠質細胞信號傳導中的重要介質。趨化因子21(chemokine ligand 21,CCL21)是神經元表達的重要趨化因子,其與小膠質細胞上表達的趨化因子受體3(chemokine receptor 3,CXCR3)結合,可激活小膠質細胞,是參與神經元-小膠質細胞信號通路的重要環節[5]。腫瘤壞死因子樣弱凋亡誘導因子(tumor necrosis factor-like weak inducer of apoptosis,TWEAK)/成纖維細胞生長因子誘導型14(fibroblast growth factor-inducible immediate-early response protein 14,Fn14)信號通路可通過激活NF-κB非經典信號途徑,上調神經元CCL21的表達,以此促進小膠質細胞激活,進一步加重腦損傷[6-8]。
栝樓桂枝湯(gua lou guizhi decoction,GLGZD)出自東漢末年張仲景《金匱要略》,現臨床用于治療腦卒中后肢體痙攣,療效顯著[9]。目前認為,腦卒中后肢體痙攣是腦缺血后上運動神經元損傷所致,而凋亡是腦缺血引起選擇性神經元丟失的一種重要形式[10]。課題組前期研究發現,GLGZD可通過調控多條信號通路產生抗凋亡、抗炎等作用,以此來發揮神經保護作用[11-12]。但作用機制尚未完全闡明,故本研究以神經元與小膠質細胞在缺血性腦損傷中的相互作用為切入點,研究GLGZD是否通過TWEAK/Fn14/CCL21/CXCR3信號通路調控小膠質細胞的活化,以此來探索GLGZD緩解腦卒中后肢體痙攣的可能機制。
1 材料
1.1 實驗動物SPF級♂SD大鼠72只,體質量(260±10)g,購自上海斯萊克實驗動物責任有限公司,許可證號:SCXK(滬)2017-0005,合格證號:2015000547928。并于福建中醫藥大學實驗動物中心飼養,合格證:SYXK(閩)2014-0001。
1.2 實驗藥物白芍(廈門燕來福制藥有限公司,批號:180803)、天花粉(亳州市中藥飲片廠,批號:1712028183)、桂枝(隴西聚善堂中藥材實業有限公司,批號:20130110)、甘草(廈門燕來福制藥有限公司,批號:180530)、大棗(福建承創堂藥店)、生姜(福建承創堂藥店)、尼莫地平(湖北百草制藥有限公司,批號:170602)。
1.3 實驗試劑DeadEndTMFluorometric TUNEL System(美國Promega公司,貨號:G3250);RNA isolater(南京Vazyme生物科技有限公司,貨號:7E261K8);HiScript Q RT SuperMix for PCR(南京Vazyme生物科技有限公司,貨號:7E281I8);ChamQTM SYBR qPCR Master Mix(南京Vazyme生物科技有限公司,貨號:7E210K8);Anti-TNF alpha antibody(英國abcam公司,貨號:ab6671);Anti-liver Arginase antibody(英國abcam公司,貨號:ab91279);內源性過氧化物酶阻斷液(武漢博士德生物工程有限公司,貨號:AR1108);DAB顯色試劑盒(武漢博士德生物工程有限公司,貨號:AR1022);即用型SABC-POD(小鼠/兔IgG)試劑盒(武漢博士德生物工程有限公司,貨號:SA1020)。
1.4 儀器尼龍線栓(廣州佳靈生物技術有限公司,型號:3600AAA);小動物核磁共振成像儀(MRI,德國BRUKER公司,型號:BioSpec 70/20 USR);生物組織自動脫水機(湖北孝感宏業醫用儀器有限公司,型號:TS-12D);生物組織石蠟包埋機(湖北孝感宏業醫用電子技術有限公司,型號:YB-6LF);生物組織攤烤機(湖北孝感宏業醫用電子技術有限公司,型號:YT-7FB);石蠟切片機(美國Thermo Fisher公司,型號:HM325);光學顯微鏡(德國Leica公司,型號:DM400B LED);倒置熒光顯微鏡(德國Leica公司,型號:DMi8);Termal circle PCR儀(美國Bio-Rad公司,型號:C1000TM);實時熒光定量PCR儀(美國Applied Biosystem公司。型號:ABI 7900)。
2 方法
2.1 制備栝樓桂枝湯GLGZD的處方:天花粉30 g、桂枝9 g、大棗9 g、白芍9 g、生姜9 g、甘草6 g。稱取2個處方量的藥材,放于2 000 mL圓底燒瓶中,加10倍量超純水,浸泡30 min,于冷凝回流裝置中煮沸,并保持微沸提取1.5 h,之后過濾藥液,并于藥渣中加入8倍量超純水,重復以上步驟。合并兩次藥液,高壓旋蒸濃縮至100 mL,即得栝樓桂枝湯高劑量(1.44 g·mL-1)。
2.2 MCAO模型制備用2%戊巴比妥鈉(3 mL·kg-1)腹腔注射麻醉動物,仰臥位固定于鼠板上,頸正中線偏右切口,用鑷子鈍性分離肌肉與筋膜,分離出頸總動脈(common carotid artery,CCA)、頸外動脈(external carotid artery,ECA)、頸內動脈(internal carotid artery,ICA),結扎CCA與ICA,于ICA上掛線備用,并用動脈夾夾閉。用眼科剪在CCA近心端血管壁30°夾角剪一小口,插入線栓至線栓黑點完全進入ICA,2 h后部分抽出線栓實現再灌注,結扎縫合。待大鼠蘇醒后即刻參照改良神經功能缺損評分(modified neurological severity score,mNSS)[13]對大鼠進行神經功能損傷程度的評價,評分>6分者視為造模成功,納入實驗分組。
2.3 分組與給藥將造模成功的大鼠隨機分為5組:MCAO模型組、GLGZD低劑量組(3.6 g·kg-1)、中劑量組(7.2 g·kg-1)、高劑量組(14.4 g·kg-1)、陽性對照組(尼莫地平,6 mg·kg-1),另設一組假手術(Sham)組,每組12只。各組大鼠均在手術當天評分后開始給藥,此后于每天上午9 ∶00給藥,給藥組灌服相應濃度藥物(10 mL·kg-1·d-1),MCAO組與假手術組灌服0.9%生理鹽水(10 mL·kg-1·d-1),連續7 d。
2.4 神經功能缺損評分GLGZD干預7 d后,采用mNSS[13]對各組大鼠進行神經行為學評分,該評分包括運動試驗、感覺試驗、平衡木試驗、反射喪失和不正常運動等四項評估。運動試驗包括提尾試驗(含前肢屈曲、后肢屈曲、頭部在30 s內偏離垂直軸>10°三個指標,每個1分,共3分)和爬行試驗(正常行走計0分,不能直線行走計1分,向輕癱側轉圈計2分,向輕癱側傾倒計3分),感覺試驗包括放置試驗(視覺和觸覺任一存在障礙計1分)和本體感覺試驗(將大鼠朝桌子邊緣輕推,無反抗計1分),平衡木試驗根據大鼠在平衡木上保持平衡的時間評分(<20 s計6分,<40 s計5分,<60 s計4分,>60 s計3分,一肢體從平衡木垂落計2分,緊抱平衡木計1分,穩定平衡姿勢計0分),反射喪失和不正常運動包括耳廓反射(接觸外耳道時不搖頭計1分)、角膜反射(用棉絲輕觸角膜時不眨眼計1分)、驚恐反射(對快彈硬紙板的噪音無運動反應計1分)和肌張力障礙(存在癲癇、肌陣攣或肌張力障礙計1分)。評價等級為0~18,0分為正常無缺陷,18分為最大缺陷。
2.5 小動物核磁共振成像(magnetic resonance imaging,MRI)檢測腦梗死體積實驗采用MRI對大鼠腦部進行T2WI掃描,實驗參數:T2WI采用TSE序列;重復時間:4 200 ms;回聲時間:35 ms;掃描層數:21層;視場:32 mm×32 mm;平均信號數:2;掃描時間:4 m 28 s 800 ms。以ImageJ圖像分析軟件測定大鼠T2WI腦梗死體積。
2.6 組織石蠟切片的制備大鼠末次給藥2 h后用2%戊巴比妥鈉(3 mL·kg-1)腹腔注射麻醉,固定,打開胸腔,用透灌針從左心室插到主動脈,將右心耳剪開。先用生理鹽水推注,直至無血液流出后,再用4%多聚甲醛推注至全身僵硬,斷頭取完整大腦,置于4%多聚甲醛中固定24 h后,取出用超純水清洗,再用大鼠腦模具切成均等6片,進行脫水、石蠟包埋以及切片。
2.7 TUNEL法檢測細胞凋亡率取石蠟切片進行脫蠟復水,清洗后4%多聚甲醛固定10 min,清洗,使用蛋白酶K(稀釋比1 ∶500)處理8 min,平衡緩沖液室溫孵育10 min,滴加50 μL rTdT緩沖液,蓋上塑料蓋玻片,放入濕盒避光并于37 ℃孵育1 h。滴加2×SSC溶液于室溫避光孵育15 min, DAPI染核,抗熒光淬滅封片劑封片,使用熒光倒置顯微鏡于400倍鏡下觀察并拍攝缺血側大腦皮層陽性細胞表達情況,實驗采用ImageJ圖像分析軟件進行統計。
2.8 免疫組織化學法檢測炎癥因子TNF-α的表達水平取石蠟切片進行脫蠟復水,內源性過氧化物酶阻斷液覆蓋10 min,抗原修復,5% BSA封閉2 h,滴加相應一抗(稀釋比1 ∶100),4 ℃冰箱孵育12 h,清洗后滴加相應二抗室溫孵育2 h,清洗,SABC 37 ℃孵育1 h, DAB試劑盒顯影,蘇木素復染,封片,使用熒光倒置顯微鏡于400倍鏡下觀察并拍攝缺血側大腦皮層陽性細胞表達情況,實驗采用ImageJ圖像分析軟件進行統計。
2.9 RT-qPCR 檢測 IBA-1、TWEAK、Fn14、NIK、Rel B、CCL21、CXCR3 mRNA表達末次給藥2 h后,斷頭取大鼠缺血側皮層腦組織,TRIzol法提取總RNA,使用HiScript Q RT SuperMix for PCR試劑盒逆轉錄得到cDNA,再采用ChamQTMSYBR qPCR Master Mix試劑盒檢測IBA-1、TWEAK、Fn14、NIK、Rel B、CCL21、CXCR3 mRNA 表達水平,PCR引物由上海尚亞生物技術有限公司合成,本實驗采用GAPDH為內參基因,各指標的基因相對表達根據2-ΔΔCt計算得到。引物序列見Tab 1。
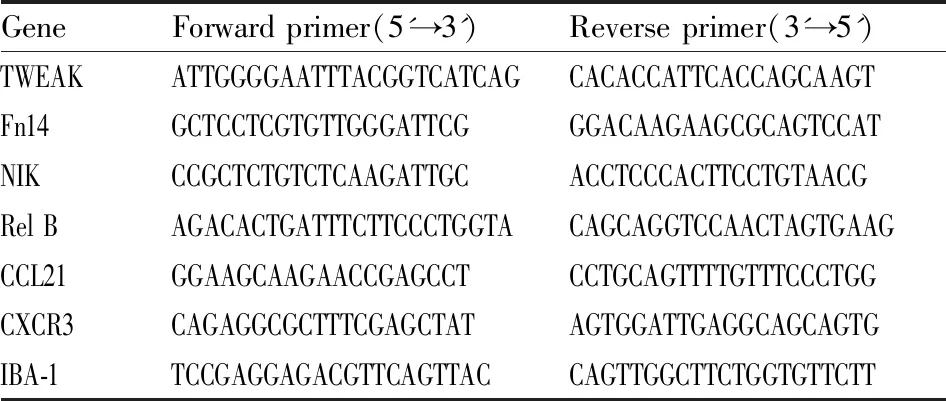
Tab 1 Primers used for quantitative real time PCR
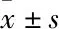
3 結果
3.1 GLGZD對MCAO大鼠神經功能的影響mNSS結果顯示,造模后MCAO大鼠整體神經功能評分均明顯高于Sham組大鼠(P<0.01);經GLGZD干預7 d后,與MCAO組相比,GLGZD-L、 GLGZD-M及GLGZD-H組整體神經功能評分均明顯下降(P<0.01)。見Fig 1。
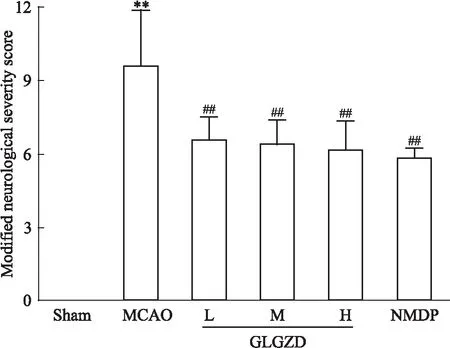
Fig 1 Effects of GLGZD on neurological **P<0.01 vs Sham;##P<0.01 vs MCAO
3.2 GLGZD對MCAO大鼠缺血側腦梗死體積的影響MRI結果顯示,與Sham組相比,MCAO組大鼠缺血側大腦出現大片明顯梗死區域(P<0.01);經GLGZD干預7 d后,各劑量組大鼠缺血側腦梗死體積明顯減少,且差異具有統計學意義(P<0.05或0.01)。見Fig 2。
3.3 GLGZD對MCAO大鼠缺血側大腦皮層組織神經細胞凋亡的影響TUNEL染色結果顯示,與Sham組相比,MCAO組大鼠缺血側大腦皮層TUNEL陽性細胞表達明顯升高,神經細胞凋亡率明顯增高(P<0.01);經GLGZD干預7 d后,各劑量組大鼠缺血側大腦皮層TUNEL陽性細胞數明顯減少,神經細胞凋亡率均有不同程度的降低(P<0.01)。見Fig 3。
Fig 2 Effects of GLGZD on cerebral infarction volume(Part of yellow arrow) in MCAO **P<0.01 vs Sham;#P<0.05 vs MCAO,##P<0.01 vs MCAO
3.4 GLGZD對MCAO大鼠缺血側皮層腦組織中TNF-α表達的影響免疫組織化學法結果顯示,MCAO組較Sham組大鼠缺血側皮層腦組織中TNF-α蛋白表達明顯增加(P<0.01),GLGZD干預7 d后TNF-α蛋白表達明顯減少(P<0.05或0.01)。見Fig 4。
3.5 GLGZD對MCAO大鼠缺血側大腦皮層組織小膠質細胞活化相關因子基因表達的影響RT-qPCR法結果顯示,與Sham組相比,MCAO組大鼠缺血側大腦皮層組織IBA-1、TWEAK、Fn14、NIK、Rel B、CCL21、CXCR3 mRNA表達增加(P<0.01);經GLGZD干預7 d后,各劑量組大鼠缺血側IBA-1、TWEAK、Fn14、NIK、Rel B、CCL21、CXCR3 mRNA表達明顯減少,且差異具有統計學意義(P<0.05或0.01)。見Fig 5。
4 討論
在腦缺血/再灌注損傷的實驗研究中,常采用全腦缺血或者局灶性腦缺血的動物模型,然而在臨床上較為常見的是局灶性腦缺血,且MCAO造成的動物局灶性腦缺血能很好模擬臨床上腦缺血疾病情況,是研究缺血性腦卒中的經典模型[14]。本實驗采用線栓阻斷大鼠大腦中動脈血流后,大鼠mNSS評分、腦梗死體積、神經細胞凋亡率均明顯高于Sham組,提示MCAO模型大鼠制備成功。治療7 d后,GLGZD各劑量組和陽性對照組均能明顯改善模型大鼠運動、感覺、反射、平衡功能,能明顯減少腦梗死體積和抑制缺血側皮層組織中神經細胞的凋亡,且高劑量組療效最為明顯,與陽性對照組相比差異無顯著性,提示GLGZD對腦缺血/再灌注損傷具有較好的保護作用,這一結果也與課題組前期研究相一致[10,11];陽性對照藥物尼莫地平對腦缺血/再灌注損傷亦具有顯著的保護作用,提示本實驗體系可靠,故GLGZD進一步的作用機制研究不再加入陽性對照。
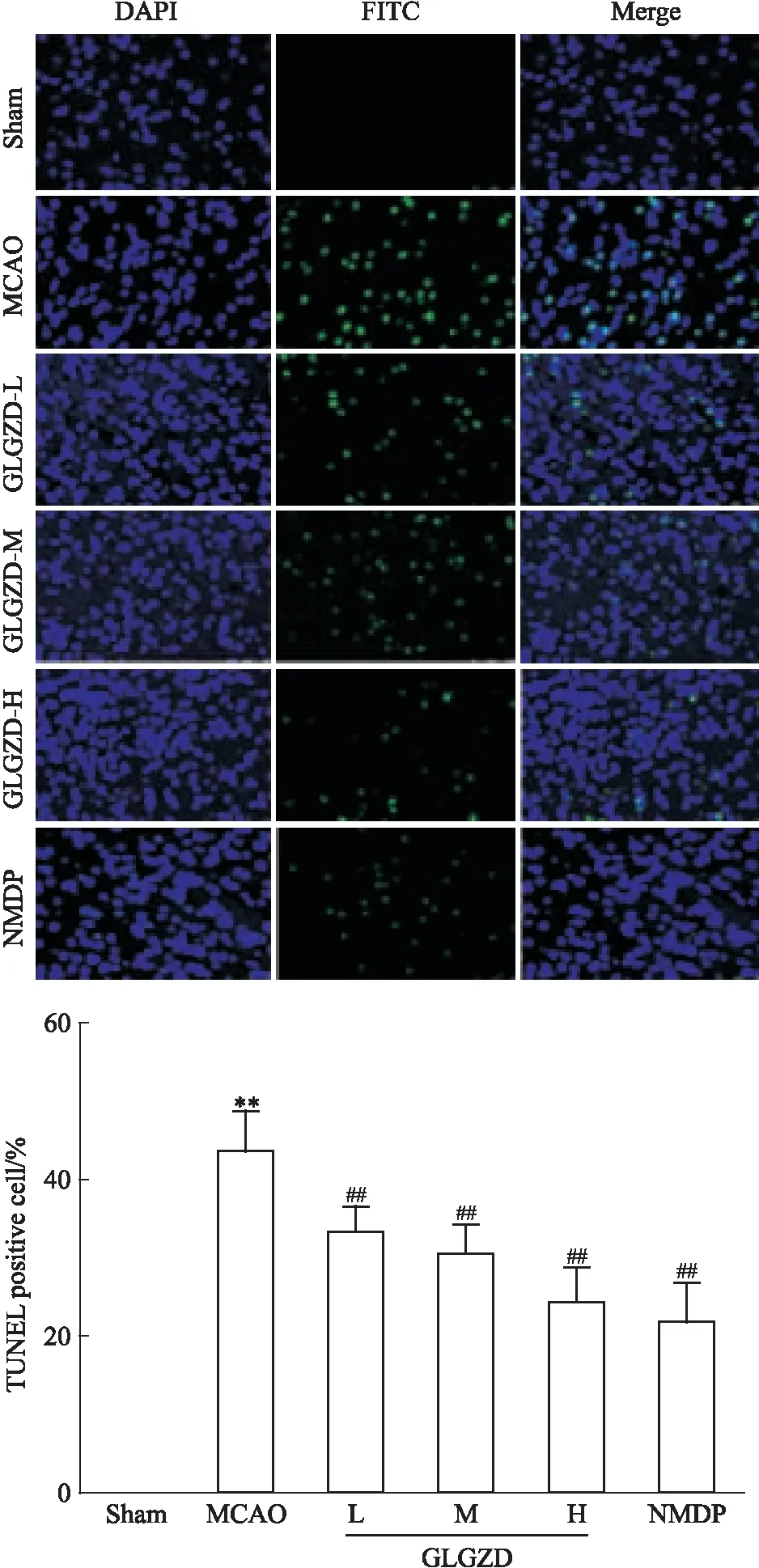
Fig 3 Effects of GLGZD on apoptosis of neurons in cerebral cortex in MCAO **P<0.01 vs Sham;##P<0.01 vs MCAO
缺血性腦卒中因缺血造成神經元死亡,導致原發性腦損傷,并使免疫細胞向細胞外釋放促炎,這些物質可引發一系列炎癥反應,進一步加劇神經細胞損傷,導致繼發性腦損傷[15]。小膠質細胞對神經炎癥有深遠的影響,活化的小膠質細胞通常負責清除壞死的神經細胞和恢復神經功能,然而當小膠質細胞被過度激活時,會大量分泌TNF-α等多種神經炎癥因子,促進周圍神經細胞凋亡,導致神經元進一步受損[16]。本研究發現,與Sham組相比,MCAO大鼠缺血側皮層腦組織中小膠質細胞活化的標志物IBA-1 mRNA和炎癥因子 TNF-α蛋白的表達量均明顯增加,提示腦缺血/再灌注損傷后小膠質細胞大量活化,并釋放大量炎癥因子,誘導神經元凋亡,進一步加重腦組織損傷。干預7 d后,GLGZD各劑量組大鼠缺血側大腦皮層腦組織中IBA-1 mRNA和TNF-α蛋白表達量均明顯的減少,提示GLGZD可抑制小膠質細胞的過度活化,減少炎癥因子的釋放,減輕腦缺血/再灌注損傷后的炎癥反應,從而發揮抗缺血后神經元的凋亡,減輕腦組織損傷的作用。
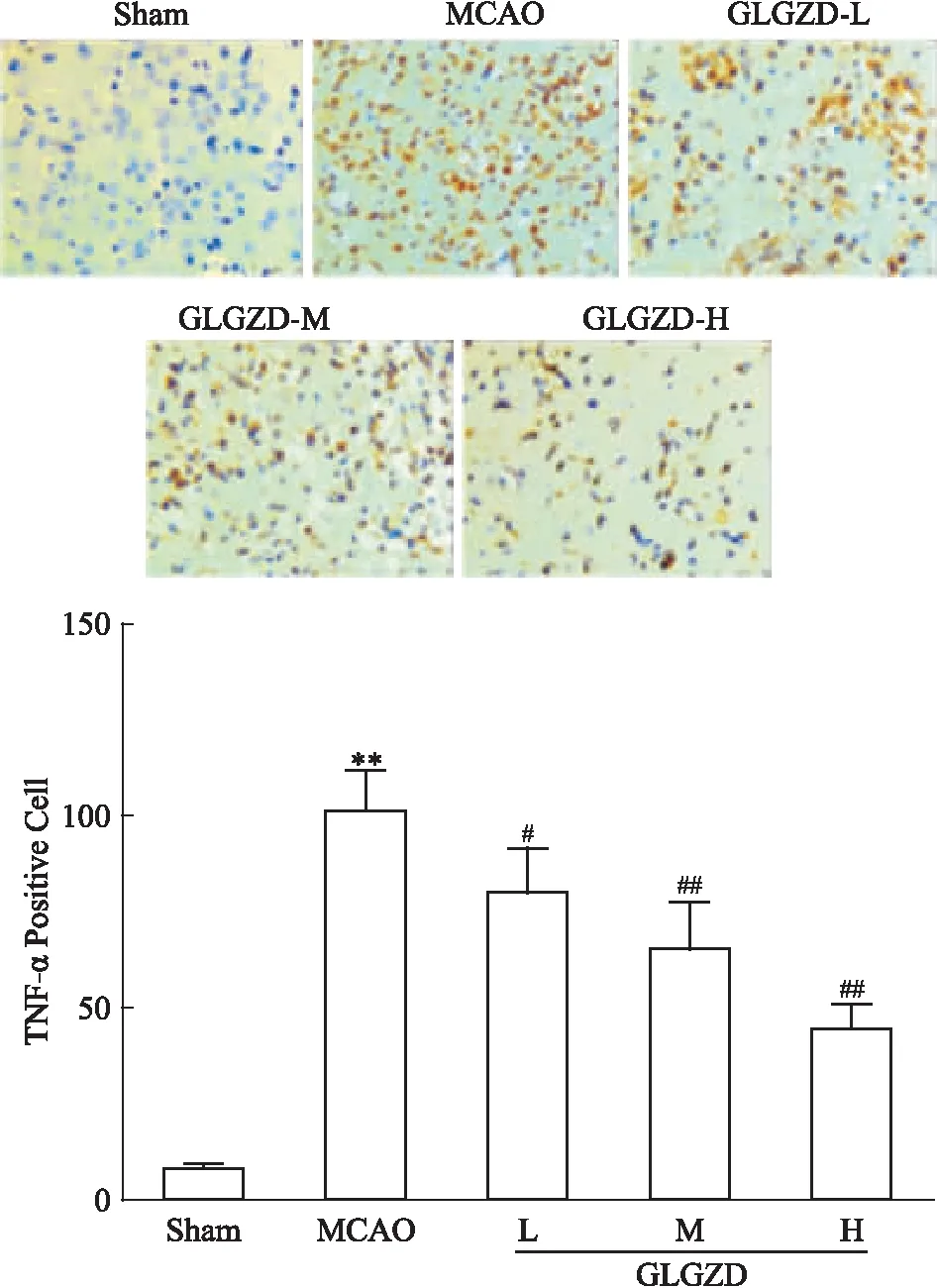
Fig 4 Effects of GLGZD on TNF-α positive cells in cerebral **P<0.01 vs Sham;#P<0.05 vs MCAO, ##P<0.01 vs MCAO
新近研究發現,神經元不僅是小膠質細胞的作用目標,而且是調節小膠質細胞活化的重要參與者,即小膠質細胞的活化程度受到神經元的嚴密調控[17],神經元和小膠質細胞之間存在相互作用。神經元可通過多條信號通路表達大量細胞因子,并與小膠質細胞表面的特異性受體結合介導彼此之間的信號傳導,以此來調控小膠質細胞的活化。其中,TWEAK/Fn14/CCL21/CXCR3信號通路參與神經元-小膠質細胞相互作用,在小膠質細胞活化中發揮重要作用。
最新研究發現,TWEAK與Fn14的結合可增加炎癥細胞的積累和神經元損傷,與腦缺血期間的細胞死亡密切相關[18]。研究指出,在中風后,Fn14在神經元上高表達,并在受TWEAK激活后可抑制細胞質中NF-κB誘導激酶(NF-κB induced kinase,NIK)的降解,而不斷積累的NIK磷酸化抑制性κB激酶(inhibitory kappa B kinase,IKK),繼而使核轉錄因子(nuclear factor kappa-B,NF-κB)p100磷酸化降解成p52,暴露其核定位序列后,與RelB組成異源二聚體轉移進入細胞核內,RelB存在轉錄激活結構域,從而調控靶基因(如趨化因子CCL21等)的表達,進而上調神經元CCL21的表達[6,7]。而上調的CCL21與其小膠質細胞上表達的特異性受體CXCR3結合,持續激活小膠質細胞,使其釋放大量炎性介質,引發并擴大繼發性腦組織損傷[8]。我們采用RT-qPCR檢測結果顯示,MCAO組大鼠缺血側皮層腦組織中神經元-小膠質細胞相互作用的相關因子TWEAK、Fn14、NIK、Rel B、CCL21、CXCR3 mRNA表達量均明顯增多,提示腦缺血/再灌注損傷后引起的小膠質細胞大量活化與TWEAK/Fn14/CCL21/CXCR3信號通路的激活相關,這一結果與文獻報道相一致[6-8],經GLGZD干預7 d后,各劑量組均可不同程度地下調上述因子mRNA的表達,提示GLGZD可通過抑制TWEAK/Fn14/CCL21/CXCR3信號通路,調控神經元-小膠質細胞間相互作用,從而抑制小膠質細胞的過度活化,減輕炎癥反應,發揮腦保護作用。
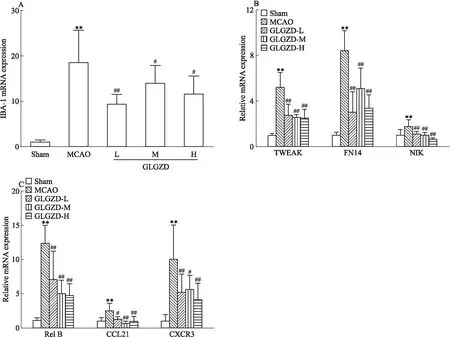
Fig 5 Effects of GLGZD on IBA-1 mRNA(A) and TWEAK, Fn14, NIK mRNA(B) and Rel B, CCL21,CXCR3 mRNA(C) in MCAO vs Sham;#P<0.05,##P<0.01 vs MCAO
綜上所述,GLGZD能顯著改善大鼠腦缺血/再灌注損傷,這一作用可能與其通過影響TWEAK/Fn14/CCL21/CXCR3信號通路,抑制小膠質細胞活化,從而減輕炎癥反應有關。
(致謝:本實驗在福建中醫藥大學藥學院生物醫藥研發中心完成,感謝所有老師及同學的支持與幫助!)

