血清尿酸水平與2 型糖尿病患者胰島素抵抗的相關性研究
王楠楠,逄曙光
(1.山東第一醫科大學(山東省醫學科學院),山東 泰安;2.山東大學附屬濟南市中心醫院內分泌科,山東 濟南)
0 引言
高尿酸血癥(hyperuricemia,HUA) 是嘌呤代謝障礙所致的慢性代謝性疾病,隨著飲食習慣及生活方式的變化,其發病率在逐年增加。高尿酸血癥可能會導致胰島素抵抗,是一個獨立預測因子,而胰島素抵抗使糖酵解過程中血尿酸生成增加,同時通過增加腎臟對尿酸的重吸收直接導致高尿酸血癥,也可作為高尿酸血癥的一種獨立危險因素[1,2]。本研究旨在探討2 型糖尿病(T2DM)患者血尿酸水平與胰島素抵抗的關系,進一步了解T2DM 患者合并高尿酸血癥對患者糖脂代謝的影響。
1 資料與方法
1.1 研究對象
選取2018 年8 月至2019 年10 月于濟南市中心醫院內分泌科住院的T2DM 患者322 例,根據血尿酸水平分為高尿酸組(HUA組,168 例) 及正常尿酸組(NUA 組,154 例)。入選標準:所有患者均符合世界衛生組織(WHO)2006 年修訂的糖尿病診斷標準;高尿酸血癥符合1998 年WHO 提出的診斷標準,男性≥420umol/L,女性≥360umol/L。排除標準:1 型糖尿病及其他類型的糖尿病;糖尿病急性并發癥;嚴重心肺、肝腎功能不全患者;急性大面積腦梗死或腦出血者;嚴重感染、創傷、手術、惡性腫瘤患者;有糖皮質激素使用史及其他內分泌疾病者(如甲狀腺功能亢進或減退);妊娠期婦女;近期使用阿司匹林、利尿劑及降尿酸藥等影響尿酸水平者;長期酗酒者;近3 個月高嘌呤飲食者。
1.2 一般資料及檢測指標
收集受試者病史資料, 包括性別、年齡、飲食習慣、糖尿病病程、飲酒史、用藥史及其他涉及排除標準的疾病史。收集一般人體測量資料, 包括身高、體重、收縮壓(SBP)、舒張壓(DBP), 并計算體重指數 (BMI),BMI=體重(kg)/身高(m)2。所有患者夜間禁食8-10小時后,于次日清晨6:00-7:00 采集空腹靜脈血,主要檢測指標包括空腹血糖(FBG)、糖化血紅蛋白(HbA1c)、空腹C 肽、尿酸(UA)、甘油三脂(TG)、總膽固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、尿素(BUN)、肌酐(Cr)。空腹血糖采用己糖激酶法,空腹C 肽采用放射免疫測定法,生化指標采用羅氏Cobas8000。胰島素抵抗評價采用改良的基于空腹C 肽水平計算的HOMAIR 指數[3],HOMA-IR(cp)=1.5+ 空腹血糖(FBG,mmol/L)× 空腹C肽(pmol/L)/2800。
1.3 統計學方法
采用SPSS 20.0 統計軟件,計量資料先進行正態性檢驗,符合正態分布的資料以±s 表示,非正態分布資料進行對數轉換;經對數轉換仍不能滿足正態分布的以中位數(四分位間距)表示;計數資料采用χ2檢驗;正態分布資料相關性分析采用Pearson 相關分析;非正態分布資料相關性采用Spearman 相關分析;多因素二分類Logistic 回歸分析獨立相關性。P<0.05 為差異有統計學意義。
2 結果
2.1 一般臨床資料分析
兩組年齡、性別、SBP、FBG、HbA1c、LDL-C無統計學差異(P>0.05);HUA 組的DBP、BMI、C 肽、HOMA-IR(cp)、TG、TC、BUN、Cr 均高于NUA 組,差異有統計學意義(P<0.05);HUA 組的糖尿病病程、HDL-C 均低于NUA 組,差異有統計學意義(P<0.05)(表1)。
2.2 相關性分析
血尿酸與SBP、FBG、LDL-C 無明顯相關性(P>0.05);DBP、BMI、C 肽、HOMA-IR(cp)、TG、TC、BUN、Cr 與 血 尿 酸 正 相關(P<0.05);年齡、糖尿病病程、HbA1c、HDL-C 與血尿酸負相關(P<0.05)(表2)。
2.3 回歸分析
以是否合并高尿酸血癥為因變量,以DBP、BMI、HOMAIR(cp)、TG、TC、BUN、Cr、糖尿病病程、HDL-C 為自變量進行多因素二元Logistic 分析,結果顯示BMI(OR=1.132,95%CI 1.064~1.205,P<0.01)、HOMA-IR(cp)(OR=1.049,95%CI 1.023~1.075,P<0.01)、Cr(OR=1.023,95%CI 1.005~1.041,P=0.01)是T2DM 合并高尿酸血癥的危險因素。
3 討論
本研究結果表明,T2DM 合并高尿酸血癥組BMI、TG、TC 均高于單純糖尿病組,而HDL-C 低于單純糖尿病組,此結論與多個同類研究[4-6]結果一致。高尿酸血癥導致糖尿病患者脂代謝異常,尤其與TG 升高密切相關。有報道[7]稱,血尿酸水平升高可促進低密度脂蛋白膽固醇的氧化和脂質過氧化,導致血脂水平增高。梅彩霞等[8]對806 例健康體檢人群按BMI 分組研究肥胖與高尿酸血癥的關系,結果顯示,隨BMI 水平的升高, 高尿酸血癥的患病率呈上升趨勢,與本研究結果一致, 其機制可能為肥胖狀態下脂肪組織缺氧,嘌呤合成增加, 使SUA 生成增多[9]。高尿酸血癥還與年齡相關,年齡可能為其保護性因素[10],考慮與隨著年齡增長應酬減少,飲食習慣趨于規律有關。此外,本研究中糖脂代謝異常、胰島素抵抗、BMI 升高等結果與其他研究一致,而病程的相關性與其他研究[11]結果不一致。有研究[12]認為胰島功能惡化及胰島素抵抗指數升高的速度隨著病程的遷延明顯減慢,同時血尿酸與空腹血糖水平在較低的血糖狀態下呈正相關而在較高的血糖狀態下呈負相關[13],考慮血糖控制情況及胰島功能的變化共同影響血尿酸水平與病程的關系。因相關研究較少,2 型糖尿病患者的血尿酸水平與病程的關系需要更大規模的前瞻性研究進一步探討其相關性及因果關系。

表1 兩組臨床資料和檢測指標的比較
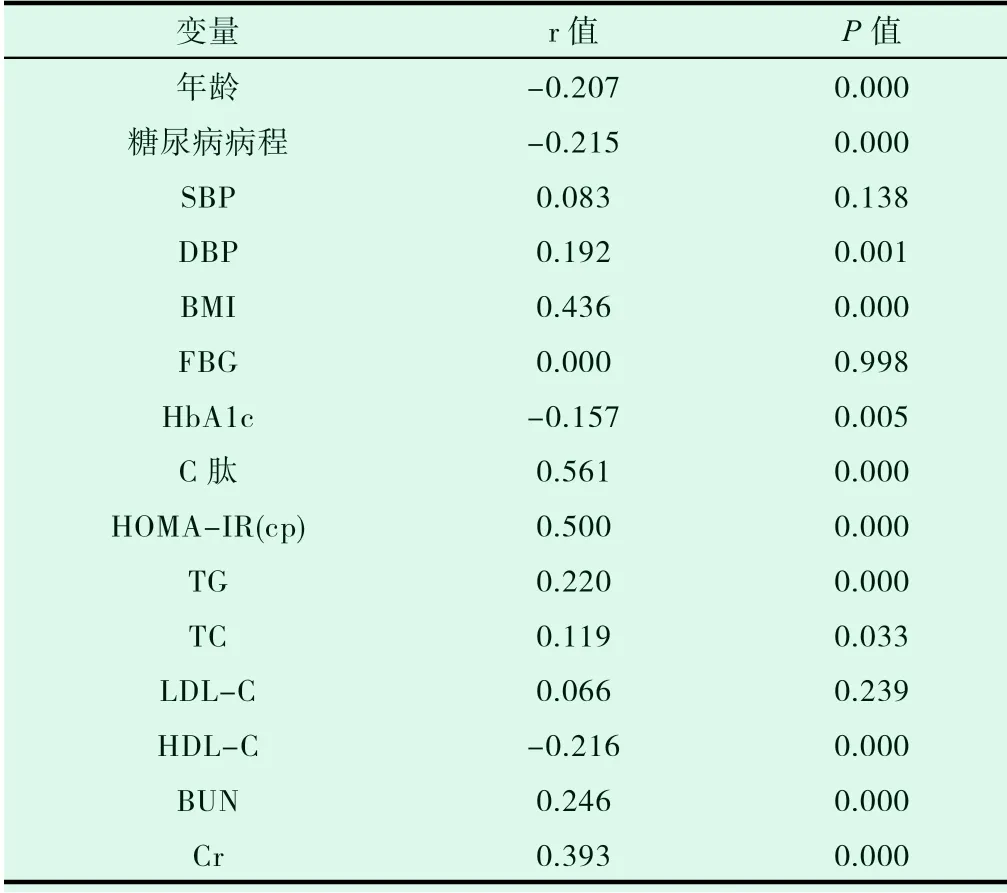
表2 尿酸與其他指標的相關性分析
以往的研究表明,高尿酸血癥和胰島素抵抗可能是相互影響的,血尿酸水平與胰島素抵抗呈正相關,同時胰島素抵抗又是高尿酸血癥的危險因素。尿酸水平升高可激活NF-kB-iNOS-NO 炎癥信號軸,降低內源性NO 生物利用度并減少內皮細胞NO 供應,干擾胰島素介導的葡萄糖攝取;血尿酸水平升高也可激活NADPH氧化酶,引起脂肪細胞氧化應激反應損傷胰島β 細胞,導致胰島素抵抗,減少胰島素分泌[14-17]。然而,Tassone 等[18]提出了一種新的尿酸誘導胰島素抵抗的分子模型,認為尿酸能夠通過內皮細胞ENPP1 合成,在受體水平抑制胰島素信號通路。另一方面,胰島素抵抗是高尿酸血癥的危險因素之一,可通過增加肝臟新生脂肪合成導致人體嘌呤代謝失衡,降低尿酸清除率[19]。其次,胰島素抵抗引起代償性高胰島素血癥,導致近端小管對尿酸的重吸收增加,引起尿酸升高[20]。
綜上所述,T2DM 合并高尿酸血癥與BMI 升高、糖脂代謝異常、胰島素抵抗相關,胰島素抵抗是T2DM 患者發生高尿酸血癥的危險因素。另外,胰島素抵抗與高尿酸血癥相互影響,關系較復雜,仍需要擴大樣本量進行更深入的研究。臨床上,應積極預防,給予適當治療及生活方式干預,控制體重,以改善T2DM 患者的尿酸水平及胰島素抵抗。

