硝酸體系中Pt催化肼的分解
王 妍,肖松濤,李輝波,歐陽應根
中國原子能科學研究院 放射化學研究所,北京 102413
肼,作為鈾钚還原分離系統的支持還原劑[1-2],在后處理過程中已經得到了廣泛應用。在后處理流程中,為了抑制1B、2B萃取器中亞硝酸的破壞作用,需向體系中加入支持還原劑,它不僅能保護還原劑,還能防止還原產物Pu(Ⅲ)不再被氧化。在進入钚純化之前,必須將1BP中殘留的支持還原劑肼破壞,然后再選用適合的氧化劑將Pu(Ⅲ)氧化為Pu(Ⅳ)。
Pt具有良好的催化性能,可用Pt催化法分解肼[3-4]。與傳統的亞硝酸鈉或亞硝氣氧化法破壞肼相比,Pt催化法分解肼具有不引入其它離子、廢液或廢氣處理量小等優點,是值得在后處理工藝中研究的方法。
從20世紀90年代末開始,國內外的學者先后發表了許多關于Pt催化氧化肼的文獻。例如,Ananiev等[4-6]分別考察了硝酸、非硝酸以及弱堿體系下Pt/SiO2催化分解肼的動力學并推測了其反應機理;常利等[7]研究了在硝酸介質中溫度、酸度等條件對Pt催化肼分解的影響。
然而,后處理過程的最大特點是處理的對象是經過解體的強放射性物料,具有極強的放射性(如α、β、γ、中子等)。在實際反應體系中,用Pt催化法破壞后處理料液中的肼時,就不得不考慮放射性對催化過程的影響,而這些影響可能會抑制或促進催化體系的效率。已有的研究表明[8],β放射性對催化氧化還原反應具有提高作用,可以提高合金在氧化還原反應中的催化作用。不僅如此,在后處理過程中,裂片產物合金顆粒中的β放射性同位素(99Tc、107Pd及196Ru),也能夠提高裂片元素的催化作用[9]。
本工作結合后處理流程的實際需要,擬通過實驗探究硝酸體系中肼的初始濃度、溫度、硝酸濃度、催化劑的用量(S/V)等對Pt催化分解肼的影響。實驗采用電子加速器產生的電子束模擬β放射性,初步探究β放射性對硝酸體系中Pt催化分解肼行為的影響,從而為后處理過程中肼分解的工藝提供一定的基礎數據。
1 實驗部分
1.1 主要試劑和儀器
硝酸、水合肼、甲烷磺酸等試劑,均為分析純,北京化學試劑公司。催化劑:Ti基Pt材料(以下簡稱Pt-Ti網),環網狀,佛山市金譽五金篩網有限公司。其中鍍鉑層厚度為4 μm,高度為30 mm,直徑為60~200 mm,直徑不同Pt催化劑的量也不同。通過循環伏安法測定,該材料的活性面積約為幾何面積的1.3倍。
恒溫磁力攪拌器,德國IKA儀器有限公司;CIC-100型離子色譜儀,青島盛瀚色譜技術有限公司,陽離子交換色譜柱為Thermo Fisher Ion Pac CS12A分析柱(250 mm×4 mm),淋洗液為8 mmol/L MSA,流速為1.2 mL/min,進樣量為50 μL;DC-1010型低溫恒溫循環器,南京瞬瑪儀器設備有限公司;電子加速器,最大束功率12 MeV,50 kW,中國原子能科學研究院計量測試部。
1.2 實驗方法
通過測定反應過程中N2H4濃度的變化來表征Pt催化分解肼的反應。實驗前,首先按不同的實驗條件配制一定濃度的HNO3和肼的反應溶液。降溫使帶水浴夾套的玻璃裝置溫度達到設定值,然后向玻璃裝置中加入總體積為450 mL的反應溶液,當溫度達到設定值后,機械攪拌條件下(600 r/min)加入不同比表面積的Pt-Ti網催化劑,反應同時開始計時,根據溶液反應情況,每隔一段時間取樣分析溶液中肼濃度等隨時間的變化。肼濃度的測定采用離子色譜法,并依據標準曲線計算肼的濃度。
1.3 動力學處理方法
(1)
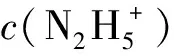
(2)
其中:
k′=kcb(HNO3)
(3)
對上式積分并整理得:
(4)
2 結果與討論
2.1 反應對級數的確定
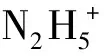
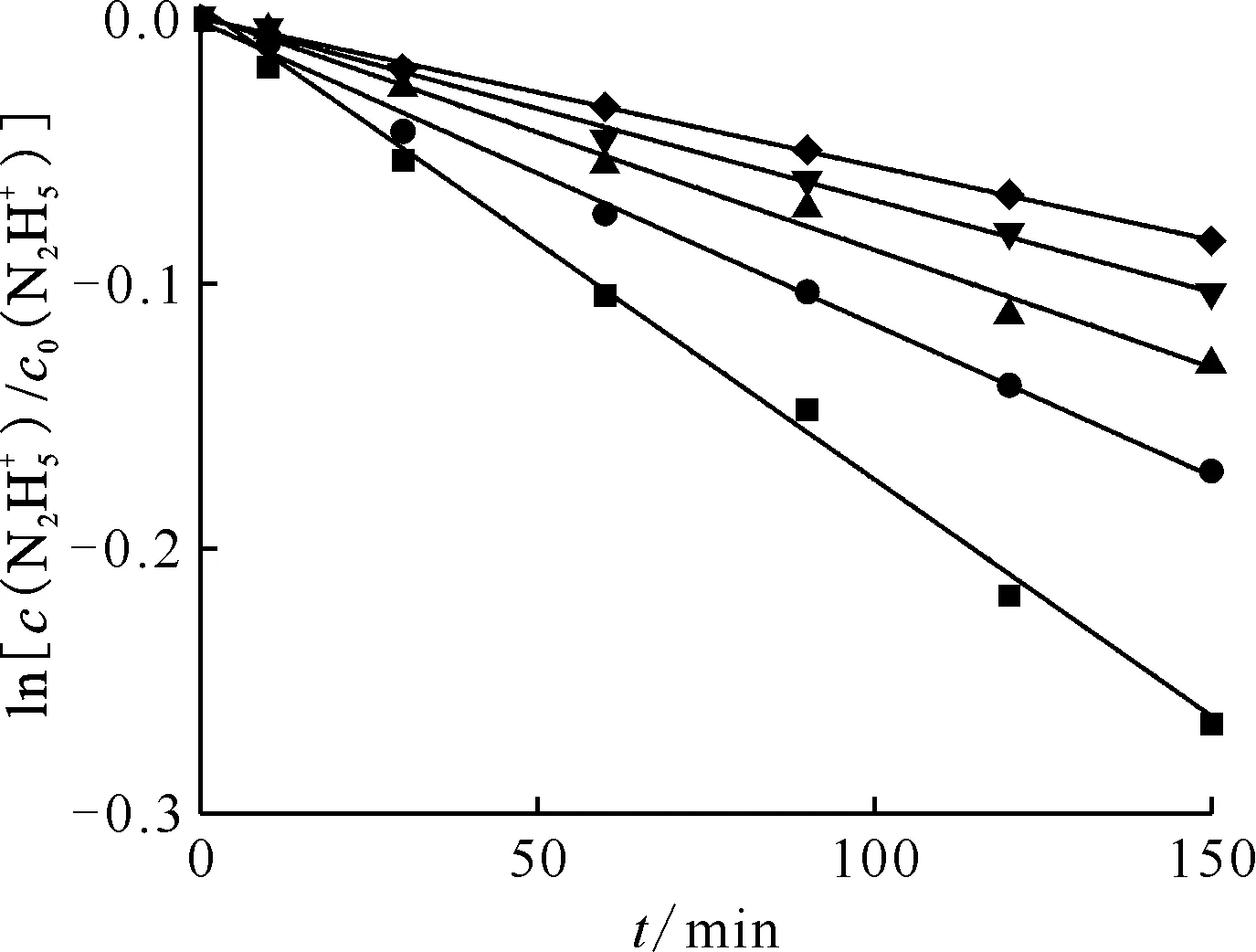
催化劑的用量 0.63 cm2/mL,T=296 K,c0(HNO3)=0.020 mol/L ■——0.055,y=-1.79×10-3x+4.78×10-3,r2=0.99;●——0.040,y=-1.14×10-3x-1.01×10-3,r2=0.99;▲——0.035,y=-8.88×10-4x+1.60×10-3,r2=0.99;▼——0.025,y=-6.92×10-4x+7.93×10-4,r2=0.99;◆——0.020, y=-5.58×10-3x+2.68×10-4,r2=0.99
2.2 硝酸初始濃度對反應速率的影響
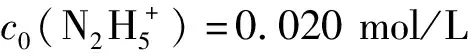
同樣經處理后,求出不同HNO3濃度下反應的表觀速率常數k′,并以HNO3起始濃度的對數對lnk′作圖得圖3。圖3表明,lnc0(HNO3)與lnk′呈直線關系,直線的斜率是-0.39,即反應對HNO3的反應級數為-0.39。反應級數為負說明H+不直接參與Pt催化肼的分解反應,相反由于它和肼分子之間存在競爭吸附催化劑上活性位的關系,在反應體系S/V不變的情況下,隨著酸度增加,H+占活性位的比例增加,吸附肼的活性位相應的較少,導致肼的分解速率下降。
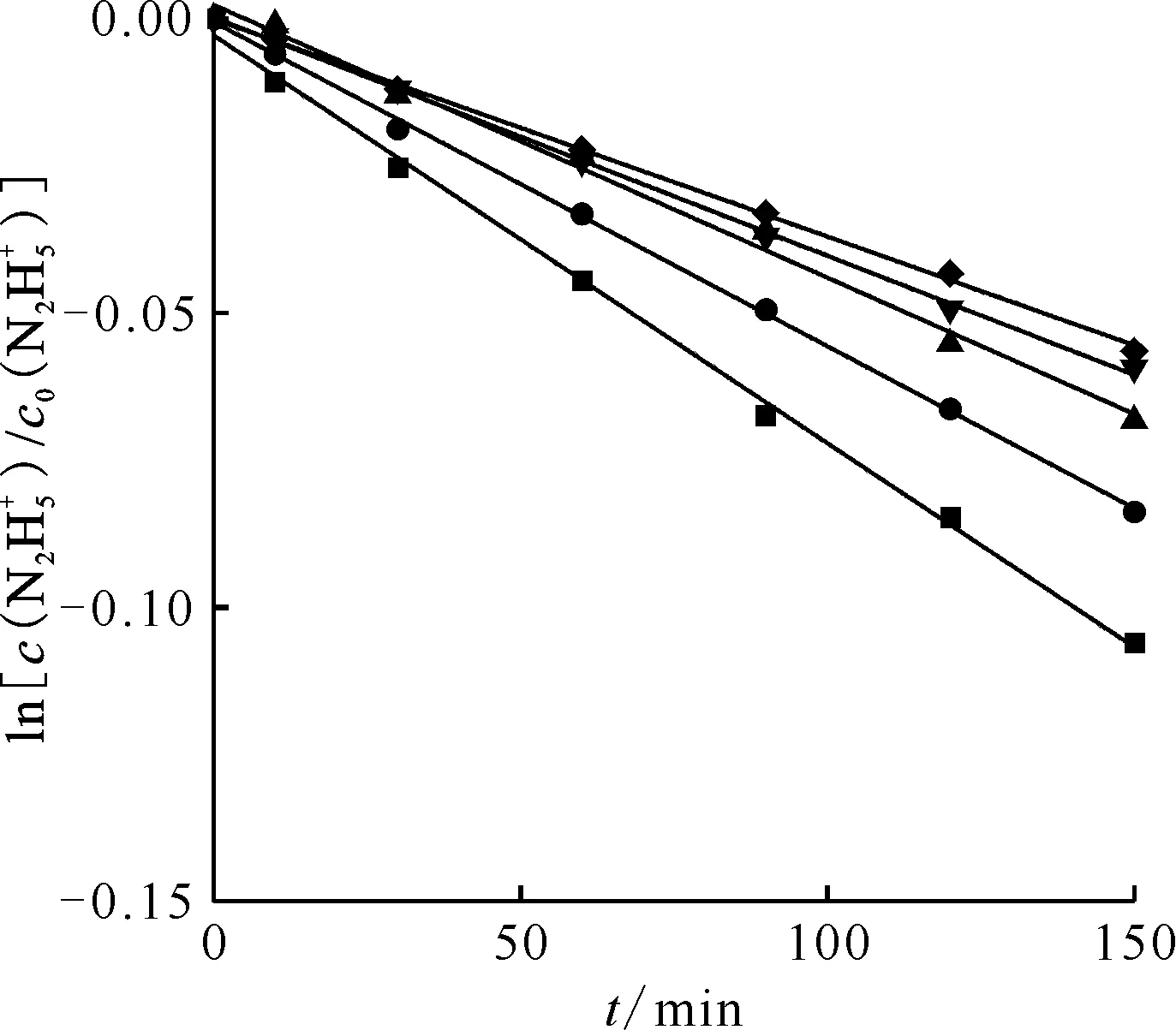
c0(HNO3),mol/L:■——0.010,y=-6.92×10-4x-2.88×10-3,r2=0.99;●——0.020,y=-5.50×10-4x-5.97×10-5,r2=0.99;▲——0.030,y=-4.63×10-4x+2.30×10-3,r2=0.99;▼——0.040,y=-4.05×10-4x+1.61×10-5,r2=0.99;◆——0.050,y=-3.69×10-4x-9.74×10-5,r2=0.99
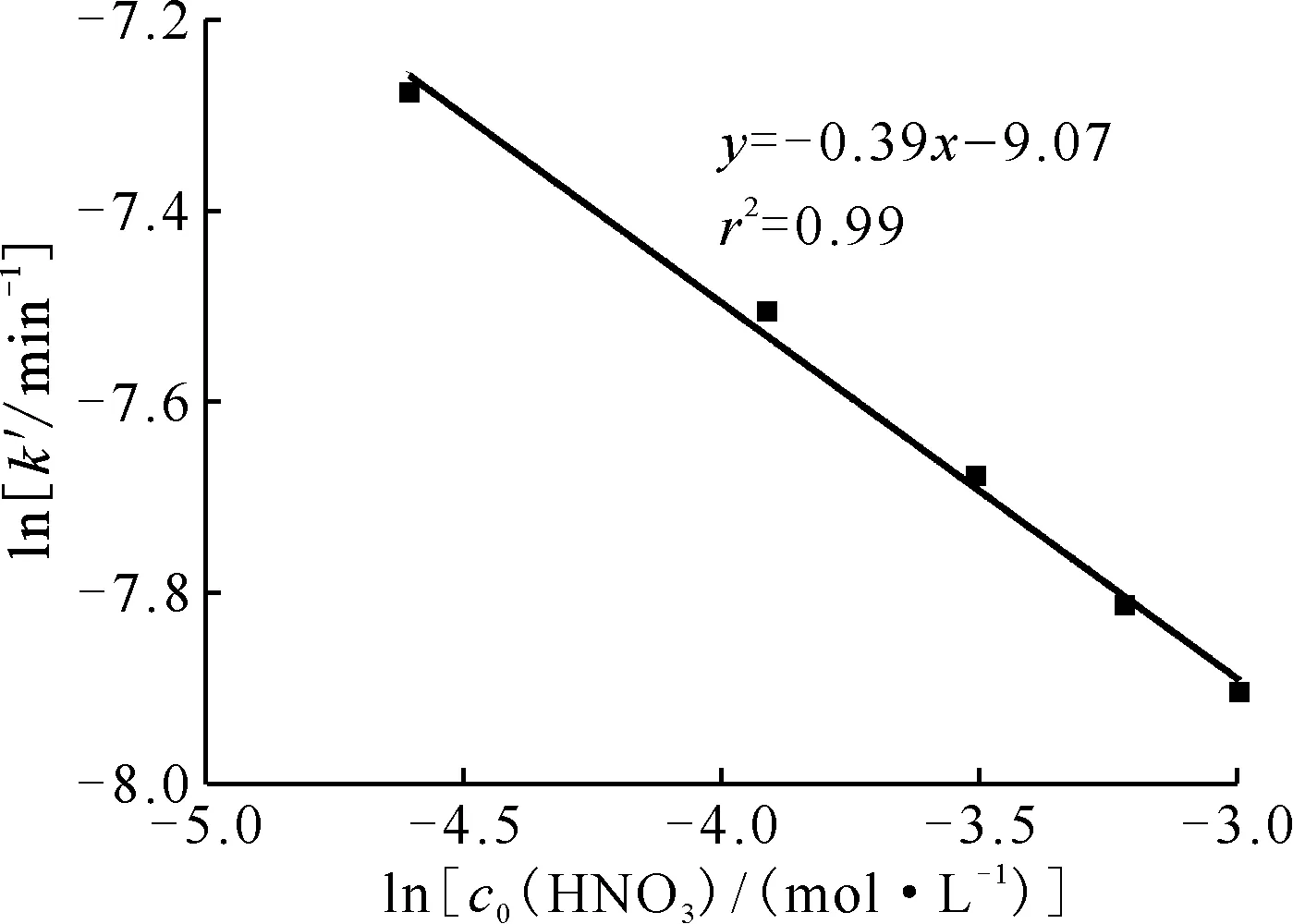
圖3 不同硝酸初始濃度對表觀速率常數的擬合曲線
各種不同起始條件下的速率常數列入表1。
綜上所述,Pt催化肼分解的初始表觀動力學速率方程可表示為:
(5)
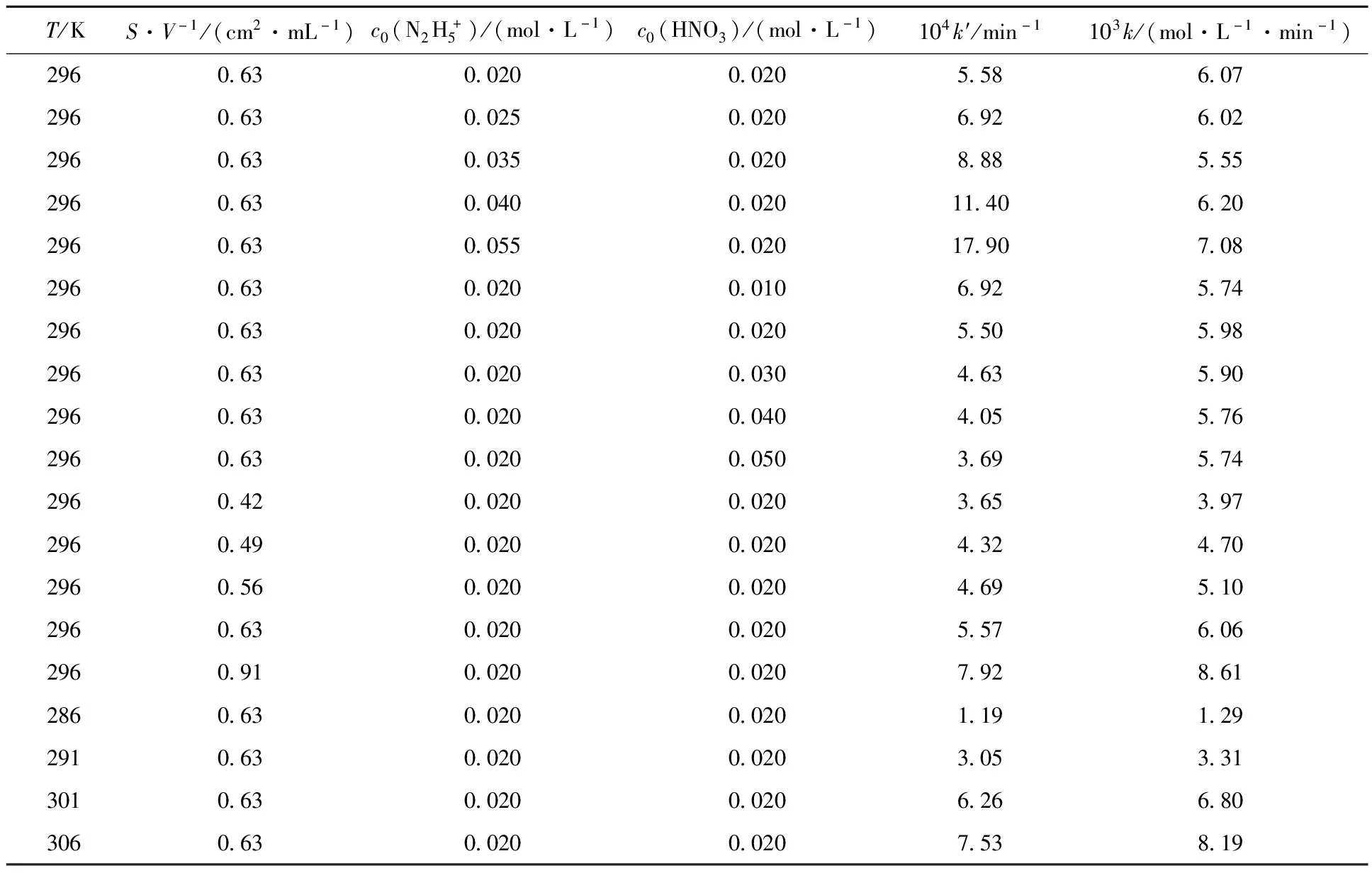
表1 Pt催化肼分解的k和k′值
T=296 K,催化劑用量S/V=0.63 cm2/mL時,速率常數k=(5.90±0.35)×10-3mol/(L·min)。
2.3 催化劑用量對反應速率的影響

c0(HNO3)=0.020 mol/L 催化劑用量,cm2/mL:■——0.91,y=-8.04×10-4x-5.94×10-5,r2=0.99;●——0.63,y=-5.57×10-4x+8.40×10-5,r2=0.99;▲——0.56,y=-4.69×10-4x+1.29×10-5,r2=0.99;▼——0.49,y=-4.23×10-4x+1.78×10-3,r2=0.99;◆——0.42,y=-3.58×10-4x+1.80×10-3,r2=0.99
2.4 溫度對反應速率的影響
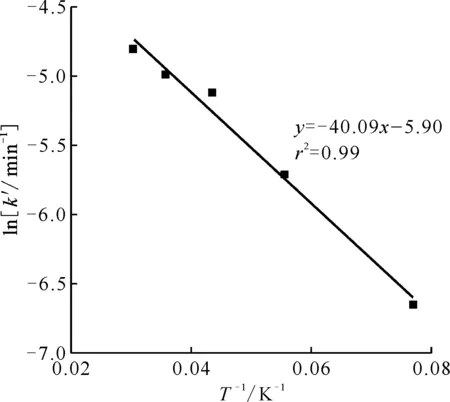
維持其他條件不變,單獨改變反應體系的溫度,在280~310 K研究溫度對反應的影響。反應溫度與表觀速率常數的關系通常用Arrhenius定理表示:
k′=Ae-Ea/RT
(6)
其中:Ea,該反應的活化能,J/mol;A,指前因子,mol/(min·L);R,氣體摩爾常數,R=8.314 J/(mol·K)。
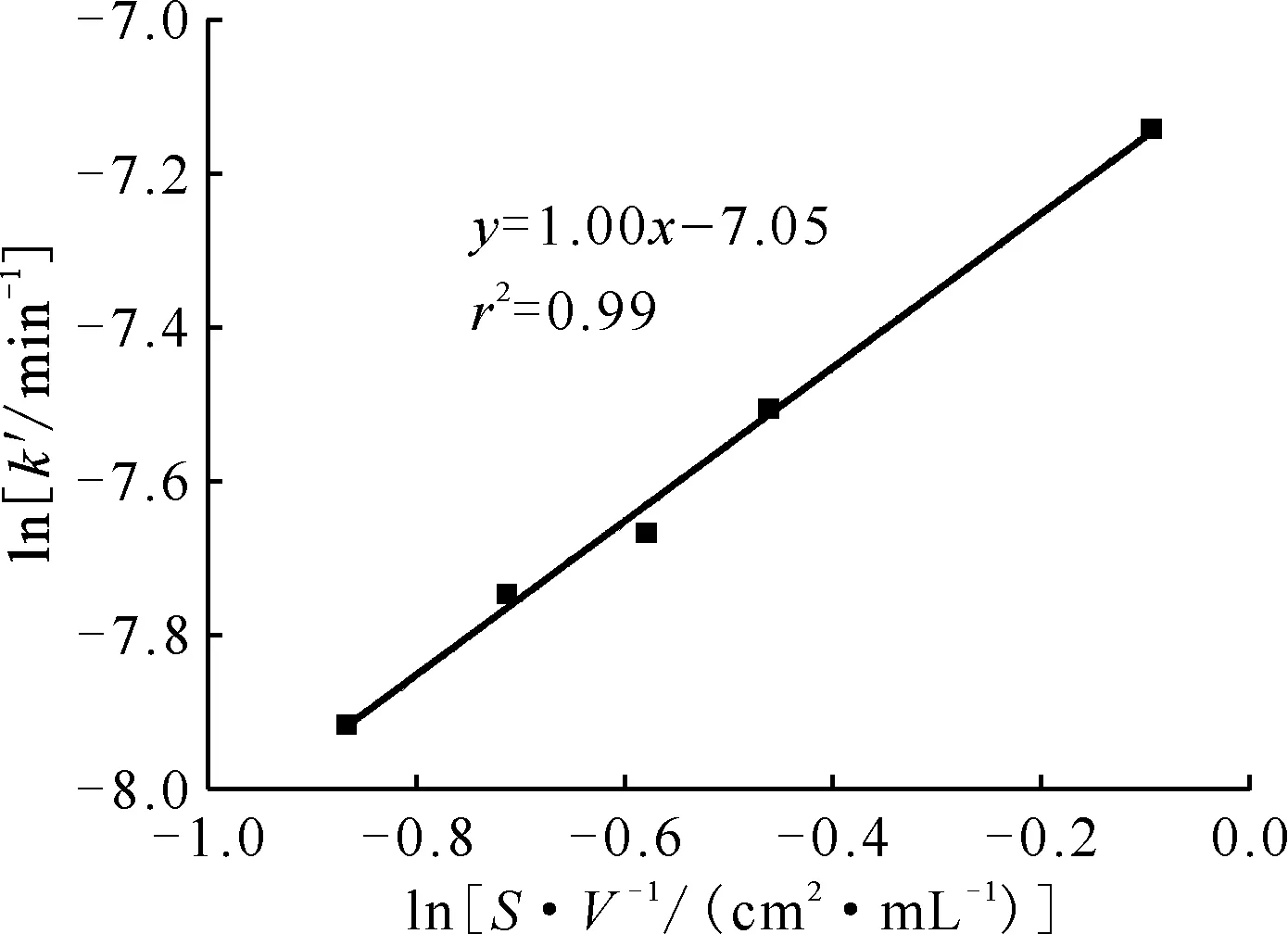
圖5 催化劑用量對表觀速率常數的擬合曲線
圖6為不同溫度下肼分解的一級擬合曲線。由圖6可知:隨著溫度升高,表觀速率常數由1.19×10-4min-1(286 K)增加到7.53×10-4min-1(306 K),并由公式(6)求得反應的活化能Ea=(333.3±2.9) J/mol(圖7)。
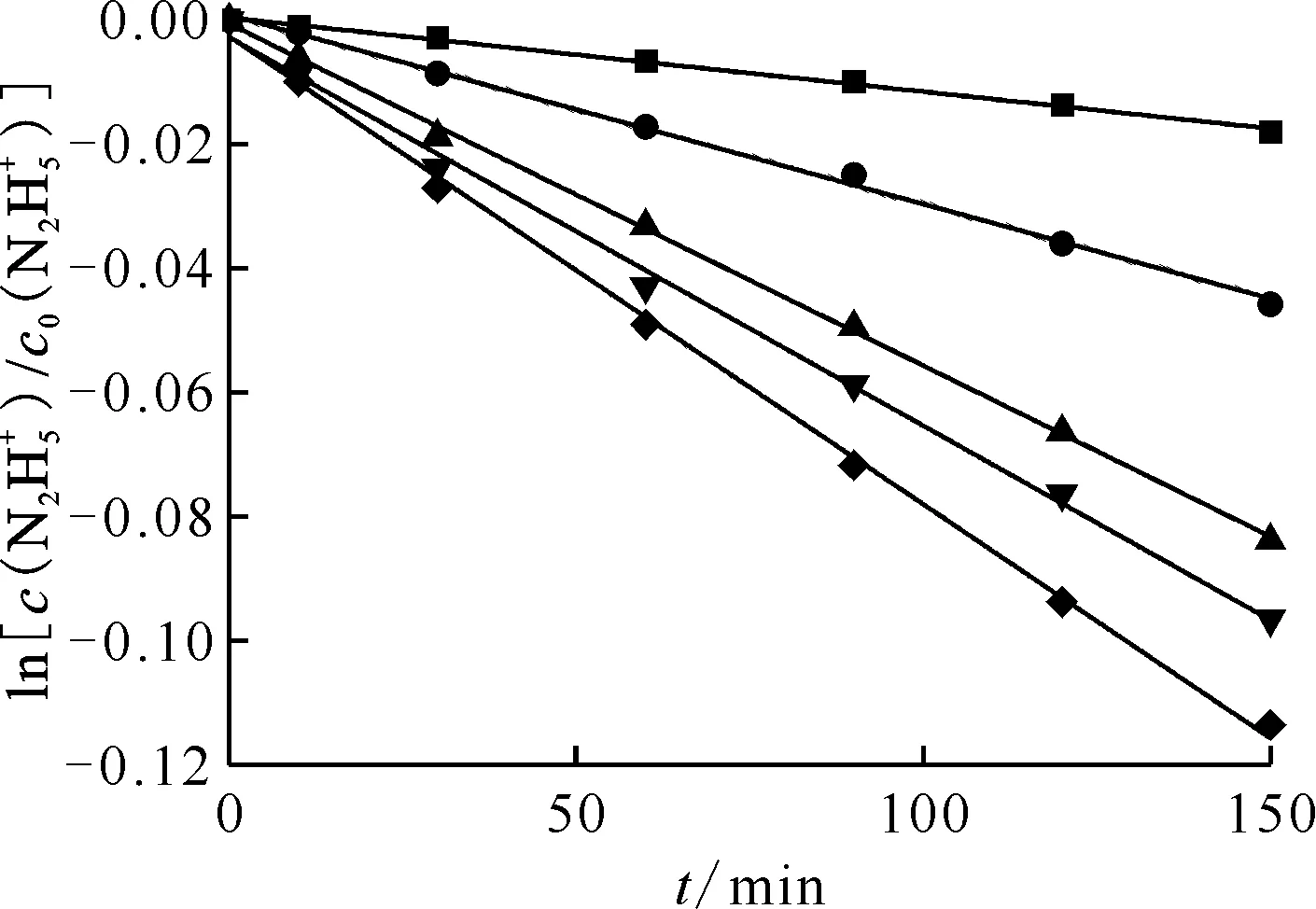
催化劑用量 c0(HNO3)=0.020 mol/L ■——286 K,y=-1.19×10-4x+3.67×10-4,r2=0.99;●——291 K,y=-3.05×10-4x+8.35×10-4,r2=0.99;▲——296K,y=-5.50×10-4x-5.96×10-4,r2=0.99;▼——301 K,y=-6.26×10-4x-2.76×10-3,r2=0.99;◆——306 K,y=-7.53×10-4x-2.63×10-3,r2=0.99
2.5 β放射性對反應速率的影響
如前所述,在實際的后處理過程中,所處理的料液具有強放射性,為了探究后處理溶液中β放射性對反應可能的影響,利用電子加速器來模擬β放射性進行研究,其最大束功率為2.0 MeV,50 kW。輻照樣品置于距電子加速器鈦窗口約30 cm處進行輻照實驗,使電子束僅輻照反應溶液,電子束流強度為0.065 mA。實驗中,由薄膜劑量計測得樣品的輻照吸收劑量為31.2 kGy(20 min)。
催化劑用量 c0(HNO3)=0.020 mol/L
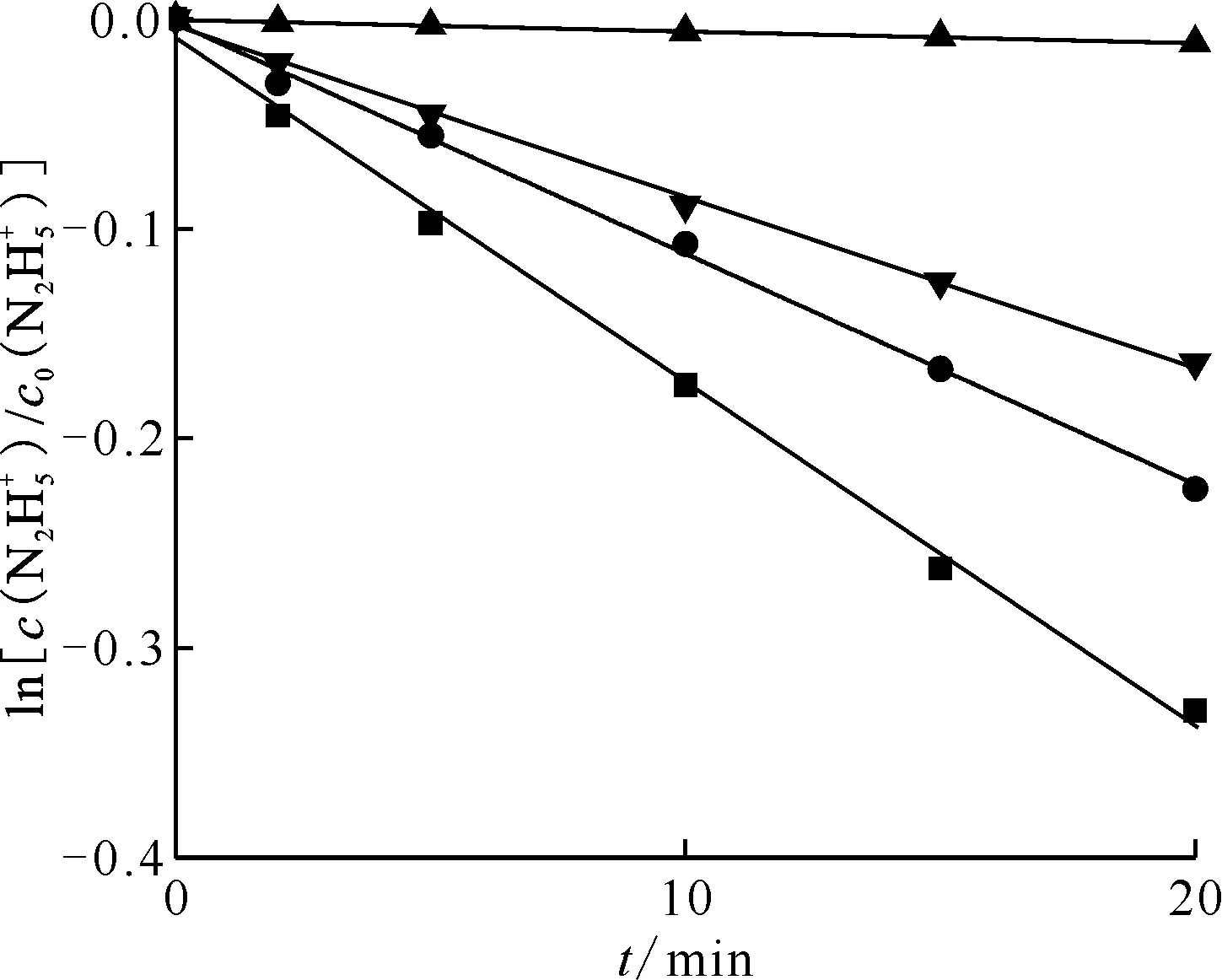
催化劑用量 c0(HNO3)=0.020 mol/L ■——β輻照Pt表面(Pt/β),y=-1.64×10-2x-9.78×10-3,r2=0.99;●——β輻照溶液(Pt/β),y=-1.10×10-2x-2.29×10-3,r2=0.99;▼——β輻照,y=-8.14×10-3x-3.76×10-3,r2=0.99;▲——Pt催化 ,y=-5.67×10-4x-3.51×10-4,r2=0.99
不同實驗條件下肼的分解曲線示于圖8。由圖8可知:單獨采用Pt催化,硝酸體系中肼分解的表觀速率常數為5.67×10-4min-1;單獨采用β輻照處理,硝酸體系中肼分解的表觀速率常數為8.14×10-3min-1;在相同時間、相同條件下,采用Pt/β聯合處理工藝,肼分解的表觀速率常數為1.10×10-2min-1,是單獨Pt催化法的19.3倍,是單獨β輻照的1.35倍。這表明,當溶液中存在β放射性時,可以顯著提高體系中Pt催化肼分解的分解速率。同時可看出,Pt/β聯合作用時肼的表觀分解速率(1.10×10-2min-1)大于單獨Pt催化與單獨β輻照的常數之和(8.71×10-3min-1),這說明當引入β放射性時,β放射性和Pt催化氧化反應產生了一種疊加效應或者說協同效應,并且這種協同作用與體系中的自由基反應有關[10-11]。
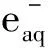
3 可能的反應機理
通過以上反應動力學數據分析,可以對硝酸體系中Pt催化肼分解的反應機理進行初步推測。
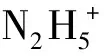
Pt催化肼分解反應過程中,在反應瞬間就有氣體生成表明該過程有自由基參與。反應發生于Pt催化劑的表面,H+和N2H4首先擴散并吸附到Pt催化劑表面的活性中心處(式(7)、(8)),當Pt催化劑活性點一定時,增加肼的濃度或降低酸度有利于肼的吸附,從而加速肼的分解,動力學方程中對肼的級數為正可以驗證。c(N2H4)的一級反應級數取決于吸附平衡式(8)。通常來說,吸附在催化劑上的肼的解離脫氫(式(12))為整個反應的限制步驟。在反應過程中,肼氧化還原分解的反應為式(9)—(12)。下標sol表示溶液,ads表示吸附在催化劑表面。
(7)
(8)
(9)
(10)
(11)
(12)
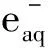
因此,當將β放射性引入溶液中時,溶液中產生了大量的活性粒子如HO·、eaq·等,它們可以很快地與吸附在Pt催化劑上的肼或其中間產物反應,從而導致肼的分解速率加快,可能發生的反應如式(13)、(14)。然而其真實的作用與機理有待進一步考證和研究。
(13)
(14)
4 結 論
(1) 本實驗條件下,在硝酸體系中Pt催化肼分解的反應動力學方程為:
296 K、催化劑的量S/V=0.63 cm2/mL時,速率常數k=(5.90±0.35)×10-3mol/(L·min)。
(2) 推測了硝酸體系下Pt催化肼分解的反應機理,肼在催化劑表面的吸附分解是整個反應的控制步驟。升溫、減小硝酸濃度、增大催化劑Pt的量均可以使肼的分解速率加快。
(3) β放射性對Pt催化體系中肼的分解速率有顯著的提高作用,其表觀速率常數比單獨Pt催化提高了19.3倍,比單獨β輻照提高了1.35倍,β放射性輻照位置不同肼的分解速率也不同。據推測,是由于β射線與水溶液反應生成的活性粒子與吸附在Pt催化劑表面的肼及中間產物發生了一系列氧化還原反應導致肼的分解速率加快。

