肥胖對OSAHS患者日間嗜睡的影響
鄭艷文 鄔海燕 胡立紅 姜貽乾

【摘要】 目的:探討肥胖與阻塞性睡眠呼吸暫停低通氣綜合征(OSAHS)患者日間嗜睡關系及對OSAHS患者影響。方法:經多導睡眠圖(PSG)及體重指數(BMI)測評,分為OSAHS伴肥胖組40例,OSAHS不伴肥胖組38例,單純肥胖組42例,測定三組體重指數(BMI)、呼吸暫停低通氣指數(AHI)、夜間最低血氧飽和度、愛潑沃斯嗜睡量表(ESS)評分、血清瘦素(LEP)水平并進行對比,分析ESS評分與AHI及LEP水平相關性。結果:OSAHS伴肥胖組ESS評分、LEP水平均高于OSAHS不伴肥胖組及單純肥胖組,差異均有統計學意義(P<0.05);OSAHS不伴肥胖組ESS評分高于單純肥胖組,差異有統計學意義(P<0.05);OSAHS伴肥胖組ESS評分與LEP水平呈明顯正相關性,差異有統計學意義(P<0.05)。結論:OSAHS伴肥胖患者日間嗜睡癥狀與肥胖有關,而日間嗜睡發病機制可能與LEP水平變化有關。
【關鍵詞】 阻塞性睡眠呼吸暫停低通氣綜合征 肥胖 嗜睡 瘦素
[Abstract] Objective: To investigate the relationship between obesity and daytime sleepiness in patients with OSAHS and its effects on patients with OSAHS. Method: After polysomnography (PSG) and body mass index (BMI) evaluation, 40 cases in the OSAHS with obesity group, 38 cases in the OSAHS without obesity group, and 42 cases in the simple obesity group. Body mass indexes (BMI), apnea hypopnea indexes (AHI), nighttime minimum oxygen saturation, Epworth sleepiness scale (ESS) scores and serum leptin (LEP) levels were measured and compared among the three groups, and the correlation between ESS score and AHI and LEP levels was analyzed. Result: The ESS score and LEP level of the OSAHS with obesity group were higher than those of the OSAHS without obesity group and the simple obesity group, and the differences were statistically significant (P<0.05). The ESS score of the OSAHS without obesity group was higher than that of the simple obesity group, and the difference was statistically significant (P<0.05). There was a significant positive correlation between ESS score and LEP level in the OSAHS with obesity group, and the difference was statistically significant (P<0.05). Conclusion: The symptoms of daytime sleepiness in patients with OSAHS and obesity are related to obesity, and the pathogenesis of daytime sleepiness may be related to LEP level changes.
阻塞性睡眠呼吸暫停低通氣綜合征(obstructive sleep apnea hypopnea syndrome,OSAHS)是以在睡眠過程中反復發生呼吸暫停、低通氣及微覺醒為特征的疾病[1]。OSAHS是睡眠障礙中最常見疾病[2]。肥胖為OSAHS患者首要危險因素[3]。日間嗜睡是OSAHS患者常見的臨床表現之一,16%~22%的OSAHS患者存在日間嗜睡[4]。研究顯示,OSAHS患者日間嗜睡與夜間缺氧程度及AHI相關,且患者BMI與AHI呈正相關[5]。但目前關于肥胖與日間嗜睡的獨立關系的研究不多,且機制不清。肥胖程度與血清中瘦素濃度變化密切相關[6]。本研究通過對比是否伴肥胖的OSAHS患者日間嗜睡情況及血清瘦素水平,進一步探討肥胖與OSAHS患者日間嗜睡關系及可能影響機制。
1 資料與方法
1.1 一般資料
研究對象均來自杭州市蕭山區第一人民醫院門診、住院或健康體檢中心,研究時間為2017年9月-2019年7月。OSAHS診斷標準:夜間7 h睡眠中呼吸暫停及低通氣反復發作>30次或AHI≥5次/h,且以阻塞性呼吸暫停為主[7]。中國單純性肥胖診斷標準:超重為BMI 25~26 kg/m2,肥胖為BMI>26 kg/m2。排除標準:心血管疾病、腦部疾病、老年癡呆、智力障礙、未控制的糖尿病、惡性腫瘤、甲狀腺疾病、維生素缺乏、慢性阻塞性肺疾病、間質性肺疾病等。經多導睡眠圖(PSG)及體重指數(BMI)測評,分為OSAHS伴肥胖組40例,OSAHS不伴肥胖組38例,單純肥胖組42例。研究經醫院倫理委員會同意,患者均簽訂知情同意書。
1.2 方法
囑患者晚8點后禁飲食、飲水,次日清晨7點于臥位、空腹狀態下抽取靜脈血15 ml,置于試管內并加入EDTA抗凝,30 min內于2 ℃~8 ℃條件下以1 000 g離心15 min,取上清液置于-20 ℃冰箱中保存。采用化學發光酶免疫分析法測定血清瘦素(LEP)水平,試劑盒由上海康朗生物科技有限公司提供,所有標本均嚴格按照試劑盒說明書操作。
PSG監測:采用全數字多導睡眠監測系統(美國安波瀾Embla N7000)對患者進行夜間連續7 h以上的監測。
1.3 觀察指標及評價標準
(1)對比三組臨床情況,包括一般情況(年齡、BMI)、AHI、ESS評分、最低血氧飽和度及LEP水平。AHI分級:輕度5~15次/h,中度15~30次/h,重度>30次/h。嗜睡程度采用ESS量表進行評估:詢問患者過去2周中8種不同日間活動情景及打瞌睡或可能睡著的程度,總分0~24分,分數越高,嗜睡程度越重。(2)分析ESS評分與AHI及LEP水平相關性。
1.4 統計學處理
數據采用SPSS 23.0軟件進行統計學分析,呈正態分布的計量資料以(x±s)表示,兩組間比較采用t檢驗,多組間比較采用F檢驗,ESS評分與AHI及LEP水平相關性采用Pearson相關性分析,P<0.05為差異有統計學意義。
2 結果
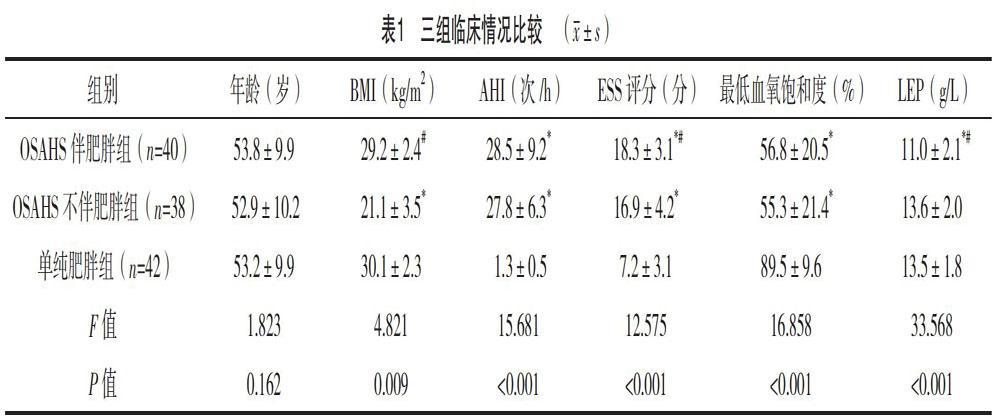
2.1 三組臨床情況比較
三組年齡比較,差異無統計學意義(P>0.05);OSAHS伴肥胖組與OSAHS不伴肥胖組AHI、最低血氧飽和度比較,差異無統計學意義(P>0.05);OSAHS伴肥胖組與單純肥胖組BMI比較,差異無統計學意義(P>0.05);OSAHS伴肥胖組ESS評分、LEP水平均高于OSAHS不伴肥胖組及單純肥胖組,差異均有統計學意義(P<0.05);OSAHS不伴肥胖組ESS評分高于單純肥胖組,差異有統計學意義(P<0.05),見表1。
2.2 OSAHS伴肥胖組ESS評分與AHI及LEP水平相關性
ESS評分與LEP水平呈正相關性,差異有統計學意義(P<0.05);ESS評分與AHI無明顯相關性,差異無統計學意義(P>0.05),見表2。
3 討論
OSAHS是由間歇低氧導致的氧化應激和炎癥反應,可對機體造成嚴重損傷[8]。由于肥胖患者上氣道狹窄程度較嚴重,腹部及胸廓脂肪堆積,縱向氣管牽張力及咽壁張力減弱,胸壁順應性下降,致使肺容量進一步下降,加重阻塞程度[9]。目前研究認為,睡眠片段化及低氧血癥與OSAHS患者日間嗜睡有一定關系[10]。瘦素是脂肪組織和中樞神經系統間網絡聯系的外周信號,可通過血-腦屏障與下丘腦的特異性受體結合,并作用于下丘腦弓狀核,使攝食相關神經肽合成與分泌減少,從而降低食欲,增加能量消耗,加速脂肪分解,抑制脂肪合成,是預測肥胖敏感指標。研究顯示,肥胖程度及間歇性缺氧時間等與血清中瘦素(Leptin)濃度密切相關[6]。肥胖伴OSAHS患者體內的血清瘦素水平比非肥胖伴OSAHS患者明顯偏高[11]。
既往研究顯示,OSAHS嚴重程度與日間嗜睡有明顯相關性[12]。本研究顯示,OSAHS伴肥胖患者日間嗜睡癥狀較OSAHS不伴肥胖及單純肥胖患者明顯,同時LEP水平明顯升高;此外,相關分析顯示,LEP水平與ESS評分呈明顯正相關。說明肥胖為OSAHS患者日間嗜睡的影響因素。可能機制:(1)肥胖患者尤其頸部肥胖患者可增加低氧血癥發生風險,引起睡眠-喚醒過程中交感神經過度興奮,導致夜間深睡眠不足,日間嗜睡加重。(2)OSAHS伴肥胖患者體內存在瘦素抵抗,可導致中央呼吸控制機制的缺陷及周圍和中央化學感受器的不良反應,導致呼吸節律發生紊亂,影響機體氧合狀態,從而造成白天嗜睡[13]。Lecube等[14]描述,胰島素抵抗及瘦素抵抗可產生更嚴重的睡眠呼吸暫停癥狀及更高的睡眠呼吸暫停低通氣指數,從而導致白天嗜睡。(3)其他因素,如代謝異常、炎癥反應、氧化應激引起睡眠片段化等[15-16]。此外,肥胖可加重OSAHS患者白天嗜睡程度。
本研究發現,瘦素水平與日間嗜睡程度呈正相關,說明肥胖為OSAHS患者日間嗜睡的相關因素。但本試驗樣本數量未能達到大樣本數量要求,且未考慮缺氧程度的影響作用,因此日后還需進一步實施相關試驗。
參考文獻
[1]中國醫師協會睡眠醫學專業委員會.成人阻塞性睡眠呼吸暫停多學科診療指南[J].中華醫學雜志,2018,98(24):1902-1914.
[2] Peromaa-Haavisto P,Tuomilehto H,K?ssi J,et al.Obstructive sleep apnea:the effect of bariatric surgery after 12 months.A prospective multicenter trial[J].Sleep Medicine,2017,7(35):85-90.
[3] Carneiro G,Zanella M T.Obesity metabolic and hormonal disorders associated with obstructive sleep apnea and their impact on the risk of cardiovascular events[J].Metabolism,2018,7(84):76-84.
[4] Kapur V K,Baldwin C M,Resnick H E,et al.Sleepiness in patients with moderate to severe sleep-disordered breathing[J].Sleep,2005,28(4):472-477.
[5] Magne F,Gomez E,Marchal O,et al.Evolution and predictive factors of improvement of obstructive sleep apnea in an obese population after bariatric surgery[J].Journal of Clinical Sleep Medicine,2019,15(10):1509-1516.
[6] Pamuk A E,Süslü A E,Yalcinkaya A,et al.The serum leptin level in non-obese patients with obstructive sleep apnea[J].Auris Nasus Larynx,2018,45(4):796-800.
[7]中華醫學會呼吸病學分會睡眠呼吸障礙學組.阻塞性睡眠呼吸暫停低通氣綜合征診治指南(2011年修訂版)[J].中華結核和呼吸雜志,2012,35(1):19-22.
[8]鄭艷文,欽光躍,張穎,等.經鼻氣道持續正壓通氣對OSAHS伴夜尿增多患者腎損傷影響作用[J].實用醫學雜志,2018,34(24):4120-4122.
[9] Jeong J I,Gu S,Cho J,et al.Impact of gender and sleep position on relationships between anthropometric parameters and obstructive sleep apnea syndrome[J].Sleep Breath,2017,21(2):535-541.
[10] Kainulainen S,T?yr?s J,Oksenberg A,et al.Severity of desaturations reflects OSA-related daytime sleepiness better than AHI[J].Journal of Clinical Sleep Medicine,2019,15(8):1135-1142.
[11] Imayama I,Prasad B.Role of leptin in obstructive sleep apnea[J].Annals of the American Thoracic Society,2017,14(11):1607-1621.
[12] Iannella G,Vicini C,Colizza A,et al.Aging effect on sleepiness and apneas severity in patients with obstructive sleep apnea syndrome:a meta-analysis study[J].European Archives of Oto-Rhino-Laryngology,2019,276(12):3549-3556.
[13] Bassi M,Furuya W I,Zoccal D B,et al.Control of respiratory and cardiovascular functions by leptin[J].Life Sciences,2015,125(15):25-31.
[14] Lecube A,Romero O,Sampol G,et al.Sleep biosignature of type 2 diabetes: a case-control study[J].Diabetic Medicine,2017,34(1):79-85.
[15] Stolarczyk E.Adipose tissue inflammation in obesity:a metabolic or immune response?[J].Current Opinion in Pharmacology,2017,37(11):35-40.
[16] Bingol Z,Karaayvaz E B,Telci A,et al.Leptin and adiponectin levels in obstructive sleep apnea phenotypes[J].Biomarkers in Medicine,2019,13(10):865-874.
(收稿日期:2019-12-25) (本文編輯:李盈)

