膀胱癌相關轉錄物1在胃癌組織中的表達及其對胃癌細胞增殖和自噬水平的影響
王甲南,崔大煒,吳曰清,陳建祿,李欣諭,金宏遠,楊清波
[1. 遵義醫科大學第五附屬(珠海)醫院普通外科,廣東 珠海 519100;2.中國醫科大學附屬第四醫院普通外科,遼寧 沈陽 110032]
胃癌是目前全球第5大常見惡性腫瘤,每年約有72.3萬人死于胃癌[1]。早期胃癌切除術后患者5 a生存率為90%,晚期患者5 a生存率接近10%[2]。進展期胃癌一般采用手術和(或)化療治療,但復發和轉移很常見[3-4]。疾病的診斷較晚和表現各異,加上普遍缺乏有效的治療方法來對抗疾病的異質性,是造成高死亡率的主要原因[5]。雖然手術是胃癌的標準治療方法,但早期發現、診斷和治療是能夠降低死亡率的唯一途徑[6]。通過胃癌篩查可以降低胃癌特異性死亡率,提高胃癌患者的生存率[7]。因此,可靠的生物標志物對于簡單、快速的癌癥診斷以及可靠、廣泛適用的治療方案的選擇具有重要意義。
長鏈非編碼RNA(long non-coding RNA, lncRNA)目前被定義為長度超過200個核苷酸的一種非編碼RNA,在人類正常和疾病狀態中具有重要的調節作用[8]。許多lncRNA在胃癌中表達失調,與腫瘤發生、轉移、預后或診斷密切相關,在胃癌的診斷和預后中顯示出潛在的生物標志物作用[9]。自發現膀胱癌相關轉錄物1(bladder cancer associated transcript-1,BLACAT1)在膀胱癌組織中高度上調以來[10],lncRNA BLACAT1在多種實體瘤患者組織和血漿中也被發現顯著上調[11-12]。BLACAT1上調驅動胃癌細胞的特性,影響腫瘤細胞的增殖、凋亡等[13]。然而,關于胃癌組織中BLACAT1與自噬的關系尚不清楚,BLACAT1在人胃癌組織和細胞系中的表達模式、生物學作用以及在胃癌進展中的潛在機制仍有待研究。本研究通過檢測BLACAT1在人胃癌組織和細胞系中的表達情況,探討其對胃癌細胞的增殖和自噬水平的影響以及對自噬調控的潛在機制,以探究胃癌治療的新靶點。
1 資料與方法
1.1 胃癌標本收集收集2017年8月至2018年9月期間在遵義醫學院第五附屬醫院進行手術切除并經病理檢查確診為胃癌的標本53例,均為原發病灶,并經2名病理科醫師證實,離體后放入液氮中保存。全部患者術前未行放、化療。本研究經醫院倫理委員會批準,在患者簽署知情同意書后進行。
1.2 主要試劑Trizol試劑購自美國Invitrogen公司;人正常胃上皮黏膜細胞系GES-1,胃癌細胞系SGC-7901、MGC-803、BGC-823均購自美國標準菌庫;RPMI-1640培養基購自美國HyClone公司;體積分數10%胎牛血清購自美國Gibco公司;Trizol試劑購買自美國Invitrogen公司;cDNA試劑盒Prime Script RT kit購買自日本TaKaRa公司;RIPA裂解液購自上海碧云天公司;siRNA均購自上海吉瑪公司;Lip2000購自美國Invitrogen公司。
1.3 方法
1.3.1 細胞培養與轉染 GES-1、SGC-7901、MGC-803、BGC-823細胞系均在含體積分數10%胎牛血清和100 u/mL青霉素鈉RPMI-1640培養基中培養,環境為含體積分數5% CO2的37 ℃濕潤環境。靶向BLACAT1的小干擾RNA(small interference RNA, siRNA),包括si-BLACAT1、si-control和si-ATG3、si-NC由上海吉瑪公司合成。si-BLACAT1序列如下:5’-GAATTAGAAGCGAGGGGTT-3’。BLACAT1過表達質粒購自上海吉瑪公司,選用pcDNA3.1空白載體作為陰性對照。分別設立BLACAT1干擾組(si-BLACAT1)和陰性轉染組(si-control),BLACAT1過表達組(pcDNA3.1- BLACAT1)和對照組(pcDNA3.1),ATG3干擾組(si-ATG3)和陰性轉染組(si-NC)。
將SGC-7901、BGC-823細胞按每孔5×105個種于6孔板中,待細胞達到90%融合時,通過Lipofectamine 2000儀器,分別用si-BLACAT1和si-control、pcDNA3.1- BLACAT1和pcDNA3.1、si-ATG3和si-NC轉染細胞。48 h后收獲細胞用于實時定量PCR檢測,72 h后用于Western blot檢測。
1.3.2 實時定量PCR 采用Trizol試劑從胃癌細胞系和組織中提取總RNA。利用Prime Script RT kit合成cDNA。采用美國Invitrogen公司合成實時定量PCR引物,BLACAT1序列為:正向:5’-TGACGTCTTACTACACCCATCCT-3’,反向:5’-CTGCCACCTATAGGAAATGCG-3’。β-actin作為內部參照,以下引物序列被用來放大β-actin,正向:5’-CTACAATGAGCTGCGTGTGG-3’和反向:5’-AAGGAAGGCTGGAAGAGTGC-3’。對每個樣本進行3次PCR擴增,并用2-ΔΔCT法計算并標準化BLACAT1表達。
1.3.3 免疫熒光試驗 使用質量分數4%多聚甲醛固定胃癌細胞,然后用質量分數0.1% Triton x-100 處理細胞15 min。將穩定表達的胃癌細胞接種于細胞孔,待細胞貼壁且生長到70%左右分別加入si-BLACAT1和si-control、pcDNA3.1-BLACAT1和pcDNA3.1,再放入培養箱培養。后加入一抗、二抗,滴加DAPI復染核,在激光掃描顯微鏡下觀察LC3發光情況。
1.3.4 Western blot 收集胃癌細胞,用RIPA裂解緩沖液裂解。提取等量的蛋白質(30 μg)經SDS-PAGE電泳分離, 然后轉移到聚偏二氟乙烯膜。在含質量分數0.05% Tween-20的Tris緩沖液中,用體積分數5%脫脂牛奶封閉膜,然后與LC3Ⅰ、LC3Ⅱ、ATG3特異性抗體封閉過夜(15 000;美國Cell Signaling Technology公司)。后在37 ℃條件下與山羊、兔抗體IgG孵育(11 000) 2 h, 結合蛋白的可視化使用ECL和Bio-Imaging System檢測。蛋白水平標準化用β-actin (110 000)。
1.3.5 CCK-8 法測定胃癌細胞增殖能力 取對數生長期的胃癌細胞接種于96孔板中(5×103個/孔),分別于24、48、72、96 h 后終止培養,加入質量分數10% CCK-8培養基,置于培養箱中孵育3 h。最后用酶標儀測定450 nm波長處的吸光度值(OD450)。
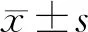
2 結果
2.1 BLACAT1在胃癌組織和細胞系中的表達胃癌組織中的BLACAT1的表達水平高于癌旁組織,差異有統計學意義(P<0.05,圖1)。實時定量PCR用于分析GES-1、SGC-7901、MGC-803、BGC-823細胞系中BLACAT1表達。結果表明,各胃癌細胞系中BLACAT1表達高于正常胃細胞系,其中胃癌細胞系SGC-7901、BGC-823的BLACAT1表達水平相對較高,用于后續實驗(P均<0.05,圖1)。
2.2 敲除BLACAT1抑制胃癌細胞的增殖與si-control相比,si-BLACAT1質粒的敲除后BLACAT1降低率分別為70%與64%,差異均有統計學意義(P均<0.05,圖2)。CCK-8用于檢測敲除BLACAT1后對胃癌細胞系SGC-7901、BGC-823增殖能力影響。結果顯示,敲除BLACAT1后胃癌細胞的增殖能力較si-control顯著降低,差異有統計學意義(P<0.05,圖3)。
2.3 敲除BLACAT1抑制胃癌細胞自噬與si-control相比,si-BLACAT1自噬標志蛋白LC3Ⅱ/LC3Ⅰ比例明顯降低,表明細胞自噬水平受到抑制(圖4)。免疫熒光實驗用于進一步研究敲除BLACAT1對自噬水平影響,可見LC3熒光斑點在si-BLACAT1組中降低,即敲除BLACAT1能夠抑制胃癌細胞的自噬水平(圖5)。
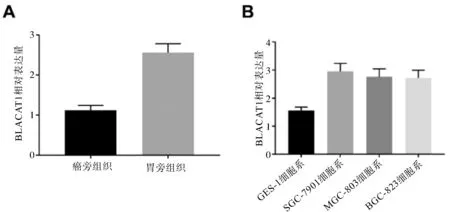
圖1 lncRNA BLACAT1在胃癌組織(A)和細胞系(B)中的表達
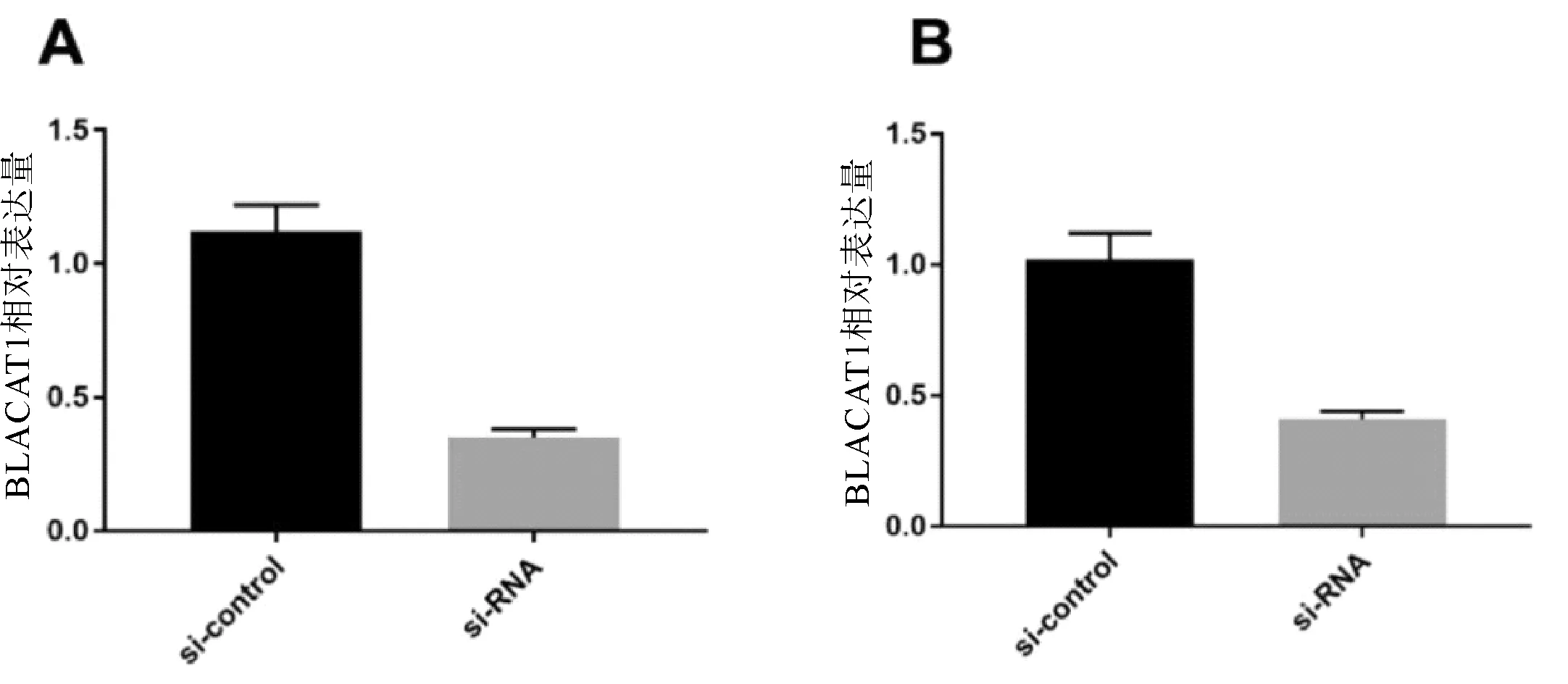
圖2 敲除BLACAT1對SGC-7901(A)、BGC-823(B)細胞系增殖的影響
圖3 敲除BLACAT1對SGC-7901(A)、BGC-823(B)細胞系增殖的影響
2.4 敲除BLACAT1抑制自噬相關蛋白ATG3的表達與si-control相比,敲除BLACAT1降低ATG3蛋白表達水平,即si-BLACAT1能夠上調SGC-7901、BGC-823細胞系中ATG3的表達(圖6)。
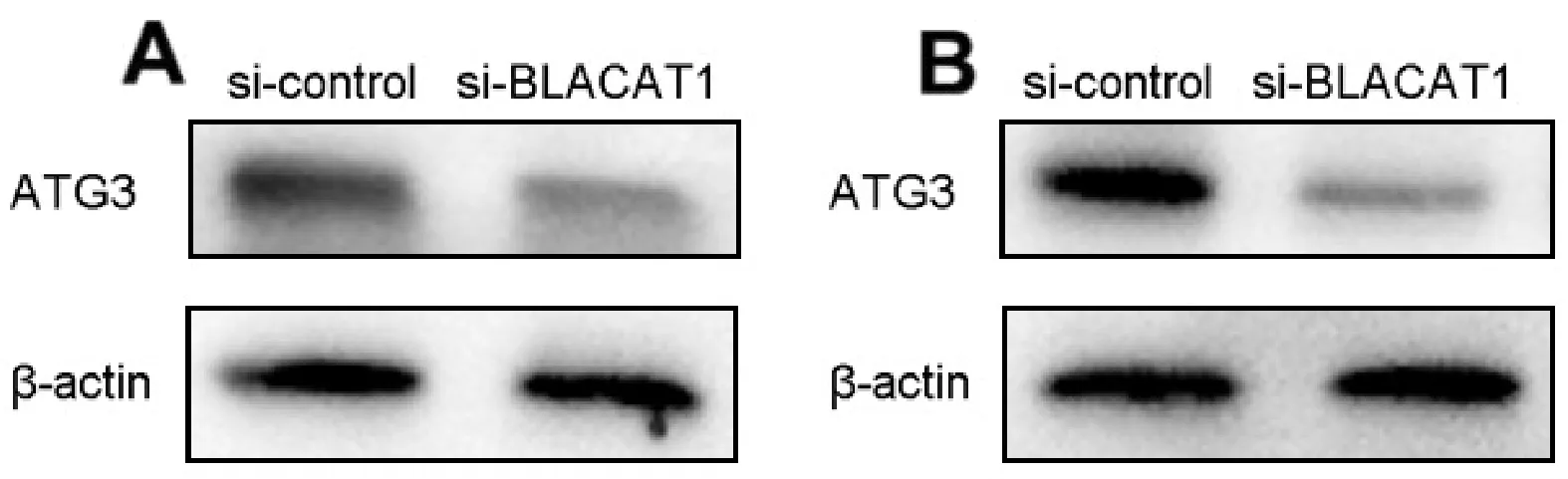
圖6 敲除BLACAT1對SGC-7901(A)、BGC-823(B)細胞系自噬相關蛋白ATG3表達的影響
3 討論
LncRNA通過調節基因轉錄和表觀遺傳信號等多種復雜機制,在調控腫瘤行為中發揮重要作用[8]。然而,關于lncRNA在胃癌組織中的表達和功能的數據有限。研究表明,lncRNA BLACAT1具有促癌活性,是結直腸癌[14]、膀胱癌[10]和胃癌[15]患者的預后不良的指標。本文結果顯示,lncRNA BLACAT1在胃癌組織中的表達明顯高于癌旁組織。LncRNA BLACAT1的診斷和預后價值一直被關注。例如,已證實多種惡性腫瘤患者的血清和組織中lncRNA BLACAT1的表達水平均較非惡性腫瘤者顯著上調,且血清lncRNA BLACAT1具有較高的診斷性能[12],這表明lncRNA BLACAT1在胃癌診斷中可能具有生物標志物的潛力。在非小細胞肺癌中,lncRNA BLACAT1表達上調,沉默lncRNA BLACAT1可在體內外抑制增殖、遷移、侵襲,誘導細胞G0/G1期阻滯,lncRNA BLACAT1促進腫瘤細胞生長發揮致癌作用[16],我們證實了這一觀察結果,體外敲除lncRNA BLACAT1可抑制胃癌細胞增殖,提示lncRNA BLACAT1可能是胃癌的致癌基因。
自噬是一種細胞內溶酶體參與蛋白質和細胞器降解的途徑,與人類疾病和生理聯系緊密[17]。近年來越來越多研究證實自噬與腫瘤發展的密切關系[18-19]。然而,在惡性腫瘤發展過程中,自噬被證明具有雙重作用。在某些情況下,自噬是一種腫瘤抑制機制,但在另一些情況下,自噬促進腫瘤發生[20-21]。我們用si-BLACAT1轉染胃癌細胞,抑制自噬體形成。而敲除BLACAT1時抑制腫瘤細胞的生長,提示BLACAT1可能通過促進自噬參與腫瘤發生過程。然而,盡管本研究有相關數據,但自噬與細胞凋亡尤其是腫瘤細胞凋亡的關系。
自噬涉及多個步驟:起始、成核、伸長、形成自噬體的膜的閉合、與溶酶體的融合以及大分子前體的循環,特定的自噬相關蛋白調節每個步驟[22]。ATG3的乙酰化增強了其與含磷脂酰乙醇胺脂質體和內質網的結合,是促進ATG8/LC3-磷脂酰乙醇胺綴合物形成的關鍵調節分子[23]。研究[24-25]發現,多種lncRNA可以通過ATG3調控自噬水平。但ATG3在胃癌中的作用目前尚未完全清楚。本研究發現,敲除BLACAT1抑制ATG3的表達,通過共轉染pcDNA3.1- BLACAT1和si-ATG3后,胃癌細胞自噬水平受到顯著抑制。說明BLACAT1對自噬的調控是通過ATG3實現的。
綜上所述,本研究證實lncRNA BLACAT1在胃癌中表達升高。通過細胞學實驗,我們發現lncRNA BLACAT1敲除可抑制胃癌細胞增殖和自噬;并且我們發現敲除lncRNA BLACAT1能抑制自噬相關蛋白ATG3的表達。這說明lncRNA BLACAT1對胃癌細胞自噬的調控可能與ATG3有關。本研究為lncRNA BLACAT1在胃癌發生、發展中的機制研究奠定了理論基礎。

