脾破裂大鼠血清及回腸黏膜組織中緊密連接蛋白Occludin和ZO-1的變化及意義
賀強貴 謝先海 徐洪波 程水兵 吳廣宇 陶禮鈞
脾臟是腹部臟器中最容易受損的器官之一,外傷性脾破裂約占腹部臟器損傷的21%~38%[1]。脾破裂患者往往發生大出血,產生嚴重的缺血、缺氧,最終導致休克及多器官功能障礙綜合征(MODS),具有高發病率和高病死率的特征[2]。同時脾臟是人體最大的免疫器官,在機體的抗感染中起到重要作用。大量研究表明,脾臟全切除術后患者免疫功能顯著下降,可大大提升感染尤其是兇險性感染的發生率,對患者生命構成極大威脅[3]。臨床上,嚴重的創傷、燒傷、感染、休克等可直接損害腸上皮細胞,導致腸黏膜屏障功能受損,引發腸源性感染、全身性炎癥反應綜合征,最終導致MODS的發生。腸黏膜屏障是防止腸道內細菌移位最重要的功能和形態學結構,緊密連接是腸上皮細胞最重要的細胞間連接,其結構包括膜蛋白和細胞質蛋白[4]。緊密連接蛋白的閉合蛋白(Occludin)、密封蛋白-1 和緊密粘連蛋白-1(ZO-1)是構成腸黏膜屏障的主要成分,其在腸上皮細胞中含量的變化與腸黏膜屏障功能密切相關[5]。本研究旨在探討Occludin和ZO-1在不同程度脾破裂大鼠腸黏膜中的含量及陽性表達的意義,以期為臨床上救治脾破裂患者時保護腸黏膜屏障提供理論依據。
1 材料和方法
1.1 實驗動物和分組 健康Wistar雄性大鼠48只,2~3月齡,體重300~400g,由溫州醫科大學實驗動物中心提供,按隨機數字表法分為脾破裂輕度組、中度組、重度組和假手術組(Sham組)4組,每組12只。
1.2 主要試劑和儀器 酶聯免疫吸附實驗(ELISA)試劑盒由上海西唐生物科技有限公司提供;Occludin一抗由中國Abcam公司提供;ZO-1一抗由中國Themo Fisher公司提供,二抗及免疫組化試劑盒均由福州邁新生物技術開發有限公司提供;計算機圖像分析儀(Qwin)由德國Leica公司提供。
1.3 動物模型制作 4組大鼠術前均禁食、禁水6h,實驗組予0.2ml 0.1%的戊巴比妥鈉腹腔注射,麻醉后取左肋緣下切口(1.5cm)進腹,暴露脾臟,用手術刀片在脾臟膈面分別制作1道、2道、3道長約2cm、深約0.3cm的創面,分別對應輕度組、中度組、重度組,完成后逐層關腹[6];Sham組僅接受開、關腹手術。手術均在無菌操作下進行。建模完成后,4組大鼠分籠喂養,自由進食。4組大鼠均于造模24h后各留取3ml靜脈血作檢測標本,并均于造模24h后用斷頭法處死,同時開腹取回腸中段約5cm腸管置于4%甲醛溶液中浸泡,留待檢測。
1.4 檢測指標
1.4.1 大鼠腹腔情況觀測 檢測各組大鼠腹腔內出血量,觀察腹腔滲出及腸管、脾臟情況。
1.4.2 血清Occludin及ZO-1含量檢測 采用ELISA法。取3ml靜脈血標本經肝素抗凝,樣品室溫下放置不超過1h,3 000r/min常溫離心10min,取上層血清液于-80℃液氮罐保存備用。ELISA法檢測按照說明書操作。
1.4.3 回腸組織病理學觀察 4組大鼠回腸標本均制作病理切片并經HE染色,光鏡下觀察黏膜組織的病理變化。
1.4.4 回腸黏膜組織中Occludin及ZO-1表達檢測采用免疫組化染色法。每只大鼠隨機取回腸組織切片2張,陽性染色均為胞膜出現棕黃色顆粒,用計算機圖像分析儀觀察并分別測定其免疫反應陽性區及其終末的平均光密度(optical density,OD)值,觀察 5個視野,取平均值。
1.5 統計學處理 采用SPSS 22.0統計軟件。計量資料用±s表示,多組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 4組大鼠腹腔內情況 Sham組腹腔內無滲出、出血,各臟器無異常。輕度組腹腔內少許積血,平均約1.6ml,腸管顏色正常,脾臟創面少許滲出。中度組腹腔內積血平均約3.5ml,腸管顏色較蒼白,脾臟創面滲出較明顯。重度組腹腔內積血平均約4.3ml,腸管蒼白明顯,伴水腫,腸管間部分粘連,脾臟創面滲出明顯,并與周圍腸管粘連。
2.2 4組大鼠血清Occludin及ZO-1含量比較 4組大鼠血清中Occludin及ZO-1含量比較差異均有統計學意義(均P<0.05)。與Sham組相比,中、重度組血清中Occludin及ZO-1含量均有所升高,差異均有統計學意義(均P<0.05);與輕度組相比,中、重度組血清中Occludin及ZO-1含量均有所升高,差異均有統計學意義(均 P<0.05),見表1。
2.3 4組大鼠回腸黏膜組織病理變化的比較 Sham組回腸組織形態結構正常(圖1a,插頁)。輕度組回腸黏膜結構基本完整,偶見絨毛充血水腫,無炎癥反應、壞死、脫落(圖1b,插頁)。中度組腸黏膜絨毛數量減少,排列紊亂,可見部分細胞變性壞死,部分絨毛脫落,有多量炎性細胞浸潤(圖1c,插頁)。重度組回腸可見絨毛伏倒,部分絨毛尖端脫落,絨毛黏膜和黏膜下層間質水腫,黏膜層可見大量中性粒細胞浸潤(圖1d,插頁)。
2.4 4組大鼠回腸黏膜組織中Occludin及ZO-1表達情況的比較 4組大鼠回腸黏膜組織中Occludin及ZO-1 OD值比較差異均有統計學意義(均P<0.05)。與Sham組相比,中、重度組Occludin及ZO-1 OD值均有所降低,差異均有統計學意義(均P<0.05);與輕度組相比,中、重度組Occludin及ZO-1 OD值均有所降低,差異均有統計學意義(均 P<0.05),見表 2及圖 2、3(插頁)。
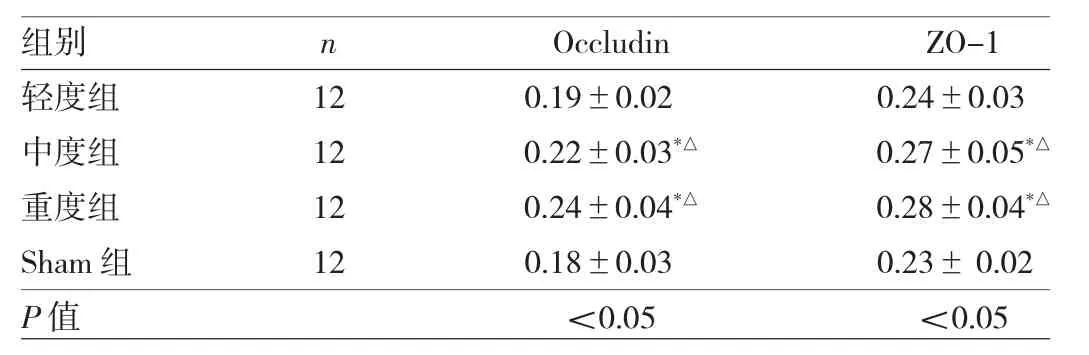
表1 4組大鼠血清中Occludin及ZO-1含量比較(ng/ml)
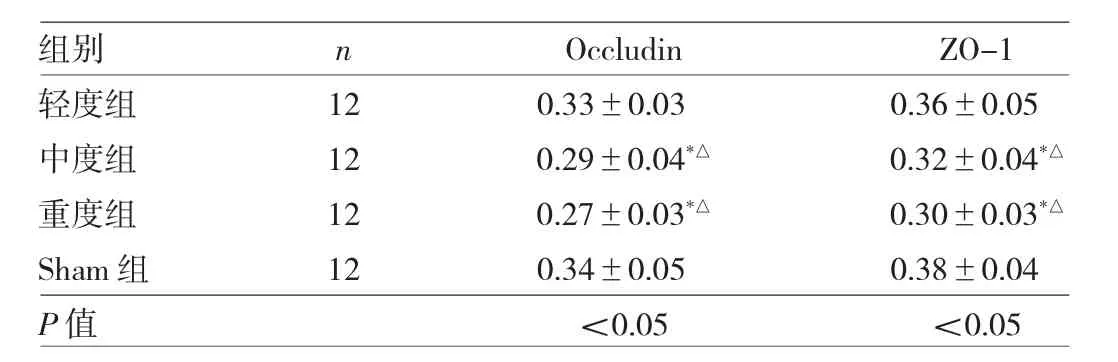
表2 4組大鼠回腸黏膜組織中Occludin及ZO-1表達情況的比較(OD值)
3 討論
腸道不僅是MODS的“受損”器官,又是MODS的“始動”器官,在嚴重創傷、燒傷、重度感染等應激條件下,胃腸道最早容易發生缺血、缺氧損傷,產生腸源性感染,最終導致MODS及死亡。因此保護腸屏障結構和功能的完整性是有效防治MODS的重要環節。緊密連接蛋白Occludin及ZO-1是構成腸道黏膜屏障的主要成分,其在保證腸道黏膜結構完整中起著重要作用。研究表明在機體明顯應激下緊密連接蛋白發生改變,導致腸黏膜屏障破壞,細菌和毒素易位,最終導致腸源性感染的發生[7]。ZO-1是最早被發現的緊密連接蛋白,在腸道上皮存在多量表達,在緊密連接蛋白的形成與細胞骨架系統的關聯中發揮重要作用[8]。ZO-1含量降低會導致腸道通透性增加,腸屏障功能降低,細菌移位,從而引起機體感染性疾病[9]。Occludin是構成緊密連接的特異性蛋白,與ZO-1等蛋白相互結合調節緊密連接的結構變化和血管通透性,維持腸黏膜屏障的正常功能。研究發現,塵螨的最主要抗原Derpl能夠水解Occludin蛋白,從而引起緊密連接的破壞和上皮滲透性的增加[10]。另有研究表明Occludin的減少和腸黏膜屏障功能的損傷密切相關[11]。有研究發現失血性休克后30min腸道通透性和細菌、內毒素移位增加,Occludin和ZO-l產生減少。可見緊密連接蛋白的改變,可能是燒傷、嚴重創傷等應激反應后早期腸道屏障功能損害的一個重要機制。
脾臟在腹部受到外傷時容易發生脾破裂,引起腹腔大出血,危及生命。同時脾臟又是機體重要的免疫器官,具有抗感染、抗腫瘤等重要作用。脾臟損傷之后會導致機體免疫功能不同程度下降,容易并發各種感染。研究表明臨床脾破裂患者感染發生率約為10%~15%,而嚴重脾破裂患者感染發生率高達16%~22%,因重度感染造成的病死率高達5%[12]。陳琦等[13]的研究也表明感染是造成創傷性脾破裂患者高病死率的一個重要因素。張偉[14]的研究則表明對不同損傷程度的脾破裂患者采取合適的治療手段能夠降低感染發生率,提高搶救成功率。
臨床上,對于脾破裂患者的救治往往將重點放在采取手術還是非手術治療的方案上,而忽視了在整體救治過程中由于嚴重脾破裂出血導致的機體組織缺血、缺氧,腸黏膜屏障功能受損,細菌移位,同時脾臟功能受損,機體免疫功能下降,引起各種醫院感染的發生,引發全身炎癥反應綜合征,并最終導致MODS的發生,而這有可能是嚴重脾破裂患者高病死率的重要病因之一。目前,國內外的研究大都集中在嚴重的燒傷、重癥感染、腸梗阻、急性胰腺炎等引起的早期腸黏膜屏障損傷方面。張繼龍等[15]的研究證明急性腦出血早期即可出現腸屏障功能障礙,從而影響患者的預后。而關于外傷性脾破裂與腸黏膜屏障功能障礙之間關系的研究鮮有報道。本研究通過建立大鼠輕、中、重度脾破裂模型,檢測緊密連接蛋白Occludin和ZO-1在各組中的含量變化,并且綜合以上其他實驗結果,筆者認為輕度脾破裂因為創傷應激較輕,出血量少,大鼠機體能夠通過循環調節迅速代償,維持血容量穩定及腸道正常血供,避免腸黏膜損傷或僅輕微損傷;而中重度脾破裂因為創傷應激相對較嚴重,出血量大,大鼠機體無法有效代償,造成腸道嚴重缺血、缺氧,腸黏膜屏障功能受到嚴重損害,導致腸黏膜明顯損傷,進一步引起腸源性感染,最終導致MODS,危及生命。
綜上所述,大鼠血清中Occludin及ZO-1的含量變化能夠真實反映大鼠脾破裂后腸黏膜損傷的程度,這有望成為臨床上反映患者脾破裂后腸黏膜損傷程度的一個可靠指標,有助于掌握脾破裂患者的腸黏膜屏障功能改變情況,及時對腸黏膜屏障進行保護以盡量減少腸源性感染尤其是嚴重感染的發生,降低脾破裂患者的病死率。

