高密度脂蛋白與系統性紅斑狼瘡關系的研究進展
嚴巧巧 狄亞珍
系統性紅斑狼瘡(systemic lupus erythematosus,SLE)是一種高度異質性的自身免疫性疾病,以各種自身抗體的產生為特征,并可發展為免疫系統失調和全身多臟器系統損傷。近幾十年來,隨著診治水平的提高,SLE患者早期病死率下降[1],但與一般人群相比,其缺血性心臟病患病風險率仍增加了10倍,而處于生育年齡的年輕女性心血管疾病(cardiovascular disease,CVD)風險增加了近50倍[2]。據統計CVD造成SLE患者晚期死亡的病死率占總病死率的1/3以上[3],可見CVD對SLE患者依舊是一個重大的威脅。
高密度脂蛋白(high-density lipoprotein,HDL)是所有脂蛋白中相對密度最高、體積最小的脂蛋白,有介導膽固醇外流、抑制脂質氧化、抗感染、抗血栓、抗細胞凋亡和保護內皮細胞等作用。HDL水平降低與CVD風險增加相關。SLE患者氧化應激和慢性炎性等反應導致HDL顆粒大小、蛋白質組學及脂質組學發生變化,進而引起上述作用減弱,導致SLE患者CVD的發生和發展。本文就HDL與SLE之間關系的研究進展作一綜述。
1 HDL的結構
HDL主要是由肝臟和小腸產生的一種血漿脂蛋白,通過與其他脂蛋白、酶的相互作用以及與靶細胞的接觸在血液中不斷被重塑。其內層為疏水性脂質核心,主要由膽固醇酯和三酰甘油構成;外層為親水的極性層,包括磷脂、游離膽固醇、載脂蛋白和一些活性酶類,其中脂質和蛋白質部分幾乎各占一半。蛋白成分可分為載脂蛋白、酶類、脂質轉移蛋白、急性期反應蛋白、補體成分、蛋白酶抑制劑和其他蛋白質7大類,載脂蛋白AⅠ(apolipoprotein A-Ⅰ,apoA-Ⅰ)是最主要的載脂蛋白,脂質部分則以磷脂為主。不同HDL顆粒間因蛋白質和脂質等含量的差異而具有高度異質性。另外,HDL可以用不同的技術劃分不同的亞群[4],經非變性聚丙烯酰胺梯度凝膠電泳法(non-denaturing gradient gel electrophoresis,Native-PAGE)將 HDL 分為 HDL2a、HDL2b、HDL3a、HDL3b及HDL3c 5型,而經雙向電泳法(twodimensional electrophoresis,2-DE) 將 HDL 分為 α-1HDL、α-2HDL、α-3HDL、α-4HDL、pre-β-1HDL 5 型。為了便于各項研究結果的分析比較,Rosenson等[5]依據顆粒密度和大小提出新的命名方法,將HDL分為極大顆粒、大顆粒、中等顆粒、小顆粒及極小顆粒5個亞型。近年來利用核磁共振(nuclear magnetic resonance,NMR)技術已經確定了26種HDL亞群,但由于測量精度有限,它們被簡單描述為小顆粒、中顆粒、大顆粒。
2 SLE患者HDL結構的變化
2.1 SLE患者血脂代謝異常 大部分研究結果表明,SLE患者的極低密度脂蛋白(very-low-density lipoprotein,VLDL)、低密度脂蛋白(LDL)水平升高,而 HDL 水平降低,目前被描述為“狼瘡譜”[6]。低HDL-膽固醇(HDL-C)是SLE患者(包括兒童)最常見的血脂異常指標之一。一項包含546例不同種族SLE患者的研究中發現,81%的患者 HDL-C 水平較低(<35mg/dl)[7],另一項針對埃及221例SLE患者的研究中發現45%的患者HDL-C水平較低(<40mg/dl)[8],該兩項研究均提示對照組與空白組的HDL-C水平無統計學差異,推測是由于患者群體的差異。但值得注意的是,HDL-C作為臨床常規實驗室指標,越來越多學者認為其與HDL顆粒的數量并不完全相關。因此,更多研究通過免疫組化方法測量apoA-Ⅰ濃度從而來測定HDL水平,發現相對于健康對照組,SLE患者apoA-Ⅰ水平較低[9]。Purmalek等[10]進一步通過NMR方法直接測量HDL粒子數發現SLE患者HDL顆粒數顯著減少,疾病活動期顆粒數水平更低。研究發現在SLE患者血清中HDL重要的抗氧化組分-對氧磷酶 1(paraoxonase 1,PON1)活性降低[11]。藥物應用方面,強的松及羥氯喹的使用與HDL-C升高相關,但目前還沒有研究發現他汀類藥物能改變SLE患者HDL-C水平[12]。
2.2 SLE患者HDL顆粒大小變化 相較于健康人群,SLE患者血清中有不同亞型、不同顆粒大小的HDL,且不同患者炎癥反應、用藥差異均會影響HDL亞型分布。此外,因描述HDL分型的分析方法不同,阻礙了各個研究之間結果的比較。Hua等[13]報道SLE患者中小顆粒HDL含量較低,總體HDL水平較健康對照組高,而Chung等[14]報道SLE患者大顆粒HDL含量較低,總體HDL水平與健康對照組無明顯差異,其他另有研究認為SLE患者與健康對照組在HDL顆粒大小上并無明顯差異[15]。Juárez-Rojas等[16]報道 SLE 患者 HDL3 到HDL2的成熟過程受損,循環中HDL2b下降、HDL3b和HDL3c增加。
2.3 SLE患者HDL顆粒蛋白質和脂質組分變化 SLE患者HDL蛋白質組分變化以apoA-Ⅰ最為顯著。針對SLE青年女性群體,Machado等[9]研究發現HDL-C/apoA-Ⅰ比值高于健康對照組,Juárez-Rojas等[16]分離出的HDL顆粒中apoA-Ⅰ水平明顯下降。而有研究通過比較51例SLE患者和49例健康對照組發現,SLE患者apoA-Ⅰ/HDL比值升高,但總體apoA-Ⅰ水平仍較低[17]。同樣,HDL脂質組分在SLE患者體內也受到損害。Juárez-Rojas等[16]發現SLE患者HDL顆粒脂質成分中膽固醇酯比例降低而三酰甘油比例升高。SLE患者氧化應激和炎性反應導致HDL過氧化反應增強,目前認為HDL的抗氧化作用主要依賴PON1等酶類,最新研究表明SLE患者PON1、PON3濃度及活性較健康人群顯著下降[18]。血清淀粉樣蛋白(serum amyloid A,SAA)是潛在的促炎因子,HDL上的apoA-Ⅰ可被SAA代替,多個團隊研究發現SLE患者HDL上SAA明顯富集[3]。故此推測,因上述HDL顆粒結構發生改變,HDL功能也出現變化。
2.4 趨炎 HDL(pro-inflammatory HDL,piHDL) 研究發現在SLE患者體內,HDL組分發生改變,具有抗感染功能的HDL會轉化為功能紊亂的促炎癥顆粒(pi-HDL),膽固醇的外流能力減弱,無法正常發揮其抗感染、抗氧化功能(圖1)[19]。piHDL的特點在于其所含SAA水平增加,apoA-Ⅰ水平和PON活性降低,SAA會替代apoA-Ⅰ成為HDL的載脂蛋白,降低HDL對動脈粥樣硬化的保護特性。McMahon等[20]報道44.7%的SLE患者piHDL水平增高,而對照組和類風濕性關節炎組的pi-HDL水平分別只有4.1%和20.1%,同時該團隊又進一步利用頸動脈超聲技術發現piHDL水平與頸動脈內膜中層厚度和頸動脈粥樣斑塊的增加呈正相關,提示pi-HDL對SLE亞臨床動脈粥樣硬化的發生、發展有顯著作用。
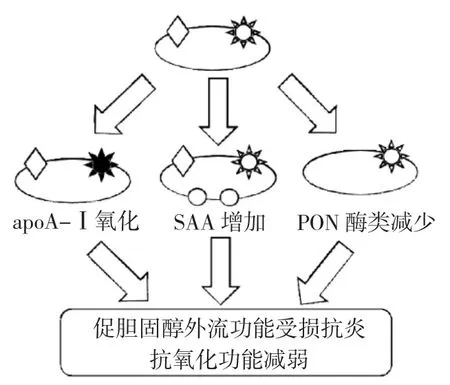
圖1 功能異常的高密度脂蛋白(HDL)
2.5 氧化型高密度脂蛋白(oxidized HDL,ox-HDL) SLE患者體內氧化應激狀態也會使HDL發生結構性變化,已有研究證實SLE患者體內ox-HDL水平較高[21]。當發生氧化應激反應時,髓過氧化物酶(myeloperoxidase,MPO)可在巨噬細胞、單核細胞和中性粒細胞中呈現高表達,利用過氧化氫氧化修飾脂質、蛋白質、核酸和脂蛋白。apoA-Ⅰ作為HDL中的主要部分,MPO通過對apoA-Ⅰ上的酪氨酸殘基86、112、148等位點進行氧化修飾,顯著提高重度氧化的apoA-I水平。有研究報道SLE患者血清中MPO濃度較高,提示SLE患者HDL氧化水平增加可能與MPO之間存在聯系[22]。而除了MPO之外,HDL結構上過氧化脂質以通過使apoA-Ⅰ和apoA-Ⅱ結構中的蛋氨酸特異性氧化和酪氨酸特異性氯化,而促進ox-HDL形成。
最近認為HDL氧化與中性粒細胞外誘捕網(neutrophil extracellular traps,NETs)的形成存在一定聯系。NETs是中性粒細胞在適宜刺激下釋放到胞外的一種纖維網格樣結構,正常生理情況下,NETs起捕獲并殺滅病原體的作用,而目前發現NETs在SLE患者體內降解受阻,導致體內NETs水平異常升高和組織間中性粒細胞浸潤,NETs功能紊亂。Carlucci等[23]研究證實SLE患者外周血中含有一群被稱為低密度粒細胞(low-density granulocytes,LDG)的中性粒細胞亞群,其不僅易產生NETs還易導致血管損傷,且與SLE患者HDL介導膽固醇外流能力減弱相關。研究認為NETs水平升高能促進MPO、一氧化氮合酶(nitric oxide synthase,NOS)、磷酸酰胺腺嘌呤二核苷酸氧化酶(NADPH oxidase,NOX)向胞外轉移,最終促進HDL3氧化[23];另有研究發現在SLE患者NETs形成過程中釋放的MPO、NOX、NOS通過促進HDL 3-氯酪氨酸修飾和3-硝基酪氨酸修飾,抑制NETs形成而減少HDL的氧化[21]。除此之外,目前研究表明NETs成分中的DNA、組蛋白等是SLE患者產生自身抗體的靶抗原,而SLE患者脫氧核糖核酸酶(desoxyribonuclease,DNase)活性降低導致的 NETs清除障礙是其自身抗體產生的始動因素之一[24]。總而言之,這些研究均支持NETs在SLE患者HDL氧化過程中起重要作用的觀點。
3 SLE患者HDL功能的變化
3.1 SLE患者HDL促膽固醇外流能力減弱 HDL將多余的膽固醇從周圍組織(包括動脈粥樣硬化斑塊)轉運到肝臟進行機體的再循環,或以膽酸的形式排泄出體外,這一過程稱作膽固醇逆轉運(reverse cholesterol transport,RCT)。HDL通過促進膽固醇流出以抑制脂毒性和泡沫細胞形成,從而發揮其抑制動脈粥樣硬化的作用。HDL促膽固醇外流功能(cholesterol efflux capacity,CEC)是其抑制動脈粥樣硬化的核心功能之一。從SLE患者體內提取的HDL與健康對照組HDL相比,其促膽固醇外流能力下降15%[21],動脈粥樣硬化非鈣化斑塊成分增多[23]。SLE狀態下氧化應激和炎性反應等導致apoA-Ⅰ和HDL顆粒蛋白質、脂質組分變形、氧化,氨甲酰化等(如前所述),形成過多 piHDL、oxHDL,改變apoA-Ⅰ的結構,影響HDL與細胞表面膽固醇轉運體(如卵磷脂膽固醇酰基轉移酶,lecithin cholesterol acyltransferase,LCTA)結合,導致 CEC 下降。
3.2 SLE患者HDL抗感染功能減弱 動脈管壁內膜發生炎癥反應和脂質異常累積是動脈粥樣斑塊形成的兩個重要誘因。炎癥狀態使血管內皮細胞表面黏附分子表達上調,進而加快粥樣斑塊進程。近年來,HDL能直接抑制動脈粥樣硬化炎癥反應這一說法已被廣泛接受,目前HDL復雜的抗感染機制尚未闡明,但已有幾種信號通路被證實[25]。首先,HDL是巨噬細胞內炎癥反應的主要調節機制,通過上調轉錄抑制因子3(ATF3)抑制toll樣受體(toll-like receptor,TLR)通路,下調白細胞介素(IL)-6、IL-12、腫瘤壞死因子(TNF)等的釋放;HDL還通過抑制單核巨噬細胞中的核因子-κB(NF-κB)信號通路,減少其下游因子如E-選擇素、P-選擇素、細胞間黏附分子-1(intercellular adhesion molecule-1,ICAM-1)、血管黏附分子-1(vascular adhesion molecule-1,VCAM-1)及血小板源性生長因子(platelet-derived growth factor,PDGF)等表達,從而抑制血管炎癥反應。
然而,與正常HDL抗感染反應相反,從SLE患者體內提取的HDL有趨炎作用(上文已述)。Smith等[26]研究發現SLE環境下的HDL無法抑制TLR通路驅動的炎癥反應,可激活NF-κB通路,使單核巨噬細胞炎癥因子TNF-α、IL-6的分泌增加。
SLE患者過量表達ox-HDL,可作為配體與氧化低密度脂蛋白受體-1(lectin-like oxidized low-density lipoprotein receptor-1,LOX-1R)結合,增強局部氧化應激反應,抑制ATF3核轉運,引起NF-κB等細胞因子增加。除此之外,SLE患者的功能異常HDL還可以直接上調血小板源性生長因子受體(platelet-derived growth factor receptors,PDGF-R)-β 和增加TNF-α 釋放[27]。最近研究人員將HDL由正常抗炎能力向異常促炎作用的轉變歸因于SAA,研究表明SLE患者HDL顆粒中SAA含量可以通過影響細胞膜表面“脂筏”的組成成分和結構完整性及其介導的信號轉導,特異性損害HDL的抗感染作用[28]。
3.3 SLE患者HDL抗氧化功能減弱 在普通人群以及SLE患者中,氧化低密度脂蛋白(oxidized low-density lipoprotein,oxLDL)水平升高是公認的CVD危險因素。HDL可保護LDL的脂質和蛋白質組分免受自由基氧化,抑制初級和次級氧化物產生,從而發揮抗氧化作用。SLE患者oxHDL和氧化apoA-Ⅰ的過表達降低了HDL顆粒清除活性氧(ROS)的能力,而piHDL促進LDL氧化的作用使SLE患者過表達oxLDL,促進內皮黏附因子表達和單核細胞的趨化,從而促進泡沫細胞產生。對氧磷脂酶(paraoxonase,PON)作為HDL重要的抗氧化組分,有清除粥樣斑塊、巨噬細胞和脂蛋白中的脂質過氧化物(lipid hydroperoxise,LOOH)作用。SLE患者PON-1活性降低(原因尚不清楚)、抗氧化能力下降,部分研究發現其與患者自身抗體水平(如:抗HDL-IgG、抗β2糖蛋白I抗體等)呈負相關[29]。Marsillach等[18]還發現除了PON-1,PON-3水平在患有亞臨床動脈粥樣硬化的SLE患者明顯降低。
4 SLE患者脂蛋白相關自身抗體形成
自身抗體水平升高是SLE的特征之一。在歐美和日本的SLE患者中抗apoA-Ⅰ抗體陽性率約為7.7%~32.5%,且該抗體滴度與疾病活動度呈正比[30]。諸多學者認為抗apoA-Ⅰ抗體可能通過降低PON活性,促進LDL氧化,被單核巨噬細胞攝取而形成泡沫細胞,且在狼瘡小鼠模型中已證實抗apoA-Ⅰ抗體水平與HDL-C水平、PON-1活性呈負相關[31]。目前認為在SLE患者體內抗apoA-Ⅰ水平升高與無脂apoA-Ⅰ、氧化游離apoA-Ⅰ相關。無脂apoA-Ⅰ在血漿中的表達還與疾病過程中SAA替代HDL中正常apoA-Ⅰ等成分使apoA-Ⅰ部分游離有關。apoA-ⅠMet-148位點氧化導致蛋白質構象改變,apoA-Ⅰ分子C端的α螺旋(對脂質分子具有極高親和性,在apoA-Ⅰ與脂質分子結合過程中起始動作用)轉變為β折疊,引起淀粉樣變并與HDL解離,故而使無脂apoA-Ⅰ水平上升[32]。研究發現,從SLE患者血漿中分離出來的HDL含有高水平蛋白質結合的3-氯酪氨酸和3-硝基酪氨酸量,其分別是健康人1.9倍、120.9倍[21],而這種錯誤折疊的apoA-Ⅰ具有更強的免疫原性,會產生抗原決定簇,誘導體內生成抗apoA-Ⅰ抗體。
抗HDL抗體在SLE患者中也有報道,但抗HDL抗體與抗apoA-Ⅰ抗體之間的差異尚不明確。部分研究發現相較于健康人群和原發性抗心磷脂綜合征患者,SLE患者體內抗HDL抗體滴度更高,且與疾病活動度和PON活性降低相關[33]。在體外試驗中也證實抗HDL抗體、抗apoA-Ⅰ抗體可直接抑制PON1活性,使SLE患者發生CVD風險增加[31]。
Borda等[34]表示與SLE病程密切相關的抗心磷脂抗體(anticardiolipin antibody,aCL),其與 IgG 型抗 apoA-Ⅰ抗體之間存在交叉反應,并且IgG型aCL與血清HDL、apoA-Ⅰ水平負相關,這提示aCL也有可能參與了SLE血脂紊亂的過程。
5 SLE與基于HDL相關治療的研究現狀
他汀類藥物是目前市面上用于治療和緩解CVD的傳統藥物。LAPS研究指出接受2年阿托伐他汀治療的SLE患者頸動脈內膜中層厚度和頸動脈粥樣硬化斑塊與對照組相比無明顯差異[35]。而另一項使用他汀藥物治療的全國性臨床研究發現,SLE高脂血癥患者的CVD病死率降低30%[36],另有學者報道短期應用阿托伐他汀(8周)能改善SLE患者內皮依賴性血管舒張功能[37]。故而目前大樣本長期前瞻性臨床試驗已確定他汀藥物治療SLE是必要的。
重組高密度脂蛋白(reconstituted HDL,rHDL)是由apoA-Ⅰ或apoA-Ⅰ模擬肽在磷脂重組后制備的納米顆粒,自1984年來作為抗動脈粥樣硬化治療藥物被廣泛研究。在動物模型和臨床試驗中已證實靜脈注射rHDL可提高外周循環HDL濃度、快速轉運膽固醇、抑制炎癥介質合成、改善內皮功能、增強整體動脈粥樣硬化保護作用。到目前為止,已有6種不同的藥物在臨床進行測試:SRC-HDL、CSL-111、CSL-112、ETC-216、ETC-642和CER001。其中ETC-216和CSL-111經血管內超聲(IVUS)評估可減少CVD患者的斑塊負擔[30]。與CSL-111相比,CSL-111的新劑型CSL-112由更好的臨床有效性和安全性。rHDL對治療炎癥性疾病如膿毒血癥也有一定作用。HDL可以中和細菌內毒素,調節巨噬細胞的炎癥反應,抑制促炎因子釋放,刺激內皮型一氧化氮合酶(eNOS)的產生。因此注射CSL-111可抑制促炎因子釋放,緩解臨床癥狀。
測試HDL治療在SLE動物模型的假定益處的研究甚少。Woo等[38]研究單獨使用L-4F或與普伐他汀聯合治療SLE在狼瘡小鼠動脈粥樣硬化模型中有顯著積極作用:降低抗ds-DNA抗體、抗磷脂抗體滴度,改善小鼠的腎組織炎癥,減少尿蛋白漏出、氧化脂質和骨質疏松。ETC-642是apoA-Ⅰ模擬肽(ESP24218)和脂質復合物組成的HDL模擬物,Smith等[26]將小鼠巨噬細胞暴露在1∶4的SLE HDL∶ETC-642環境中,觀察細胞培養液中TNF-α、IL-6表達量,并通過對ATF3轉錄及翻譯的表達分析發現,ATF3表達量與rHDL抗炎作用呈正相關,此項研究為開發新藥提供一定可行性思路。到目前為止,rHDL動物實驗治療豐富了HDL功能在SLE并發CVD疾病防治中的證據,但仍需大規模的前瞻性臨床試驗進行驗證。
6 小結
SLE患者并發CVD風險明顯增加,盡早干預SLE患者并發CVD風險的因素十分重要。活動期SLE患者全身氧化應激和炎癥反應活躍,HDL顆粒結構發生改變,這些HDL功能異常促進SLE患者并發CVD的發生和發展,可能是重要的干預靶點。SLE的相關研究豐富了HDL功能在CVD防治中的證據,但仍需大規模的臨床試驗進行驗證。

