慢性乙型肝炎患者血清脂聯素、基質金屬蛋白酶-2與肝纖維化的關系研究*
郭瑞雪,魏新亮,魏思忱
河北省滄州市中心醫院消化二科,河北滄州 061000
全球約有2.4億慢性乙型肝炎(CHB)患者,其中大部分分布在亞洲及非洲,我國CHB患者每年發展為肝硬化的發生率約為2.1%,同時有報道指出每年有約65萬CHB患者死于肝硬化、肝細胞癌及肝功能衰竭[1]。肝纖維化是CHB患者發展為肝硬化前的初始階段,該過程在一定程度上可被逆轉,早期診斷肝纖維化可使CHB患者受益頗多,肝臟組織學檢測為診斷肝纖維化的確診標準,但該檢查為有創檢查,患者痛苦大,不易接受,應用具有很大的局限性[2]。因此,找到一個與之相關的無創生物學標記物,對評估、控制肝纖維化乃至肝硬化均具有重大價值。脂聯素(APN)是脂肪組織特異分泌的脂肪因子具有調節糖脂代謝及抗炎作用,在肝硬化進程中發揮著重要作用。基質金屬蛋白酶-2(MMP-2)具有明顯降解Ⅰ、Ⅳ、Ⅴ型膠原及纖維連接蛋白的作用,在肝纖維化肝硬化發生、發展進程中具有重要意義。本文主要通過酶聯免疫吸附試驗(ELISA)對CHB肝纖維化程度不同的患者進行APN、MMP-2檢測,探討二者與CHB肝纖維化的相關性,現將詳細情況報道如下。
1 資料與方法
1.1一般資料 選擇2018年3月至2019年3月于本院診斷的CHB患者60例,均排除其他類型肝炎病毒感染,肝硬化及肝纖維化診斷參考《病毒性肝炎防治方案》相關標準確定。其中肝纖維化組30例,男20例,女10例,年齡28~55歲,平均(41.5±6.2)歲;肝硬化組30例,男17例,女13例,年齡為36~67歲,平均(46.2±5.8)歲。另選擇同期在本院體檢健康者30例作為對照組,男20例,女10例,平均年齡(56.2±6.5)歲。納入標準:血清學檢測無任何類型肝炎病毒感染,肝功能處于正常狀態,且無糖尿病、腎臟病、心臟病、肥胖癥、腫瘤、自身免疫性及合并嚴重感染等疾病,均無煙酒不良嗜好。本研究經醫院倫理委員會批準,患者及家屬同意并簽署知情同意書。
1.2標本采集 采集3組研究對象隔夜空腹8 h以上肘靜脈血3 mL,4 000 r/min離心5 min后留取上清液,-70 ℃保存備用檢測。
1.3檢測方法 APN及MMP-2均采用ELISA檢測,試劑盒購自北京方程生物科技公司;血清肝纖維化指標透明質酸(HA)、Ⅲ型前膠原(PCⅢ)試劑盒均購自武漢博士德,均按照說明書進行操作;丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)使用日立7600全自動生化分析儀檢測,試劑盒均購自四川邁克生物有限公司;所有受試者均接受肝臟超聲檢查,記錄肝臟門靜脈主干寬度及脾臟大小及厚度。
1.4治療方法 肝纖維化組及肝硬化組患者入組后當天(0周)均接受恩替卡韋抗乙型肝炎病毒治療。恩替卡韋購自正大天晴藥業集團有限公司,劑量為0.5 mg,每天1次,晚飯后2 h服用,持續治療48周。
1.5研究方法 于0、24、48周分別比較APN及MMP-2水平,明確二者在CHB不同階段的差異;分析APN、MMP-2水平與AST/ALT、肝纖維化指標間相關性,明確二者評價CHB患者病變程度的可行性;治療48周時,將肝纖維化組和肝硬化組60例患者劃分為改善組及未改善組,通過比較明確APN、MMP-2對治療效果的評估效果。改善標準:(1)HA及PCⅢ下降60%以上;(2)肝門脈主干內徑恢復正常或接近正常,或脾臟縮小。
2 結 果
2.13組受試者各時期APN、MMP-2比較 3組受試者 0、24、48周APN、MMP-2水平由高至低均為肝硬化組、肝纖維化組、對照組,兩兩比較,差異均有統計學意義(P<0.05);組內各時期對比,肝硬化組、肝纖維化組隨時間延續,APN、MMP-2水平均下降,差異有統計學意義(P<0.05)。見表1。

表1 3組患者各時期APN、MMP-2比較
注:與對照組同期相比,*P<0.05;與肝纖維化組同期相比,#P<0.05;與同組0周時相比,△P<0.05;與同組24周時相比,▲P<0.05。
2.2APN、MMP-2與肝功能、肝纖維化指標間相關性分析 90例受試者(0、24、48周)3個時間點所有數據行相關性分析,結果顯示APN、MMP-2與AST/ALT、HA及PCⅢ呈正相關(P<0.05)。見表2。
2.3APN、MMP-2對治療效果的評估情況 以60例肝纖維化及肝硬化患者為研究對象,治療48周時,改善組29例,未改善組31例,改善組APN、MMP-2見表3。
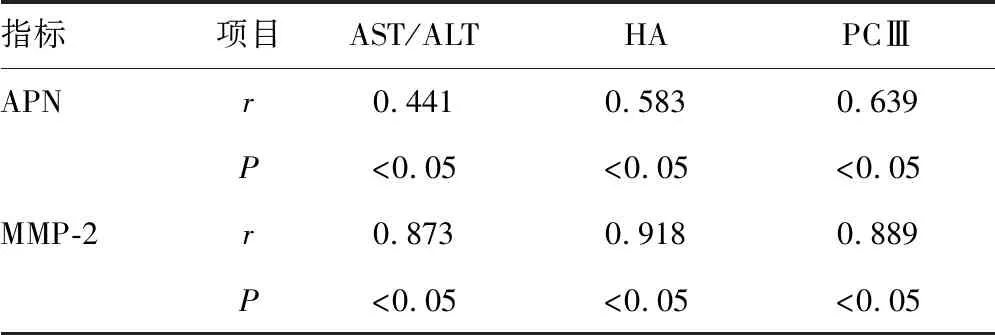
表2 APN、MMP-2與肝功能、肝纖維化指標間相關性

表3 APN、MMP-2對治療效果的評估情況
注:與同組0周時比較,*P<0.05;未改善組48周時比較,#P<0.05。
3 討 論
根據2013年全球疾病負擔(GBD)研究,肝硬化是世界不同地區患者10種最常見的死亡原因之一,也是發達國家患者死亡的第6位原因[3]。我國是乙型肝炎大國,約有1.2億CHB患者,其中有20%~30%發展為肝硬化,2%~5%肝硬化患者最終發展為肝細胞癌。這提示乙型肝炎患者若得不到及時治療,將經歷“肝炎-肝纖維化-肝硬化-肝癌”的病程。肝纖維化是肝炎發展為肝硬化的必經過程,在一定程度上可被逆轉,早期診斷治療甚至可避免肝硬化的發生、發展,肝組織活檢被定義為肝纖維化的“金標準”,但肝穿刺為有創檢查,患者多不易接受,此外肝纖維化在結構分布上是不均勻的,活組織檢查取得的樣本少,可能并不代表主要的肝臟病理學,出現漏診[4]。目前有研究提出了一系列生化和血液學血清標志物作為肝纖維化的預測因子,包括基質金屬蛋白酶(MMPs)、膠原蛋白亞型、血小板計數、AST、ALT、AST/ALT、APN等,這些標志物的各種組合被用于肝臟疾病的診斷,其中AST/ALT越高,說明肝臟損傷越重[5]。
APN是一種含有244個氨基酸的脂肪細胞因子,具有增強胰島素敏感性、調節糖脂代謝、抑制炎性反應、抗動脈粥樣硬化等多重作用,目前在肝纖維化相關研究中已證實,APN可上調NO[6],以及抑制增殖細胞核抗原(PCNA)和α平滑肌肌動蛋白(αSMA)的表達,αSMA是肝星狀細胞(HSC)激活的標志物,用來維持HSC處于靜止狀態[7]。近來有研究指出,APN可預測具有較輕組織學發現的患者的壞死性炎癥分級和纖維化分期,其水平的持續升高可能反映了肝功能的進行性惡化[8]。既往已知HA是HSC合成的黏多糖,是目前發現反映肝纖維化最具價值的指標,PCⅢ與肝臟炎癥壞死程度相關。本研究結果顯示,APN水平在肝硬化組高于肝纖維化組,并均顯著高于對照組,且與HA、PCⅢ呈正相關,進一步證實了APN水平的升高可以反映肝臟的持續惡化,與肝纖維化發生、發展關系密切。這一點在其他學者的研究中得到了支持,KALAFATELI等[9]以酒精性肝硬化患者為研究對象,發現患者中APN水平隨肝硬化Child-Pugh分期及終末期肝病模型(MELD)評分升高而升高,且APN水平持續升高,患者生存期明顯縮短。此外,肝臟病變時高APN水平可能與肝硬化時APN清除減少,以及肝硬化時膽汁淤積,膽汁排泄減少相關[10]。
肝纖維化是一個復雜的動態過程,實質是細胞外基質(ECM)合成大于降解。MMPs是含鋅內肽酶家族,其負責在病理和生理條件下降解ECM蛋白。MMP-2又名明膠酶-A,在人體內被發現是最敏感的,也是臨床上慢性肝病的標記物,因為其活性在肝硬化的所有階段都增加,故其表達水平對肝病患者病情進展的評估有一定的臨床價值[11]。MMP-2在肝病患者的肝組織中表達很強,其中HSC被認為是MMPs的主要來源,肝病患者HSC被活化,MMP-2生成增加,活化的MMP-2降解變性膠原及纖維連接蛋白,裂解Ⅰ型膠原,同時促進HSC的增殖,在肝纖維化的啟動和形成中起到重要作用。本研究結果顯示,肝硬化組及肝纖維化組MMP-2水平均顯著高于對照組,以肝硬化組尤甚,HA、PCⅢ呈正相關,證實了MMP-2水平可用于反映肝臟的持續惡化。閆瑞斌等[12]的研究證實了這一點,他指出慢性肝炎患者中MMP-2和TIMP-2隨肝纖維化加重而表達增加。此外,肝硬化本身是一個持續炎性反應過程,隨Child-Pugh分級升高,炎癥活動更為明顯,在此過程中MMP-2增強許多促炎細胞因子的活性,如腫瘤壞死因子α(TNF-α)、白細胞介素-1β(IL-1β)、CXC趨化因子配體8(CXCL-8),所以在各種肝臟疾病中觀察到MMP水平的波動,且隨Child-Pugh分級升高而升高[13]。
對乙型肝炎患者進行核苷類似物治療的研究表明,肝臟組織學可在抗病毒后明顯改善。在本研究中,60例患者接受抗病毒藥物治療后,其中29例治療48周時的APN、MMP-2明顯降低,且APN、MMP-2與肝功能、肝纖維化指標間呈正相關。因此,APN、MMP-2不僅可作為CHB肝纖維化患者的標記物,對篩選肝硬化患者起到一定作用,同時還可作為評估抗病毒治療療效的指標。
總之,APN、MMP-2在CHB患者肝纖維化進展中作用較大,與肝功能等指標聯合檢測有助于肝纖維化、肝硬化的診斷,并且可用于抗病毒治療后的療效評估,或許可以為臨床工作提供新的思路。

