腹腔鏡前列腺癌根治術聯合輔助療法治療高危前列腺癌的早期效果分析
王大明 謝棟棟 于德新 丁德茂 張志強 劉志奇 孫 偉 李博聞
安徽醫科大學第二附屬醫院泌尿外科(合肥 230000)
近年來,隨著人口老齡化及生活水平的提高,我國前列腺癌的發病率和病死率均呈持續增長趨勢[1]。 由于我國PSA 篩查存在地區差異, 約70%的患者發現時已是高危進展性前列腺癌,甚至是晚期[2]。《2014 版中國泌尿外科疾病診斷治療指南》 對高危前列腺癌的定義:PSA >20 ng/ml 或臨床分期≥T2c 或Gleason 評分≥8分[3]。 中國泌尿外科學會(CUA)和歐洲泌尿外科學會(EUA) 指南均提出手術應作為高危前列腺癌綜合治療的手段之一[3,4],但有研究指出對單純接受根治術的高危前列腺癌患者術后進行跟蹤, 術后生化復發率可達55%~70%[5], 因此高危前列腺癌治療可以手術為核心的包括新輔助治療、術后輔助治療等綜合性治療,目前國內無統一標準, 治療方式多樣, 本研究回顧性分析2013 年6 月至2017 年9 月于我院行手術及聯合輔助治療的高危前列腺癌患者, 探討手術與各種輔助治療結合的初期效果,現報道如下:
資料和方法
一、一般資料
收集2013 年6 月至2017 年9 月我科前列腺癌患者信息,納入標準:診斷為高危前列腺癌,行腹腔鏡前列腺癌根治術,隨訪信息齊全。 排除標準:初始資料不全;腫瘤侵犯直腸、盆壁、骨轉移>3 處或遠處轉移;隨訪過程中信息不全;隨訪間隔時間>3 個月;隨訪中治療方案更改或外院治療隨訪;生存期小于24 個月。 根據納入和排除流程圖(見圖1),共有69 例高危前列腺癌患者納入, 根據治療方式不同分為腹腔鏡前列腺癌根治術加上術后長期行內分泌治療(radical prostatectomy+adjuvant hormone therapy,RP+AHT) 組37 例、術前新輔助內分泌治療加上腹腔鏡前列腺癌根治術及術后再行內分泌治療組(neoadjuvant hormone therapy+radical prostatectomy+adjuvant hormone therapy,NHT+RP+AHT)組21 例、術前新輔助化療聯合雄激素剝奪治療加上腹腔鏡前列腺根治術及術后再行內分泌治 療(neoadjuvant chemohormonal therapy + radical prostatectomy + adjuvant hormone therapy,NCHT+RP+AHT)11 例。
二、治療方法
腹腔鏡下前列腺癌根治術加上盆腔淋巴結清掃術,先清掃髂外動脈,下至腹股溝內環,上至輸尿管與髂外動脈交叉處, 髂外動脈與髂外靜脈之間淋巴結亦清除。 沿髂總動脈向下清掃髂內動脈,清掃閉孔旁淋巴結,常規探查骶前、髂總淋巴結,如術前影像學檢查提示或術中探查發現髂總、骶前淋巴結可疑則一并清掃。兩側清掃的淋巴結逐個分離、 標記解剖部位并送病理檢查,然后切除前列腺。
內分泌治療, 比卡魯胺50 mg 每日1 次口服加上戈舍瑞林3.6 mg 或亮丙瑞林3.75 mg 每月1 次皮下注射或曲譜瑞林3.75mg 每月一次肌注。
新輔助化療聯合雄激素剝奪治療: 多西他賽(75 mg/m2,靜脈滴注,第1 天)聯合口服潑尼松(5 mg,每天2 次,第1~21 天)的3 周方案化療,在輸注多西他賽前12、3 和1 h,分別口服地塞米松7.5 mg,同時接受亮丙瑞林或曲譜潤林的雄激素剝奪治療。
三、研究目標
主要研究目標為PSA 無進展生存期(Progressive-free survival,PFS),即從開始前列腺癌治療至進展為生化復發的時間, 三組術后并發癥發生情況(根據Clavien-Dindo 嚴重程度分級系統進行分級)、尿控恢復情況(每日使用0~1 張尿墊為尿控基本恢復正常,每日使用2~3 張為輕度尿失禁)、病理切緣、術前新輔助治療后的病理變化。 住院或門診定期復查,每1-3 月復查PSA、睪酮、肝功能等, 每6~12 月復查超聲、MRI 及骨骼ECT 等,隨訪時間24~60 月,中位隨訪時間41 月。
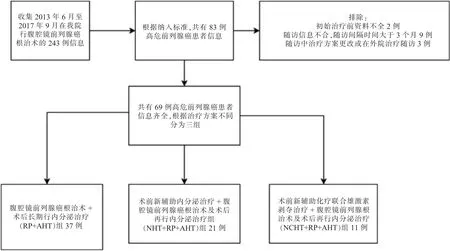
圖1 高危前列腺癌納入、排除及分組流程圖
四、統計方法
采用SPSS19.0 統計軟件處理數據,Kolmogorov-Smirnov 方法檢驗計量資料是否符合正態分布,非正態分布的資料用M(全距)表示,計數資料用百分比表示,采用kruskal-wallis 檢驗和卡方檢驗比較, 卡方檢驗組間比較采用Bonferroni 校對檢驗,應用GraphPad Prism分析PSA 無進展生存期,以P<0.05 為差異有統計學意義。
結 果
三組在年齡、BMI、初始PSA、前列腺體積、Gleason評分、TNM 分期比較無差異(P>0.05)。RP+AHT 組術后AHT 療程21(8-24)次;NHT+RP+AHT 組術前NHT 療程3(3~8)次,術后AHT 療 程18(10~24)次;NCHT+RP+AHT 組術前NCHT 療程4(3-6)次,術后AHT 療程13(7-18)次。(見表1)
隨訪時間為24-60 月,RP+AHT 組進展為生化復發例數22 例(59.5%),NHT+RP+AHT 組進展例數10例(47.6%),NCHT+RP+AHT 組進展例數6 例(54.5%),PSA 無進展生存期及術后病理示切緣陽性例數三組比較無差異(P>0.05)(表2)。 三組患者采用GraphPad Prism 分析PSA 無進展生存曲線(圖2),無統計學差異(P=0.65)。
術中并發癥:RP+AHT 組1 例直腸損傷,術中予以縫合修補, 術后禁食及腸外營養支持治療后治愈;NCHT+RP+AHT 組1 例術中大出血,予以輸血400ml。術后并發癥Clavien-Dindo 分級, 三組無IV 級和V 級并發癥,RP+AHT 組:Ⅰ級6 例(發熱和疼痛),Ⅱ級9例(吻合口漏尿4 例、不全性腸梗阻1 例、出血予以輸血1 例、下肢靜脈血栓抗凝治療1 例、淋巴漏1 例、陰囊及下肢水腫1 例);NHT+RP+AHT 組:Ⅰ級6 例(發熱和疼痛),Ⅱ級3 例(吻合口漏尿2 例、出血予以輸血1 例),Ⅲ級1 例(1 例患者術后2 天內出現每日尿量約400ml,肌酐進行性升高,最高達532umol/L,診斷為急性腎功能不全,排除藥物毒性和腎前性因素,行CT 檢查示雙腎積水,輸尿管擴張,局麻行膀胱鏡檢查示吻合口距離雙側輸尿管口較近,周圍損傷水腫所致,予以輸尿管置管后好轉);NCHT+RP+AHT 組:Ⅰ級3 例(發熱和疼痛),Ⅱ級2 例(吻合口漏尿),并發癥發生率三組無顯著差異(P>0.05)(表2)。 三組術后1 月、3 月、6 月尿控恢復例數無顯著差別(P>0.05)(表2),術后12 月三組患者尿控基本完全恢復。
NHT+RP+AHT 組術后病理變化示:1 例微小殘留灶(少量癌細胞及大量泡沫細胞),1 例術前穿刺Gleason 評分4+4 分, 術后為4+3 分, 其它未見明顯變化。NCHT+RP+AHT 組術后病理變化示:2 例術后病理完全緩解(pathologic complete response,pCR)大量泡沫細胞未見癌細胞,2 例微小殘留灶, 余7 例病理未見明顯變化。
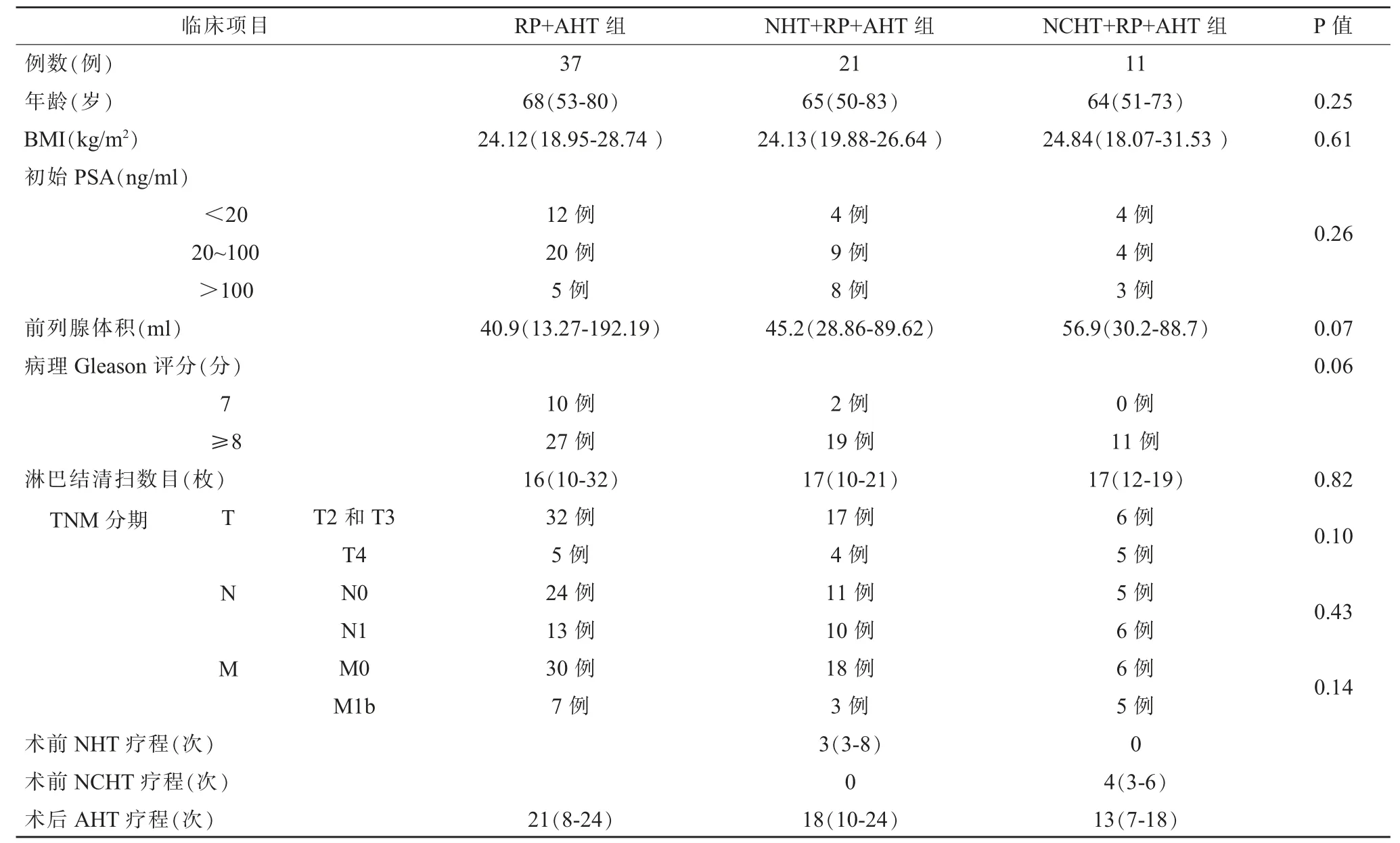
表1 各組一般臨床資料對比及治療療程
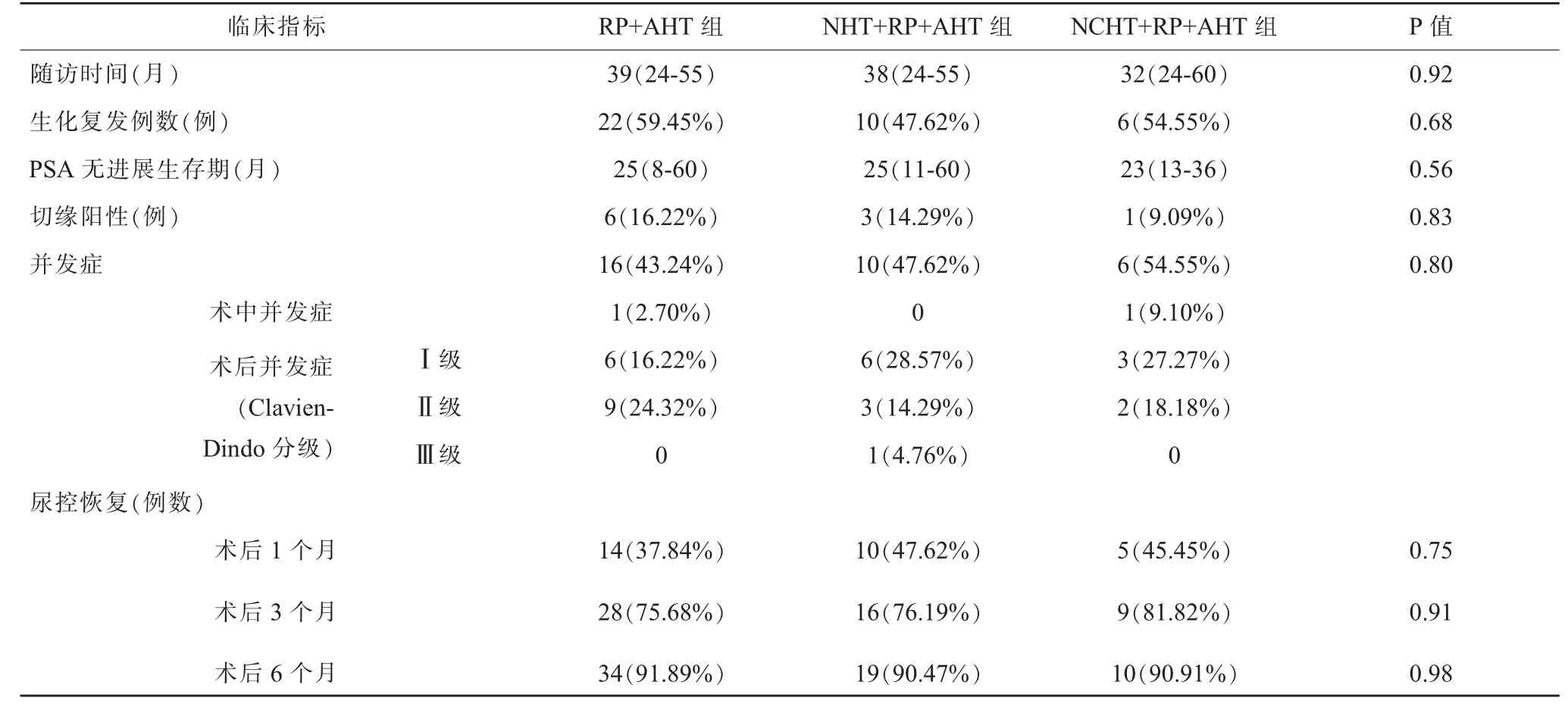
表2 三組術后臨床指標比較
討 論
高危前列腺癌患者在總體生存率和腫瘤特異性生存率方面可以從RP 治療中獲益,根治術能很好地控制局部原發腫瘤,以及根據術后病理Gleason 評分及分期采取監測及輔助治療, 而且是決定開展綜合治療方法和時機的重要指標[6]。 隨著手術技術進步及輔助治療的發展, 目前對于少量骨轉移的前列腺癌患者可行減瘤性根治性前列腺切除術(cytoreductive prostatectomy,CRP),可延長患者的無疾病進展生存期和總生存期,同時手術并發癥并未增加[7]。CRP 的目的在于減少腫瘤的負荷、提高輔助治療效果,減少腫瘤導致的血尿和疼痛等,但不能達到根治的目的,因此,在選擇病例時需要進行嚴格的篩選或術前多學科討論, 目前CRP 研究的焦點在于少量寡轉移的前列腺癌患者, 對于骨轉移病灶>5 處、盆腔局部固定無法切除、身體狀態無法耐受手術或預期壽命不長的患者,均為CRP 的禁忌證,另外無論CRP 還是RP, 盆腔局部應盡量予以根治性切除,在不增加并發癥的同時,盡量減少切緣陽性率,這樣術后輔助治療效果最佳[8]。 目前對于高危前列腺癌不推薦常規行擴大盆腔淋巴結清掃,雖然有利于病理分期,但Yaxley 等[9]研究中、高危前列腺癌患者接受擴大和標準淋巴結清掃的治療效果比較, 擴大淋巴結清掃對患者的預后并無顯著改善。 本研究三組在清掃淋巴結數目上對比無差別。
對于高危前列腺癌輔助治療方法及時機的選擇目前有較多爭議,Shelley 等[10]指出根治手術前的輔助內分泌治療可以改善病理結果, 但不能提高無生化復發生存期和總生存期,2016 年EAU、NCCN 指南均不推薦除臨床試驗外對高危前列腺癌患者行術前NHT[11-12],但近期Tosco 等[13]研究1170 例單純行RP 和403 例術前行NHT 再行RP 對比前列腺癌相關死亡率, 發現術前NHT 能明顯降低前列腺癌患者相關死亡率,Shintaro等[14]研究指出根治術前化療能明顯降低高危前列腺癌生化復發風險及改善病理。 本研究通過對比術前新輔助內分泌治療、 單純術后內分泌治療及術前新輔助化療治療,雖然三組在PSA 無進展生存期、術后病理切緣陽性例數上無明顯差別,但術前NHT 或聯合化療能給分級、分期較高的患者提供手術機會,可減少切緣陽性及提高切除率,不增加術后并發癥及尿失禁的發生,并出現明確的病理改善, 尤其新輔助化療組2 例患者出現完全病理緩解(pCR),2 例患者術后病理示微小殘留癌細胞。 有研究指出激素敏感性前列腺癌為一種高度異質性疾病, 在初治階段就已存在雄激素敏感的細胞克隆和雄激素不敏感的細胞克隆, 早期化療可以極早地抑制甚至殺滅雄激素受體陰性的細胞克隆, 降低瘤負荷,從而使前列腺癌患者遠期生存獲益[15]。 雖然三組手術并發癥發生率無差別, 但RP+AHT 組術中出現1例直腸損傷, 其它兩組未出現, 對于瘤體較大, 術前MRI 檢查示前列腺與直腸分界不清的高危前列腺癌患者,術前予以新輔助治療待瘤體縮小,無明顯粘連后再行手術可避免術中直腸損傷。 對于術中膀胱頸口切除較多的,重建吻合時注意雙側輸尿管口位置,避免造成輸尿管口損傷,必要時術中放置支架管予以標記。 本研究中術前無新輔助治療直接行根治性手術患者占多數,無進展生存期與其它兩組無差別,除手術切除率高外,術后及時、長程內分泌治療起到重要作用,無論術前有無輔助治療, 高危前列腺癌術后即刻予以內分泌治療可控制疾病進展及轉移, 有助于改善高危前列腺癌的預后[16]。
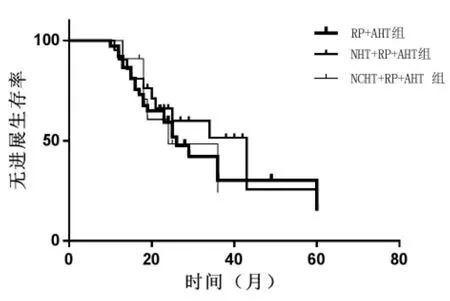
圖2 三組PSA 無進展生存期曲線對比
目前在高危前列腺癌治療方面,國內無統一標準,本研究發現術前是否新輔助治療在無進展生存期上無明顯差別,可能研究例數較少,受限于單中心、回顧性研究,造成結果有所偏倚,需要多中心、大樣本的長時間隨訪研究, 但發現術前新輔助治療出現明顯的病理改善,為后期治療提供幫助,延長總體生存期,內分泌治療目前仍為高危前列腺癌治療的基石, 聯合化療使患者受益明顯,為部分患者提供手術機會,增加手術切除率及減少切緣陽性, 術后即刻及長程的內分泌治療有助于控制疾病進展。

