C反應(yīng)球蛋白分析方法的研究進(jìn)展
唐銘擎 毛旭華 龔易昕悅 青琳森 謝靜
摘?要?C反應(yīng)球蛋白(CRP)作為一種重要的急性炎癥與感染性疾病相關(guān)生物標(biāo)志物, 臨床上常被用于多種疾病的評(píng)估與病情監(jiān)測(cè)。目前, CRP的臨床檢測(cè)方法主要有免疫比濁法、酶聯(lián)免疫吸附比色法和側(cè)向流免疫層析法等。近年來, 隨著分析理論和材料學(xué)研究的發(fā)展, 生物傳感技術(shù)、微流控技術(shù)等新的分析方法與技術(shù)不斷涌現(xiàn)。本文綜述了CRP的分析方法的開發(fā)與應(yīng)用情況, 重點(diǎn)評(píng)述了近五年的最新進(jìn)展, 展望了新型CRP檢測(cè)方法的研究方向, 以期為開發(fā)高靈敏度、高特異性、更能滿足臨床需求的CRP分析方法提供參考。
關(guān)鍵詞?C反應(yīng)球蛋白; 診斷; 免疫測(cè)定; 生物傳感器; 微流控技術(shù); 即時(shí)檢測(cè); 評(píng)述
1?引 言
C反應(yīng)球蛋白(C-reactive protein, CRP)是由5個(gè)相同亞基以非共價(jià)形式結(jié)合而成的五聚體, 是肝細(xì)胞合成的急性期蛋白之一[1]。人體CRP水平在機(jī)體受到感染或損傷時(shí)急劇上升, 因此CRP可作為炎癥指標(biāo), 輔助診斷炎癥相關(guān)性疾病[2]。CRP分析方法改進(jìn)研究也一直是檢驗(yàn)醫(yī)學(xué)和生物分析化學(xué)領(lǐng)域的熱點(diǎn)研究問題。目前, CRP檢測(cè)以免疫分析為主, 其中應(yīng)用最廣泛的有濁度分析法、酶聯(lián)免疫吸附法和側(cè)向流免疫層析法等[3]。隨著分析理論和材料學(xué)研究的發(fā)展, 多種學(xué)科交叉融合, 逐漸涌現(xiàn)出一些新穎的CRP檢測(cè)技術(shù), 如生物傳感技術(shù)、微流控技術(shù)和質(zhì)譜法等。這些新檢測(cè)技術(shù)的出現(xiàn), 滿足了臨床CRP檢測(cè)對(duì)高靈敏度、寬檢測(cè)范圍、即時(shí)檢測(cè)與多重生物標(biāo)志物檢測(cè)的新需求, 為未來進(jìn)一步改進(jìn)CRP分析法提供了新思路。
2?CRP臨床監(jiān)測(cè)意義
CRP是人體急性時(shí)相蛋白(APP)中最靈敏的反應(yīng)指標(biāo), 在正常人體內(nèi)含量低, 通常低于10 μg/mL[4]。當(dāng)機(jī)體受到感染或組織損傷時(shí), 血內(nèi)CRP水平可在48 h內(nèi)迅速上升1000倍[2]。因此CRP可作為明確炎癥指標(biāo), 輔助診斷新生兒敗血癥[5]、膿毒血癥[6]、代謝疾病[7~9]、蕁麻疹[10]、抑郁[11]、腫瘤(除白血病外)[12]等炎癥相關(guān)性疾病的診療工作; 或用于判斷呼吸道感染來源, 避免抗生素的濫用[13, 14]。
手術(shù)后患者易感染并發(fā)癥, 影響血內(nèi)CRP濃度下調(diào)恢復(fù)[2]。因此, 常需連續(xù)監(jiān)測(cè)患者CRP水平, 用于判斷患者手術(shù)后是否感染并發(fā)癥[15~18]。研究發(fā)現(xiàn), CRP能上調(diào)血管損傷因子和多種炎癥因子水平, 參與早期冠心病與粥動(dòng)脈樣硬化形成機(jī)制[19]。近年的研究也證明, CRP濃度上調(diào)可用于預(yù)測(cè)多種心血管疾病發(fā)病率[20~23]。
Ansar等[2]詳細(xì)綜述了血漿CRP濃度與多種疾病發(fā)病進(jìn)程和預(yù)后的相關(guān)性, 充分體現(xiàn)了CRP分析的臨床應(yīng)用價(jià)值。
3?CRP分析方法概述
CRP作為存在于血液中的微量蛋白, 受基質(zhì)干擾大, 通過免疫分析可實(shí)現(xiàn)其特異性檢測(cè)[24]。在識(shí)別分子(主要包括CRP特異性抗體、核酸適配體、磷酸酰膽堿、磷酸乙醇胺等)上修飾不同的示蹤材料, 當(dāng)識(shí)別分子與樣品中CRP的特異性結(jié)合后, 示蹤材料聚集產(chǎn)生檢測(cè)信號(hào), 再直接或聯(lián)用其它檢測(cè)技術(shù)讀取檢測(cè)信號(hào), 實(shí)現(xiàn)對(duì)樣品中CRP的定性或定量分析。本節(jié)簡(jiǎn)要概述了現(xiàn)有CRP分析方法及其分析特點(diǎn)(表1)。
3.1?經(jīng)典分析方法及其改進(jìn)
經(jīng)典的CRP分析方法有免疫比濁法(Immunoturbidimetry, ITM)、酶聯(lián)免疫吸附測(cè)定法(Ezyme linked immunosorbent assay, ELISA)和側(cè)向流免疫層析法(Lateral flow assay, LFA)等。
特異性抗體與靶標(biāo)抗原結(jié)合會(huì)形成不溶性免疫復(fù)合物, ITM法利用此時(shí)體系產(chǎn)生的濁度變化完成樣品的定性和定量分析。ITM法一般聯(lián)用比濁計(jì)讀取濁度信號(hào), 具備方便快捷、檢測(cè)范圍寬等優(yōu)點(diǎn), 是目前臨床工作中最常用的CRP檢測(cè)方法之一。ITM法的主要缺陷在于檢測(cè)靈敏度低, 為此, 研究者不斷地進(jìn)行了多種方案改進(jìn)。例如, Yang等[25]將光射流激光技術(shù)引入免疫比濁測(cè)試, 能有效放大濁度檢測(cè)信號(hào), 從而增加檢測(cè)靈敏度。
ELISA法是通過酶標(biāo)抗體特異性捕獲靶標(biāo)抗原, 然后利用抗體上的標(biāo)記酶催化底物顯色, 實(shí)現(xiàn)樣品比色分析。酶標(biāo)儀配合商業(yè)化的ELISA試劑盒是臨床實(shí)驗(yàn)室CRP測(cè)定的主要選擇。雖然ELISA法已廣泛應(yīng)用于臨床樣品檢測(cè), 但仍具有操作步驟繁瑣、耗時(shí)長等缺點(diǎn), Kim等[26]用毛細(xì)管取代傳統(tǒng)微孔板作為固相載體, 無需繁瑣的試劑添加與洗滌工藝, 即可在30 s內(nèi)得到顯色結(jié)果。
LFA法基于層析原理, 使含有CRP的樣品液在纖維素膜毛細(xì)力作用下能快速與檢測(cè)線和質(zhì)控線上包埋的標(biāo)記抗體特異性結(jié)合, 隨后通過檢測(cè)示蹤材料的聚集產(chǎn)生響應(yīng)信號(hào), 完成樣品液檢測(cè)。LFA分析時(shí)間短、操作簡(jiǎn)便易行, 但經(jīng)典LFA檢測(cè)方法檢測(cè)范圍狹窄, 一般只能滿足定性檢測(cè)要求。為增加檢測(cè)靈敏度、實(shí)現(xiàn)定量檢測(cè), 研究者通過替換檢測(cè)性能更強(qiáng)的示蹤材料[27~30]、去除抗體比例不合適而導(dǎo)致假陰性的鉤狀效應(yīng)(Hook effect)[31,32]等方式, 獲得了更寬的檢測(cè)范圍與更低的檢出限。
3.2?生物傳感器(Biosensor)
生物傳感器技術(shù)是一種將樣品中CRP濃度轉(zhuǎn)化為物理化學(xué)信號(hào)(如電信號(hào)、光信號(hào)等)的分析技術(shù), 主要利用識(shí)別分子捕獲CRP, 理化換能器(如場(chǎng)效應(yīng)管、壓電晶體等)轉(zhuǎn)化或放大濃度信號(hào), 實(shí)現(xiàn)CRP定量分析。生物傳感器技術(shù)形式多變, 現(xiàn)已成為建立新型CRP檢測(cè)方案的主要研究方向之一, 根據(jù)檢測(cè)原理可將其分為電化學(xué)生物傳感器、光學(xué)生物傳感器和其它形式的生物傳感器等。
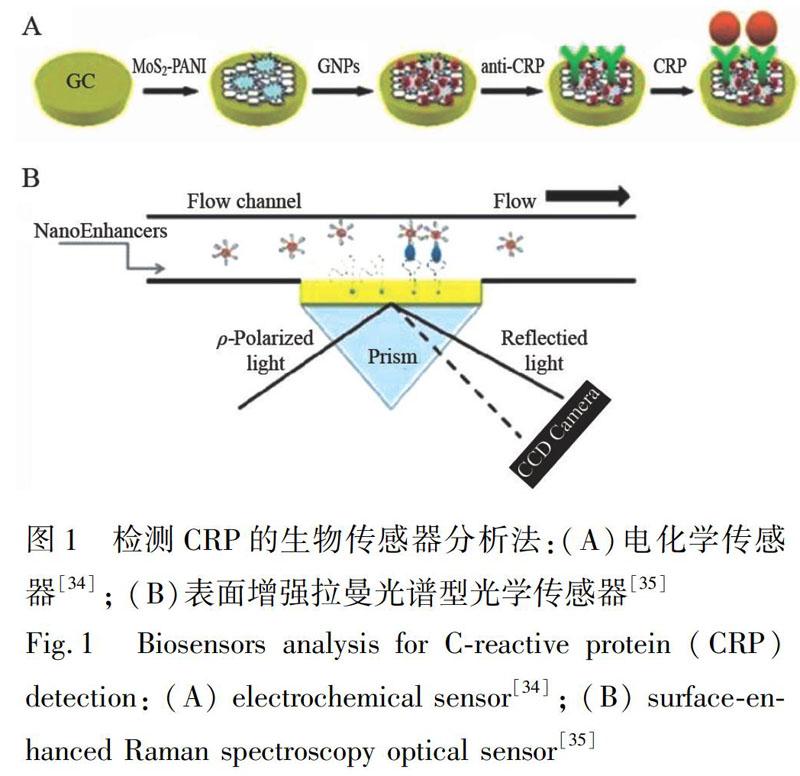
電化學(xué)生物傳感器(圖1A)通過感受檢測(cè)體系中電信號(hào)變化實(shí)現(xiàn)樣品分析。根據(jù)響應(yīng)信號(hào)的不同分為安培型和阻抗型兩類。安培型傳感器主要觀測(cè)恒定電壓下工作電極的電流變化實(shí)現(xiàn)樣品分析[33], 阻抗型傳感器則是通過檢測(cè)電極表面粘附材料的電容、電荷轉(zhuǎn)移電阻或電容變化實(shí)現(xiàn)樣品分析[34]。相較于安培型傳感器, 阻抗型傳感器是在小幅正弦電壓下進(jìn)行檢測(cè), 對(duì)樣品蛋白與抗體影響小, 可實(shí)現(xiàn)無損檢測(cè), 且無需標(biāo)記, 簡(jiǎn)單實(shí)用。
光學(xué)生物傳感器通過感受檢測(cè)體系中單束或多束光的光學(xué)信號(hào)變化實(shí)現(xiàn)樣品分析。目前, CRP光學(xué)生物傳感器按檢測(cè)信號(hào)不同可分為五類, 分別為基于評(píng)估體系顏色變化的比色型傳感器[36, 37]、基于評(píng)估體系發(fā)光信號(hào)強(qiáng)度的發(fā)光型傳感器[38, 39]、基于評(píng)估體系反射率變化的反射光譜型傳感器[40]、基于評(píng)估透射率變化的透射光譜型傳感器[41]和基于評(píng)估拉曼散射信號(hào)變化的表面增強(qiáng)拉曼光譜型(Surface-enhanced Raman spectroscopy, SERS)傳感器[35]。其中, SERS是化學(xué)和生物醫(yī)學(xué)分析中最為敏感的技術(shù)之一(圖1B)。將貴金屬作為傳感器基底, 通過SERS技術(shù)放大拉曼信號(hào), 增強(qiáng)檢測(cè)信號(hào)強(qiáng)度, 檢出限可降低至5 fg/mL[42]。
除了上述研究較多的電化學(xué)與光學(xué)傳感器外, 還有基于光熱效應(yīng)[43]、光磁效應(yīng)[44]、巨磁阻抗效應(yīng)[45]、壓電效應(yīng)[46]等原理研發(fā)的新型CRP生物傳感器, 以及聯(lián)用SERS檢測(cè)技術(shù)與圖像編譯分析技術(shù)的復(fù)合式納米成像傳感器等[47,48]。
3.3?微流控技術(shù)(Microfluidics)
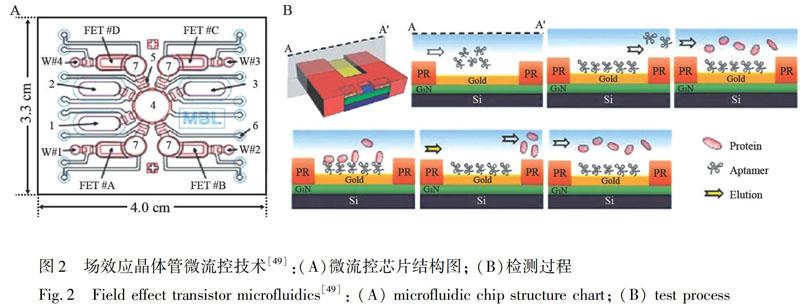
微流控技術(shù)是指利用微機(jī)電系統(tǒng), 將樣品制備、反應(yīng)、分離、檢測(cè)等基本操作單元集成于微米級(jí)的芯片上, 能自動(dòng)完成免疫分析全過程的分析檢測(cè)技術(shù)。相較于經(jīng)典分析方法, 微流控技術(shù)不僅對(duì)樣品需求量小(僅幾微升)、操作便捷快速, 還能實(shí)現(xiàn)多種生物標(biāo)志物的同時(shí)分析, 是目前臨床體外分析技術(shù)的主要研究熱點(diǎn)。最常見的微流控檢測(cè)模式, 以Sinha等[49]建立的場(chǎng)效應(yīng)晶體管微流控技術(shù)為代表。在檢測(cè)芯片上集合多個(gè)檢測(cè)腔室(圖2A), 每個(gè)腔室獨(dú)自完成不同生物標(biāo)志物的全分析處理過程(圖2B), 具備拓展成為多重指標(biāo)分析方法的潛力。Chu等[50]用鋁鎵氮/鎵氮作為微流控芯片基底材料, 能屏蔽生物樣品中的高電解質(zhì)影響, 可直接測(cè)定人血清中CRP水平。
3.4?質(zhì)譜法(Mass spectrometry, MS)
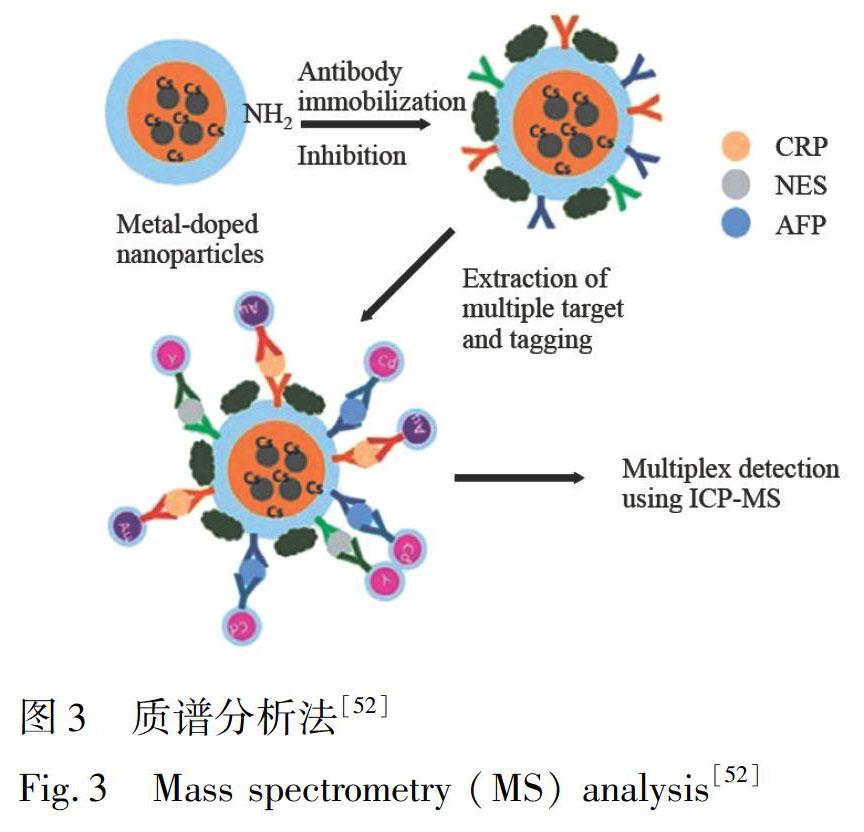
質(zhì)譜具備高度靈敏的檢測(cè)性能, 能識(shí)別分子間微小差異, 實(shí)現(xiàn)多種生物標(biāo)志物的同時(shí)檢測(cè)。例如, Gao等[51]將磁珠與抗體偶聯(lián)使蛋白能快速從樣品液中分離, 以氨基酸標(biāo)記的重組靶蛋白為內(nèi)標(biāo), 基質(zhì)輔助激光解析串聯(lián)飛行時(shí)間質(zhì)譜直接分析蛋白質(zhì)含量, 可同時(shí)測(cè)定包括CRP在內(nèi)的4種生物標(biāo)志物。Ko等[52]結(jié)合免疫分析原理, 以不同金屬摻雜的納米顆粒為示蹤材料,
以電感耦合等離子體質(zhì)譜檢測(cè)信號(hào), 可間接實(shí)現(xiàn)多種生物標(biāo)志物的同時(shí)測(cè)定(圖3)。
上述CRP分析方法的特點(diǎn)見表1。總體而言, ITM法檢測(cè)范圍寬, 囊括多種病癥, 對(duì)應(yīng)CRP臨床檢測(cè)范圍, 適用于臨床患者血樣的快速定性檢測(cè)。ELISA法靈敏性好且易判讀, 配合使用酶標(biāo)儀, 可用于臨床實(shí)驗(yàn)室中CRP的精密測(cè)定。LFA法制備成本低, 但檢測(cè)范圍窄, 可用于CRP的定性分析。質(zhì)譜法檢測(cè)精密度高, 可實(shí)現(xiàn)多重檢測(cè)模式, 但檢測(cè)設(shè)備對(duì)人員素質(zhì)要求高, 不易普及。
基于生物傳感器與微流控技術(shù)的CRP免疫檢測(cè)方法形式多變, 且操作簡(jiǎn)單, 能兼顧臨床對(duì)CRP快速檢測(cè)需要與高靈敏檢測(cè)需求。其中, 生物傳感器檢測(cè)靈敏度最高, 檢出限可低至5 fg/L[35], 較適合用于超敏CRP(Hypersensitive C-reactive protein, hs-CRP)的臨床分析方法的研發(fā)。 微流控技術(shù)能自動(dòng)化實(shí)現(xiàn)全分析檢測(cè)過程, 通過簡(jiǎn)單設(shè)備即可精密讀取檢測(cè)結(jié)果, 適用于CRP現(xiàn)場(chǎng)快速檢測(cè)平臺(tái)的開發(fā)。
4?CRP分析方法發(fā)展趨勢(shì)
4.1?提高檢測(cè)靈敏度
血漿中僅含有微量CRP, 且血漿中蛋白組成復(fù)雜, 除CRP外的無關(guān)蛋白(如白蛋白、γ球蛋白等)有可能黏附在檢測(cè)基底表面, 影響檢測(cè)基線穩(wěn)定度。受此影響, 如果CRP分析方法檢出限過高, 易造成結(jié)果失真, 甚至出現(xiàn)假陽性的現(xiàn)象, 影響臨床判斷的正確性。因此, 需提高CRP檢測(cè)靈敏度, 確保CRP含量的準(zhǔn)確分析。
在降低無關(guān)蛋白的非特異性吸附方面, Hwang等[55]將一種單晶金納米片作為SERS檢測(cè)基底, 利用其原子構(gòu)成的平坦表面減少無關(guān)蛋白的非特異性吸附, 使檢測(cè)靈敏度提高至10?17 mol/L(圖4A)。
抗體作為識(shí)別分子, 其大分子位阻效應(yīng)和不穩(wěn)定的理化性質(zhì)常影響檢測(cè)靈敏度。核酸適配體作為一種新型識(shí)別分子, 是很好的替代選擇。Wang等[56]以巰基化核酸適配體代替抗體作為識(shí)別分子, 降低了識(shí)別分子的空間位阻效應(yīng), 增強(qiáng)了理化穩(wěn)定性, 檢出限降低至1.7 pg/mL(圖4B)。本研究組[57]也利用核酸適配體作為識(shí)別分子, 建立了一種新穎的納米酶夾心式ELISA法, 檢出限可低至8 pg/mL。 O′Reilly等[39]采用小分子抗體作為識(shí)別分子, 減少了空間位阻與非特異性吸附, 檢出限為0.3 pg/mL。
此外, 增加檢測(cè)信號(hào)響應(yīng), 也可提高檢測(cè)靈敏度。如Kuo等[58]在電極邊緣添加鋸齒狀結(jié)構(gòu), 以提高電解質(zhì)電流強(qiáng)度, 檢測(cè)靈敏度比傳統(tǒng)電極提高了85.81%(圖4C)。Wang等[59]利用銀介質(zhì)對(duì)拉曼信號(hào)的增強(qiáng)作用, 在檢測(cè)基底表面鍍上一層銀, 放大檢測(cè)信號(hào), 使CRP檢出限低至0.01 pg/mL(圖4D)。
4.2?擴(kuò)寬檢測(cè)范圍
不同病癥對(duì)應(yīng)CRP檢測(cè)范圍不同, 實(shí)際臨床檢測(cè)要求CRP分析法具有較寬的線性檢測(cè)范圍。LFA法和一些微流控技術(shù)檢測(cè)范圍較窄, 只能實(shí)現(xiàn)CRP的定性或半定量檢測(cè), 無法滿足實(shí)際臨床檢測(cè)需要。為拓寬檢測(cè)范圍, 研究者進(jìn)行了多種改進(jìn)方法的研究。
采用檢測(cè)信號(hào)更強(qiáng)的示蹤材料, 可以拓寬檢測(cè)范圍。Hu等[27]制備了一種包含多個(gè)量子點(diǎn)的熒光納米球, 將其作為LFA的新示蹤材料, 利用其超強(qiáng)熒光信號(hào)使檢測(cè)范圍擴(kuò)寬到0.178~11.4 nmol/L。
抗體比例不合適而導(dǎo)致假陰性的鉤狀效應(yīng), 被認(rèn)為是導(dǎo)致免疫分析檢測(cè)范圍窄的重要原因。針對(duì)鉤狀效應(yīng)對(duì)檢測(cè)范圍的限制, Oh等[31]在改進(jìn)LFA檢測(cè)方法時(shí), 改變樣品墊在試紙條上位置, 控制CRP與捕獲抗體和金標(biāo)抗體間的結(jié)合順序, 減少非特異性結(jié)合產(chǎn)生的鉤狀效應(yīng), 將檢測(cè)范圍拓寬至0.119~100 μg/mL(圖5A)。Rey等[32]直接更換結(jié)果判讀指標(biāo), 以檢測(cè)線與質(zhì)控線檢測(cè)信號(hào)比值變化曲線為濃度判斷標(biāo)準(zhǔn), 成功去除了鉤狀效應(yīng)(圖5B)。
在一些分析方法中, 檢測(cè)基底無法固定識(shí)別分子或識(shí)別分子負(fù)載量過低, 導(dǎo)致檢測(cè)范圍窄。Lee等[60]利用具有高比表面積和豐富的活性官能團(tuán)的氧化鈦納米纖維墊作為檢測(cè)基底, 提高了識(shí)別抗體的負(fù)載量, CRP動(dòng)態(tài)檢測(cè)范圍跨越6個(gè)數(shù)量級(jí)。
4.3?即時(shí)檢測(cè)
即時(shí)檢測(cè)(Point of care testing, POCT)是指能在病床旁現(xiàn)場(chǎng)取樣, 并通過便攜式儀器與配套試劑進(jìn)行快速分析的方法統(tǒng)稱。因不需要復(fù)雜樣品處理程序和大型儀器, POCT能大大節(jié)約檢測(cè)時(shí)間與成本[61]。作為重要的臨床生物標(biāo)志物, CRP的POCT方法開發(fā)是臨床醫(yī)學(xué)和免疫分析領(lǐng)域極具前景的一個(gè)發(fā)展方向。
便攜式檢測(cè)儀器的研發(fā), 可降低檢測(cè)成本, 簡(jiǎn)化操作步驟, 滿足基層醫(yī)療點(diǎn)CRP即時(shí)檢測(cè)需要。Vashist等[62]用手機(jī)讀取CRP ELISA比色結(jié)果, 底部白光投射使檢測(cè)液顏色分布更均勻, 智能手機(jī)攝像頭捕捉圖像后, 用手機(jī)自帶的色彩處理軟件定量描述圖像顏色, 實(shí)現(xiàn)比色信號(hào)的讀取(圖6A)。Dong等[63]同樣利用手機(jī)作為檢測(cè)儀器, 用其捕捉和分析納米金聚集產(chǎn)生的顏色信號(hào), 實(shí)現(xiàn)CRP即時(shí)分析。Ji等[64]通過筆式壓力計(jì)檢測(cè)CRP, 以鉑納米粒子作為示蹤材料, 壓力計(jì)讀取鉑納米粒子催化過氧化氫產(chǎn)生的氧氣壓強(qiáng), 實(shí)現(xiàn)CRP檢測(cè)(圖6B)。Lin等[65]用可直接讀數(shù)的家用血糖儀實(shí)現(xiàn)CRP檢測(cè):CRP與功能化脂質(zhì)體結(jié)合, 釋放包埋其中的淀粉糖苷酶, 使其與Triton X-100直鏈淀粉反應(yīng)產(chǎn)生葡萄糖, 血糖儀分析產(chǎn)生的葡糖糖濃度, 間接計(jì)算出CRP含量。
減少繁瑣的樣品預(yù)處理工序與多次洗滌添加過程, 也是POCT的重要研發(fā)策略。Joung等[66]利用不對(duì)稱聚砜膜對(duì)流體的延遲釋放作用, 研制出可自動(dòng)化添加二次層析液的LFA檢測(cè)方案, 可大大精簡(jiǎn)操作步驟, 滿足POCT檢測(cè)需求。在此基礎(chǔ)上, 該研究組利用水膨脹聚合物的吸水膨脹原理開發(fā)新型POCT-LFA檢測(cè)方案[67], 可更精準(zhǔn)控制兩次層析液添加間隔時(shí)間, 減少檢測(cè)方案批間差異性(圖6C)。Tsai等[68]在研發(fā)芯片上增加細(xì)胞過濾膜與過濾柱, 可快速去除血細(xì)胞和大分子量的無關(guān)蛋白, 使該微控流芯片可以不需復(fù)雜的樣品預(yù)處理過程, 即可進(jìn)行全血檢測(cè)(圖6D)。
4.4?多重檢測(cè)
目前, 單一指標(biāo)已經(jīng)無法完全滿足臨床精準(zhǔn)診斷需求, CRP常與其它生物標(biāo)志物聯(lián)用, 增加臨床診斷準(zhǔn)確度。因此, 實(shí)現(xiàn)樣品的多指標(biāo)同時(shí)檢測(cè)也是CRP分析的發(fā)展方向。
Qi等[69]在降鈣素原和CRP抗體上標(biāo)記不同量子點(diǎn), 并設(shè)置兩條不同的檢測(cè)線, 開發(fā)了可同時(shí)檢測(cè)降鈣素原和CRP的LFA(圖7A)。Lv等[70]在血清淀粉樣蛋白A抗體上標(biāo)記紅色量子點(diǎn)、CRP抗體上標(biāo)記綠色量子點(diǎn), 實(shí)現(xiàn)雙蛋白的同時(shí)檢測(cè)(圖7B)。Sinha等[49]研制出一種場(chǎng)效應(yīng)晶體管微流控芯片, 該芯片有多個(gè)檢測(cè)腔室, 能同時(shí)測(cè)定包括CRP在內(nèi)的4種生物標(biāo)志物, 用于臨床心血管疾病發(fā)病風(fēng)險(xiǎn)的預(yù)測(cè)分析。Park等[71]研發(fā)的垂直流動(dòng)檢測(cè)技術(shù), 能控制液體流動(dòng)順序, 避免測(cè)試液間互相干擾, 實(shí)現(xiàn)多種生物標(biāo)志物檢測(cè)。
5?總結(jié)與展望
CRP作為炎癥與感染指標(biāo), 可用于多種疾病診斷治療, 具有重要的臨床應(yīng)用價(jià)值。隨著材料科學(xué)的進(jìn)步和檢測(cè)儀器的多樣化, 新的CRP分析方法不斷涌現(xiàn), 大大提高了檢測(cè)靈敏度,大拓寬了檢測(cè)范圍, 滿足了POCT與多重檢測(cè)等臨床需求。未來的CRP分析方法研究將重點(diǎn)關(guān)注以下3個(gè)方面:(1)現(xiàn)今CRP檢測(cè)方法都是以點(diǎn)時(shí)間取樣為主, 不適合術(shù)后監(jiān)護(hù)等需要長期監(jiān)測(cè)CRP含量的臨床工作。因此, 開發(fā)一種可在體內(nèi)實(shí)時(shí)連續(xù)監(jiān)測(cè)CRP的系統(tǒng)可能是未來CRP分析方法的研究熱點(diǎn); (2)生物樣品中的無關(guān)蛋白易與檢測(cè)基底或識(shí)別抗體產(chǎn)生非特異性吸附, 影響檢測(cè)結(jié)果準(zhǔn)確性。為去除非特異性吸附干擾, 檢測(cè)前需要進(jìn)行復(fù)雜的前處理工作, 不利于臨床CRP的快速檢測(cè)。因此, 建立一種能快速去除或削弱無關(guān)蛋白非特異性吸附的檢測(cè)技術(shù), 有助于同時(shí)滿足臨床快速檢測(cè)和精準(zhǔn)測(cè)定需求, 將是未來CRP檢測(cè)的研究重點(diǎn); (3)CRP檢測(cè)的重要價(jià)值決定了其必將在基層醫(yī)療點(diǎn)被廣泛使用。研制低價(jià)便攜的檢測(cè)儀器, 降低檢測(cè)成本, 也是解決CRP分析法無法在資源稀缺地區(qū)普及的關(guān)鍵。臨床需求決定了CRP分析方法的未來研究方向, 也提示需要繼續(xù)深入改進(jìn)CRP分析方法, 尤其需要分析化學(xué)、臨床醫(yī)學(xué)、材料學(xué)、納米科學(xué)、物理學(xué)等不同學(xué)科之間相互交叉、融合、滲透, 建立以“問題解決”研究為中心的研究方法, 以更好地滿足CRP臨床檢檢測(cè)需求。
References
1?Thompson D, Pepys M B, Wood S P. Structure, 1999, 7(2): 169-177
2?Ansar W, Ghosh S. Immunol. Res., 2013, 56(1): 131-142
3?Vashist S K, Venkatesh A G, Marion Schneider E, Beaudoin C, Luppa P B, Luong J H T. Biotechnol. Adv., 2016, 34(3): 272-290
4?Roy N, Ohtani K, Matsuda Y, Mori K, Hwang I, Suzuki Y, Inoue N, Wakamiya N. Biochim. Biophys. Acta, 2016, 1860(6): 1118-1128
5?Perrone S, Lotti F, Longini M, Rossetti A, Bindi I, Bazzini F, Belvisi E, Sarnacchiaro P, Scapellato C, Buonocore G. Arch. Dis. Child. Fetal. Neonatal Ed., 2018, 103(2): F163-F166
6?Pierrakos C, Vincent J L. Critical Care, 2010, 14(1): 1-18
7?Zoico E, Corzato F, Bambace C, Rossi A P, Micciolo R, Cinti S, Harris T B, Zamboni M. Arch. Gerontol. Geriatr., 2013, 57(3): 411-416
8?Bano G, Trevisan C, Carraro S, Solmi M, Luchini C, Stubbs B, Manzato E, Sergi G, Veronese N. Maturitas, 2017, 96: 10-15
9?Mc Causland F R, Claggett B, Burdmann E A, Eckardt K U, Kewalramani R, Levey A S, McMurray J J V, Parfrey P, Remuzzi G, Singh A K, Solomon S D, Toto R D, Pfeffer M A. Am. J. Kidney Dis., 2016,?68(6): 873-881
10?Kolkhir P, Altrichter S, Hawro T, Maurer M. Allergy,?2018, 73(4): 940-948
11?Misiak B, Stanczykiewicz B, Kotowicz K, Rybakowski J K, Samochowiec J, Frydecka D. Schizophr. Res., 2018, 192:16-29
12?Huang J, Baum Y, Alemozaffar M, Ogan K, Harris W, Kucuk O, Master V A. Mol. Aspects Med., 2015, 45: 28-36
13?Clark T W, Medina M J, Batham S, Curran M D, Parmar S, Nicholson K G. Eur. Respir. J., 2015, 45(1): 76-86
14?Higdon M M, Le T, O′Brien K L, Murdoch D R, Prosperi C, Baggett H C, Brooks W A, Feikin D R, Hammitt L L, Howie S R C, Kotloff K L, Levine O S, Scott J A G, Thea D M, Awori J O, Baillie V L, Cascio S, Chuananon S, DeLuca A N, Driscoll A J, Ebruke B E, Endtz H P, Kaewpan A, Kahn G, Karani A, Karron R A, Moore D P, Park D E, Rahman M Z, Salaudeen R, Seidenberg P, Somwe S W, Sylla M, Tapia M D, Zeger S L, Deloria Knoll M, Madhi S A. Clin. Infect. Dis., 2017, 64(suppl 3): 378-386
15?Adamina M, Steffen T, Tarantino I, Beutner U, Schmied B M, Warschkow R. Br. J. Surg., 2015, 102(6): 590-598
16?Shishido Y, Fujitani K, Yamamoto K, Hirao M, Tsujinaka T, Sekimoto M. Gastric Cancer,?2016, 19(1): 293-301
17?Reynolds I S, Boland M R, Reilly F, Deasy A, Majeed M H, Deasy J, Burke J P, McNamara D A. Colorectal Dis., 2017, 19(9): 812-818
18?Kassir R, Blanc P, Tibalbo L M B, Breton C, Lointier P. Surg. Endosc., 2015, 29(6): 1439-1444
19?Ridker P M. Circ. Res., 2016, 118(1): 145-156
20?Avan A, Sany S B T, Ghayour-Mobarhan M, Rahimi H R, Tajfard M, Ferns G. J. Cell. Physiol., 2018, 233(11): 8508-8525
21?Bielas H, Meister-Langraf R E, Schmid J P, Barth J, Znoj H, Schnyder U, Princip M, von Kanel R. Eur. J. Prev. Cardiol., 2018, 25(3): 298-305
22?Kunutsor S K, Seidu S, Blom A W, Khunti K, Laukkanen J A. Eur. J. Epidemiol., 2017, 32(8): 657-667
23?Kwon C H, Kang J G, Lee H J, Kim N H, Sung J W, Cheong E, Sung K C. Europace, 2017, 19(10): 1643-1649
24?Chandra P, Suman P, Airon H, Mukherjee M, Kumar P. World J. Methodol., 2014, 4(1): 1-5
25?Yang X, Shu W X, Wang Y Q, Gong Y, Gong C Y, Chen Q S, Tan X T, Peng G D, Fan X D, Rao Y J. Biosens. Bioelectron., 2019, 131: 60-66
26?Kim W J, Cho H Y, Jeong B, Byun S, Huh J, Kim Y J. Sensors, 2017, 18(1): 55-66
27?Hu J, Zhang Z L, Wen C Y, Tang M, Wu L L, Liu C, Zhu L, Pang D W. Anal. Chem., 2016, 88(12): 6577-6584
28?Wu R L, Zhou S, Chen T, Li J J, Shen H B, Chai Y J, Li L S. Anal. Chim. Acta, 2018, 1008: 1-7
29?Swanson C, D′Andrea A. Chem. Commun., 2013, 59(4): 641-648
30?Park K M, Chung D J, Choi M, Kang T, Jeong J. Nano Converg., 2019, 6(1): 35-40
31?Oh J, Joung H A, Han H S, Kim J K, Kim M G. Theranostics, 2018, 8(12): 3189-3197
32?Rey E G, O′Dell D, Mehta S, Erickson D. Anal. Chem., 2017, 89(9): 5095-5100
33?Letchumanan I, Arshad M K M, Balakrishnan S R, Gopinath S C B. Biosens. Bioelectron., 2019, 130: 40-47
34?Zhang X, Hu R, Zhang K, Bai R, Li D, Yang Y. Methods-UK, 2016, 8(32): 6202-6207
35?Vance S A, Sandros M G. Sci. Rep., 2014,?4: 5129
36?Yu R J, Ma W, Liu X Y, Jin H Y, Han H X, Wang H Y, Tian H, Long Y T. J. Nanobiotecg., 2016, 6(10): 1732-1739
37?Zhang L L, Tong S, Zhou J, Bao G. Theranostics, 2016, 6(9): 1353-1361
38?Reghuram S, Arivarasan A, Kalpana R, Jayavel R. J. Exp. Nanosci., 2015, 10(10): 787-802
39?O′Reilly E J, Conroy P J, Hearty S, Keyes T E, O′Kennedy R, Forster R J, Dennany L. RSC Adv., 2015, 5(83): 67874-67877
40?Koukouvinos G, Petrou P, Misiakos K, Drygiannakis D, Raptis I, Stefanitsis G, Martini S, Nikita D, Goustouridis D, Moser I, Jobst G, Kakabakos S. Biosens. Bioelectron., 2016, 84: 89-96
41?Zubiate P, Zamarreno C R, Sanchez P, Matias I R, Arregui F J. Biosens. Bioelectron., 2017, 93: 176-181
42?Iwasaki Y, Kimura T, Orisaka M, Kawasaki H, Goda T, Yusa S. Chem. Commun., 2014, 50(42): 5656-5658
43?Lee S H, Choi S, Kwon K, Bae N-H, Kwak B S, Cho W C, Lee S J, Junga H I. Sens. Actuators B, 2017, 246: 471-476
44?Fock J, Parmvi M, Stromberg M, Svedlindh P, Donolato M, Hansen M F. Biosens. Bioelectron., 2017, 88: 94-100
45?Yang Z, Liu Y, Lei C, Sun X C, Zhou Y. Microchim. Acta, 2015, 182(15-16): 2411-2417
46?Zhang Y, Rojas O J. Biomacromolecules, 2017, 18(2): 526-534
47?Ouyang M, Di Carlo D. Biosens. Bioelectron., 2019, 132: 162-170
48?Belushkin A, Yesilkoy F, Altug H. ACS Nano, 2018, 12(5): 4453-4461
49?Sinha A, Tai T Y, Li K H, Gopinathan P, Chung Y D, Sarangadharan I, Ma H P, Huang P C, Shiesh S C, Wang Y L, Lee G B. Biosens. Bioelectron., 2019, 129: 155-163
50?Chu C H, Sarangadharan I, Regmi A, Chen Y W, Hsu C P, Chang W H, Lee G Y, Chyi J I, Chen C C, Shiesh S C, Lee G B, Wang Y L. Sci. Rep., 2017, 7: 5256
51?Gao J, Meyer K, Borucki K, Ueland P M. Anal. Chem., 2018, 90(5): 3366-3373
52?Ko J A, Lim H B. Anal. Chim. Acta, 2016, 938: 1-6
53?Tugirimana P L, Drieghe S A, Alsaadi H, Delanghe J R. Clin. Chem. Lab. Med., 2014, 52(6): 861-867
54?Vashist S K, Czilwik G, van Oordt T, von Stetten F, Zengerle R, Marion Schneider E, Luong J H T. Anal. Biochem., 2014, 456: 32-37
55?Hwang A, Kim E, Moon J, Lee H, Lee M, Jeong J, Lim E K, Jung J, Kang T, Kim B. ACS Appl. Mater. Interfaces, 2019, 11(21): 18960-18967
56?Wang J C, Guo J J, Zhang J J, Zhang W J, Zhang Y Z. Biosens. Bioelectron., 2017, 95: 100-105
57?Xie J, Tang M Q, Chen J, Zhu Y H, Lei C B, He H W, Xu X H. Talanta, 2020,?217: 121-127
58?Kuo Y C, Lee C K, Lin C T. Biosens. Bioelectron., 2018, 103: 130-137
59?Wang S F, Luo J J, He Y, Chai Y Q, Yuan R, Yang X. ACS Appl. Mater. Interfaces, 2018, 10(39): 33707-33712
60?Lee W S, Sunkara V, Han J R, Park Y S, Cho Y K. Lab Chip, 2015, 15(2): 478-485
61?Wang T T, Lio C K, Huang H, Wang R Y, Zhou H, Luo P, Qing L S. Talanta, 2020, 206: 120211
62?Vashist S K, van Oordt T, Schneider E M, Zengerle R, von Stetten F, Luong J H T. Biosens. Bioelectron., 2015, 67: 248-255
63?Dong M L, Wu J D, Ma Z M, Peretz-Soroka H, Zhang M, Komenda P, Tangri N, Liu Y, Rigatto C, Lin F. Sensors, 2017, 17(4): 684
64?Ji T H, Liu D, Liu F, Li J X, Ruan Q Y, Song Y L, TIian T, Zhu Z, Zhou L J, Lin H, Yang C Y, Wang D. Chem. Commun., 2016, 52(54): 8452-8454
65?Lin B Q, Liu D, Yan J M, Qiao Z, Zhong Y X, Yan J W, Zhu Z, Ji T H, Yang C Y J. ACS Appl. Mater. Interfaces, 2016, 8(11): 6890-6897
66?Joung H A, Oh Y K, Kim M G. Biosens. Bioelectron., 2014, 53: 330-335
67?Kim K, Joung H A, Han G R, Kim M G. Biosens. Bioelectron., 2016, 85: 422-428
68?Tsai M Z, Hsiung C T, Chen Y, Huang C S, Hsu H Y, Hsieh P Y. Analyst, 2018, 143(2): 503-510
69?Qi X P, Huang Y Y, Lin Z S, Xu L, Yu H. Nanoscale Res. Lett., 2016, 11: 1-8
70?Lv Y B, Wang F F, Li N, Wu R L, Li J J, Shen H B, Li L S, Guo F. Sens. Actuators B, 2019, 301: 118-127
71?Park J, Park J K. Sens. Actuators B,?2017, 246: 1049-1055

