羅哌卡因經原癌基因信號通路抑制胃癌細胞增殖和遷移的機制
洪 勇,周民偉,徐化交
0 引 言
化療是胃癌最常用的治療方法,但5-氟尿嘧啶、順鉑、阿霉素等多數化療藥物療效不滿意,不良反應嚴重[1-2]。因此,迫切需要尋找新效藥物以提高胃癌的治療效果。研究發現,羅哌卡因具有影響人癌細胞侵襲的能力[3]。在直結腸癌細胞中,羅哌卡因通過抑制基質金屬蛋白酶-2(matrix metalloproteinase-2,MMP-2)和MMP-9的表達,在體外抑制細胞的侵襲和遷移[4]。此外,持續輸注羅哌卡因還可抑制小鼠骨肉瘤LM8細胞的肺轉移[5]。蛋白激酶C(protein kinase C,PKC)途徑在癌癥化療中的作用受到研究者的關注。PKC在腫瘤增殖和生存過程中發揮作用,它也被認為具有致癌活性[6]。原癌基因(proto-oncogene,c-MYC)是PKC通路的下游靶基因之一,參與細胞周期進展、細胞生長、分化、代謝和凋亡的基因的主要調控因子,也是一種有效的細胞致癌基因,在人類癌癥中經常發現其異常[7]。因此,在本研究探討羅哌卡因對胃癌MGC-803細胞增殖、遷移的影響,并探討其潛在機制。
1 材料與方法
1.1 主要試劑與儀器主要試劑:羅哌卡因(瑞典AstraZeneca AB公司,批號:6903065.77);順鉑(美國sigma公司,批號:P4394);人胃癌MGC-803細胞(中國科學院典型培養物保藏委員會細胞庫);RPMI-1640培養基和胎牛血清(美國HyClone公司);青鏈霉素溶液(美國Corning公司);細胞計數試劑盒8 (cell count kit 8,CCK-8)(美國Amresco公司,規格:96T);細胞蛋白抽提試劑盒(碧云天生物技術研究所);PKC、c-MYC、MMP-9、磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)、蛋白激酶B(protein kinase B,AKT)、哺乳動物雷帕霉素靶蛋白(mammalian Target of rapamycin,mTOR)和β-actin抗體(美國Santa Cruz公司);辣根過氧化物酶HRP標記親和純化山羊抗小鼠IgG二抗(武漢艾美捷科技有限公司)。主要儀器:Multiskall MK3酶標儀(美國Thermo scientific公司);CO2培養箱(美國Ther-mo Revco公司);倒置顯微鏡(日本Olympus公司);BD垂直電泳儀(美國BD公司);凝膠成像儀(美國UVP公司)。
1.2 方法
1.2.1 細胞培養和分組用含胎牛血清(10%)和50 U/mL青鏈霉素(50 U/mL青霉素和50 μg/mL鏈霉素)的RPMI-1640培養液在37 ℃、5%CO2條件下培養MGC-803細胞,選擇對數生長期細胞進行實驗。實驗分為對照組、羅哌卡因低劑量組、羅哌卡因中劑量組、羅哌卡因高劑量組和順鉑組。對照組無處理,羅哌卡因低、中、高劑量組分別給予終濃度為100、200、400 μg/mL的羅哌卡因[8],順鉑組給予終濃度為10 mmol/mL的順鉑[9],繼續培養24 h后進行相關檢測。
1.2.2 CCK-8法檢測細胞增殖率以5×103/孔接種于96孔板中(200 μL/孔),待細胞融合后,按1.2.1給予受試物干預20 h,繼續培養20 h,向培養板中加入10 μL CCK-8試劑,37 ℃繼續培養4 h,用酶標儀在630 nm處測定吸光度值,細胞增殖率計算公式如下:
細胞增殖率=(實驗組OD值-空白組OD值)/(對照組OD值-空白組OD值)
1.2.3 細胞劃痕法檢測MGC-803細胞遷移能力以5×104/孔接種于6孔板中(2 mL/孔),待細胞融合,用100 μL滅菌槍頭在單層細胞上呈“一”字劃痕,用無血清的RPMI-1640培養基清洗3次,按1.2.1給予受試物干預24 h后,用顯微鏡下拍照,用圖像分析儀測量測量劃痕寬度。
1.2.4 Western blot法檢測PKC、c-MYC、MMP-9、PI3K、AKT和mTOR表達以5×104/孔接種于6孔板內(3 mL/孔),待細胞融合加入按1.2.1分組分別處理MGC-803細胞24 h,收獲細胞,根據細胞量加入細胞蛋白抽提液,進行電泳(每孔上樣量為20 μg),將印跡轉移到聚偏氟乙烯膜上,然后用5%脫脂牛奶在室溫下封膜1 h,將膜與PKC(1∶200)、c-MYC(1∶100)、MMP-9(1∶400)、PI3K(1∶300)、AKT(1∶400)、mTOR(1∶200)和β-actin(1∶1000)抗體進行孵育,4 ℃過夜,用TBST緩沖液對膜進行2次沖洗,將二抗(1∶5000)在室溫下孵育30 min。進行顯色,采集圖像進行分析。
2 結 果
2.1 羅哌卡因對MGC-803細胞增殖和遷移能力的影響與對照組比較,各羅哌卡因劑量組和順鉑組MGC-803細胞增殖率和遷移能力降低,且各羅哌卡因劑量組降低強度呈劑量依賴性,但細胞增殖率和遷移能力仍高于順鉑組,差異有統計學意義(P<0.05)。見表1,圖1、圖2。

表1 羅哌卡因對MGC-803細胞增殖和遷移能力的影響

a:對照組;b-d:分別為羅哌卡因低劑量、中劑量、高劑量組;e:順鉑組圖示隨著羅哌卡因劑量的增加,細胞增殖率降低圖1 羅哌卡因對MGC-803細胞增殖影響的透射電鏡圖( ×3000)

a:對照組;b-d:分別為羅哌卡因低劑量、中劑量、高劑量組;e:順鉑組圖示隨著羅哌卡因劑量的增加,細胞遷移能力降低圖2 羅哌卡因對MGC-803細胞遷移能力影響的劃痕實驗結果( ×200)
2.2 羅哌卡因對MGC-803細胞中PKC、c-MYC、MMP-9、PI3K、AKT和mTOR表達的影響與對照組比較,各羅哌卡因劑量組和順鉑組MGC-803細胞中PKC、c-MYC、MMP-9、PI3K、AKT和mTOR表達均降低,且各羅哌卡因劑量組降低強度呈劑量依賴性,但各指標表達仍高于順鉑組,差異有統計學意義(P<0.05)。見表2,圖3。

表2 羅哌卡因對MGC-803細胞中PKC、c-MYC、MMP-9、PI3K、AKT和mTOR表達的影響
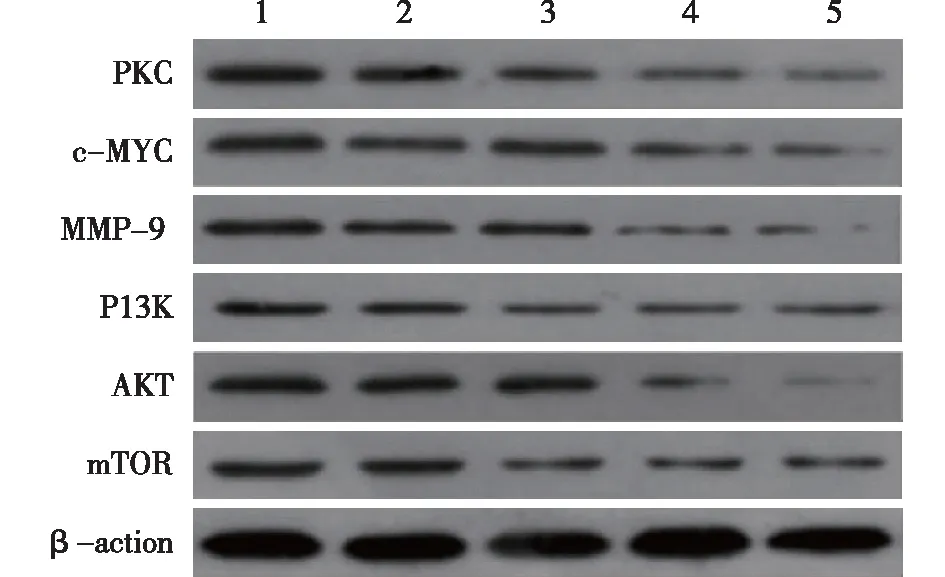
1:對照組;2-4分別為:羅哌卡因低劑量、中劑量、高劑量組;5:順鉑組圖3 羅哌卡因對MGC-803細胞中PKC、c-MYC、MMP-9、PI3K、AKT和mTOR表達影響的電泳圖
3 討 論
既往大量報道顯示,羅哌卡因對癌癥具有一定的治療作用,且其安全性令人滿意[10]。為了進一步了解羅哌卡因對胃癌的分子機制,本研究進行了一系列的體外實驗。通過CCK-8檢測結果可以看出,羅哌卡因對胃癌MGC-803細胞有生長抑制作用。
轉移是癌癥的標志之一,抑制轉移已成為治療癌癥的有吸引力的治療選擇。 在轉移中,細胞遷移是關鍵步驟。最近的報告顯示,羅哌卡因既可以起到抗腫瘤作用,又可以起到抗血管生成作用[11]。有研究顯示,羅哌卡因降低了人纖維肉瘤HT-1080細胞中MMP-9的水平[12]。本研究結果表明,羅哌卡因抑制人胃癌細胞的遷移,并與抑制MMP-9的表達有關,從而擴大了羅哌卡因的生物活性。在此,本研究證實了羅哌卡因通過c-MYC信號通路在體外抑制細胞的增殖和遷移。
羅哌卡因除了體外抑制細胞的增殖和遷移,本研究發現羅哌卡因降低了PKC水平。這些數據表明,PKC是羅哌卡因的抗腫瘤作用的主要關鍵目標。為了進一步驗證這一假設,本研究檢測了c-MYC水平的變化。原癌基因PKC的致癌途徑與下游c-MYC表達增加相關聯[13]。c-MYC是人類癌癥中最普遍的致癌基因之一,在約50%的腫瘤中被失調,尤其是在淋巴瘤中,并且還存在于子宮頸癌、結腸癌、乳腺癌、胃癌中[14]。盡管有一些研究報道c-MYC的陽性表達與不良預后顯著相關,如食管鱗狀細胞癌樣品中存在c-MYC過表達,并且c-MYC mRNA的水平是淋巴結轉移的危險因素,是食管鱗狀細胞癌患者生存的指標,但其潛在機制尚未得到很好的了解[15]。研究顯示,c-MYC是細胞生長的重要調控因子,并在多種細胞類型中響應生長促進因子而被激活[16]。癌基因表達的變化在細胞癌變和逆轉運動中起重要作用,相關基因的擴增和失活是人胃癌細胞的主要指標。因此,c-MYC基因表達的改變是細胞轉化和增殖的重要事件。PI3K/Akt/mTOR信號轉導通路由PI3K、Akt和mTOR三個蛋白酶組成。PI3K/Akt/mTOR信號轉導通路的激活可通過多種刺激抑制凋亡的觸發,促進腫瘤細胞的周期進展、存活和增殖[17]。此外,PI3K/Akt/mTOR信號通路還具有多種功能,包括參與血管生成、惡性腫瘤的發生、發展和耐藥,以及腫瘤的侵襲轉移[18]。研究顯示,羅哌卡因通過PI3K/Akt/mTOR誘導人臍血管內皮細胞自噬并抑制血管生成能力,而過表達c-MYC可顯著增加黑色素瘤B16F10細胞中mTOR蛋白的表達[19]。在本研究中,我們發現羅哌卡因的加入明顯抑制了c-MYC的表達,從而抑制PI3K/Akt/mTOR信號通路的激活。因此,c-MYC可能成為胃癌治療的新靶點。
綜上所述,本研究顯示羅哌卡因通過抑制c-MYC信號通路在體外抑制人胃癌MGC-803細胞增殖和遷移。這些結果突出了羅哌卡因作為抗增殖和抗遷移劑的重要性,并可能提供抗胃癌的治療潛力,但其作為臨床治療藥物還要大量的研究進行論證。

