尖晶石MFe2O4(M=Co、Cu、Mg)催化沼氣重整制氫研究
周 亮,姚金剛,易維明,劉 靜,蔡紅珍
(1.山東理工大學 農業工程與食品科學學院,山東 淄博 255049;2.山東省清潔能源工程技術研究中心,山東 淄博 255049)
氫是能量密度最高的載能體,是未來最有潛力替代化石燃料的可再生能源,作為高熱值燃料,其燃燒過程只生成水且不釋放其他污染物。因此,氫能的開發與利用日益受到世界各國的廣泛關注[1-2]。目前氫氣可通過熱化學分解、電解水、水煤氣轉化和甲烷熱裂解等[3-5]方法制備,但這些方法經濟效益都較差。
沼氣是一種清潔可再生的生物質能源[6]。沼氣中甲烷(CH4)的含量為40%~70%,二氧化碳(CO2)的含量為30%~60%。此外,沼氣中還含有少量的一氧化碳(CO)、硫化氫等溫室氣體,若是將沼氣直接排放到大氣中,不但會加劇溫室效應的進程,還會破壞生態平衡,且CH4在空氣中具有爆炸性,嚴重威脅了人身安全,若是能將沼氣加以有效利用,則能帶來環境與經濟的雙重效益[7]。
目前沼氣的利用方式有:直接燃燒、合成生產高附加值燃料、重整制氫等[8-10],沼氣干氣重整制氫實質是CH4-CO2重整或稱為甲烷干氣重整反應(式6),它可以將CH4和CO2轉化為合成氣(H2和CO混合氣)。與傳統的蒸汽重整相比,由于產物中H2/CO比值低,沼氣干氣重整更適合通過費托反應或羰基合成生產烴類、甲醇和其他液體燃料[11]。
催化劑可以有效促進反應物間的傳熱和傳質,降低反應溫度,促進水煤氣轉換反應、甲烷蒸汽重整反應,進而提高H2產量。目前,鎳基催化劑在重整制氫反應中得到了廣泛應用,并取得了良好的催化效果,但該類催化劑容易因積碳而失去活性[12-13];貴金屬催化劑對反應過程催化活性高而穩定,可抗積碳并能提高H2產量,但該類催化劑價格昂貴且在高溫條件下易燒結。所以,目前重整反應研究的關鍵在于開發出低成本、抗積碳、活性高、穩定性好的非貴金屬催化劑。
具有MFe2O4構型的尖晶石型鐵氧體化合物,具有良好的熱穩定性和化學穩定性,它易與過渡金屬發生相互作用,并可以提高活性組分的分散度和抗燒結性能[14]。尖晶石型氧化物上的氧缺位有利于表面積碳的消除,從而可提高催化劑的抗積碳性能[15]。尖晶石催化重整反應實例有很多,Dolgykh等[16]研究了CoFe2O4鐵氧體催化劑在乙醇重整反應中的催化性能,催化研究顯示:在700 ℃條件下最大產氫率達到64.1%。李光俊等[17]采用檸檬酸絡合法制備了CuFe2O4催化劑,并用于催化甲醇重整反應,結果表明CuFe2O4催化劑上CO選擇性最高且穩定較好;Shen等[12]采用共沉淀法制備了以MgAl2O4為載體負載鎳的催化劑,結果顯示Ni負載量為3.4%的尖晶石型MgAl2O4催化劑在平均粒徑為9.8 nm條件下,進行連續100 h的干氣重整反應,催化劑呈現出良好的穩定性,無燒結失活和積炭現象。目前,鮮有研究報道尖晶石催化沼氣干氣重整反應。因此本文通過凝膠-溶膠法制備CoFe2O4、CuFe2O4和MgFe2O43種尖晶石鐵氧體催化劑,在固定床上開展沼氣干氣催化重整制氫研究,考察溫度、VCH4和VCO2比值及GHSV等因素對H2和CO選擇性的影響。
1 實驗部分
1.1 催化劑的原料與制備
C6H8O7·3H2O、Co(NO3)2·6H2O、Cu(NO3)2·3H2O、Mg(NO3)2·6H2O、Fe(NO3)2·9H2O均為分析純,由天津奧普升化工有限公司提供。
采用溶膠-凝膠法制備,按照一定的化學計量比,將既定的金屬硝酸鹽溶于去離子水中,攪拌混合均勻。向該混合溶液中加入一定量的檸檬酸,在80 ℃水浴中溶解得到透明的溶液,并在80 ℃、攪拌下緩慢蒸發得到透明的溶膠,繼續蒸發至粘稠膠狀物,然后在105 ℃的烘箱內干燥12 h后,900 ℃下焙燒4 h。
1.2 催化劑的表征
催化劑的物相表征(XRD)采用德國Bruker D8 ADVANCE型X-射線衍射儀,功率為35 kV×30 mA,Cu Kα射線,λ=0.154 18 nm,大角掃描范圍2θ=20°~80°。
催化劑比表面積和孔體積的測定在WJGS-029全自動比表面積及孔隙分析儀(Micromeritics,USA)上完成,采用液氮溫度(-196 ℃)下的N2吸附法測得BET比表面和孔徑分布,測試前將樣品在200 ℃下脫附3 h,以去除樣品中的水氣等雜質。用BET公式和BJH方程分別計算催化劑的比表面積和孔體積。
催化劑的表面形貌結構用日立SU8020場發射掃描電子顯微鏡(SEM)進行觀察,在15 kV加速電壓、16 mm工作距離的條件下觀察拍攝樣品的微觀形貌照片。
催化劑的程序升溫還原(H2-TPR)在AutoChem II 2920化學吸附儀(Micromeritics,USA)上測定,催化劑預先在氬氣氣氛中于500 ℃處理1 h,冷卻至室溫切換為10%H2/Ar,吹掃至基線穩定后,以10 ℃/min升溫至900 ℃。
1.3 實驗裝置與步驟
實驗反應器為自制的固定床反應器,實驗在固定床反應器上(φ25 mm×760 mm)進行,裝置示意圖如圖1所示。固定床通過三段式熱電偶進行加熱,在固定床的中部設計了一段凹槽來放置定量的(1 g)催化劑。催化前催化劑在400 ℃、100 mL/min的N2流中穩定0.5 h,實驗產生的氣體產物用5 L氣袋收集后進行氣相色譜檢測。測試結束后,催化劑在50 mL/min的N2流中冷卻至室溫,以備分析。
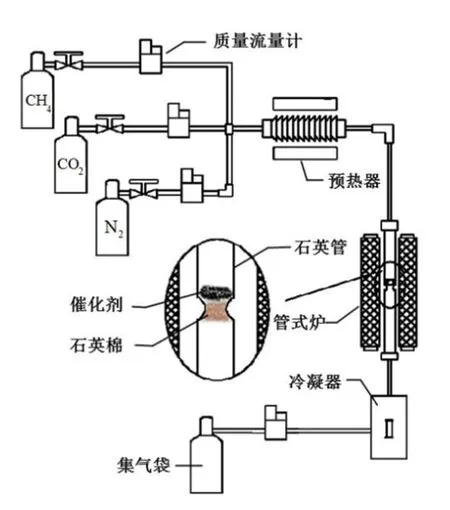
圖1 沼氣催化重整反應裝置圖Fig.1 Experimental scheme of methane reforming
1.4 數據分析
實驗收集的氣體采用Agilient 490 微型氣相色譜儀(Molsieve 5?色譜柱和Hayesep A色譜柱,柱溫100 ℃,載氣為Ar)進行分析。相關計算公式如下[18-19]:
(1)
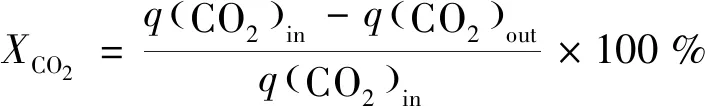
(2)
(3)
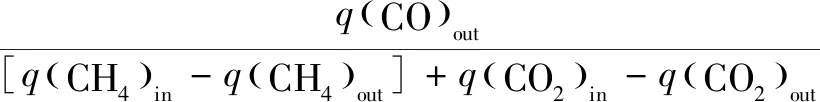
(4)
式中:X為轉換率;S為選擇性;q為氣體體積流量,mL/min。
2 結果與討論
2.1 催化劑表征
2.1.1 XRD分析
催化劑催化前后的XRD表征結果見圖2。圖2中,b、d和f分別為催化后的3種尖晶石催化劑R-CoFe2O4、R-CuFe2O4和R-MgFe2O4,由圖2可知,催化劑均具有明顯的尖晶石晶體結構。在CoFe2O4(JCPDS 03-0864)、MgFe2O4(JCPDS 73-2410)晶體中,Co2+、Mg2+存在于尖晶石面心立方體結構的八面體位置中,Fe3+存在于八面體位置中[20],為典型正尖晶石的Fd-3m晶群。在各催化劑中,都出現了Fe3O4(JCPDS 89-0691)立方體晶系Fd-3m型晶群的(220)、(222)、(331)、(511)和(440)晶面衍射峰。尖晶石中Fe3+-Fe2+離子之間的游離交換,可使催化劑產生大量氧晶格缺陷,晶格中的O2-離子逸出后,破壞了尖晶石結構的電中性平衡,因此,大量的陽離子會向內聚集,導致晶格間隙膨脹和晶格畸變,從而提高了MFe2O4催化劑的還原能力[21]。

a:CoFe2O4;b:R-CoFe2O4;c:CuFe2O4;d:R-CuFe2O4;e:MgFe2O4;f:R-MgFe2O4:MFe2O4;:Fe3O4;:Cu;:CuO圖2 催化劑催化前后的XRD譜圖Fig.2 XRD profiles of catalysts before and after reaction
在CuFe2O4(JCPDS 72-1174)的XRD衍射峰中,出現了CuO(JCPDS 89-5899)單斜晶系Cc型晶群(111)晶面的特征峰。據Cheng等[22]研究發現,表面分散的CuO可以在一定程度上提高催化劑的催化活性,且α-Fe2O3與CuO基團的協同作用可以進一步分散CuO,從而提高CuFe2O4催化劑的催化活性[23]。但是在催化后CuFe2O4的XRD衍射峰中,CuO的特征峰消失,出現了Cu(JCPDS 70-3039),這可能是發生了碳還原氧化銅的反應,即
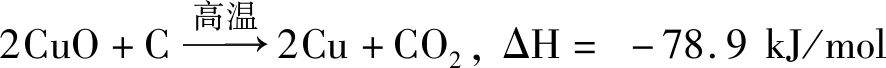
(5)
2.1.2 BET分析
表1列出了MFe2O4(M=Co、Cu、Mg)尖晶石型催化劑的比表面積、孔體積和孔徑。可以看出3種催化劑的孔徑均在2~50 nm之間,均屬于介孔催化劑。較大的比表面積和孔體積有利于催化劑的活性組分在載體表面的自發分散,從而提高催化劑的活性[24]。
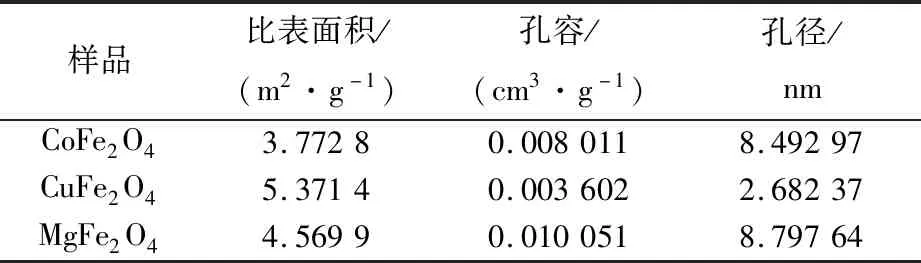
表1 催化劑的物理化學性質Tab.1 Physico-chemical performance of catalysts
2.1.3 SEM分析
圖3為3種催化劑催化前后的SEM照片,可以明顯看出催化前后的3種催化劑都呈不規則的幾何多面體結構,顆粒間彼此相連,根據謝樂公式計算得到晶粒尺寸大多位于30~80 nm范圍。
圖3(d,e和f)分別為催化后的3種尖晶石催化劑R-CoFe2O4、R-CuFe2O4和R-MgFe2O4,可以看出R-CoFe2O4和R-MgFe2O4的立體結構相比催化前要模糊。這主要是因為粒子本身粒徑太小,粒子間的距離很短,其范德華力遠大于粒子本身的重力,從而引起粒子間的團聚[25]。
2.1.4 H2-TPR分析
圖4為MFe2O4催化劑的H2-TPR圖譜,可以看出CuFe2O4和MgFe2O4都出現了兩個還原峰,而CoFe2O4只出現了一個還原峰,根據Chagas[26]的研究,這是因為位于405 ℃和460 ℃的兩個還原峰進行了重疊。第一個還原峰位于405 ℃,與Co2+→ Co0、Fe3+→ Fe2++Fe3+有關,隨后是催化劑在460 ℃出現的Fe2++Fe3+→Fe2++Fe0還原峰。
MFe2O4催化劑中,M位元素的H2還原峰面積和位置與催化活性關系較大[27]。270 ℃和425 ℃時,在CuFe2O4的H2-TPR曲線出現了高度分散的Cu2+→Cu1+和結晶中的Cu2+→Cu1+的還原峰。Cu的還原峰溫度明顯低于其他M位元素,Meshkani等[23]認為,尖晶石結構的出現,改變了催化劑中Cu與Fe所占的亞晶格位置,進而影響催化劑的H2還原峰面積和還原溫度。
2.2 催化劑的篩選
本節考察了3種催化劑的催化活性,并以不加催化劑作為空白樣進行了對比實驗。基于所選催化劑對沼氣干氣重整制氫過程CH4、CO2轉化率以及H2、CO選擇性的影響,篩選出最優催化劑,并進行后續的進一步研究。
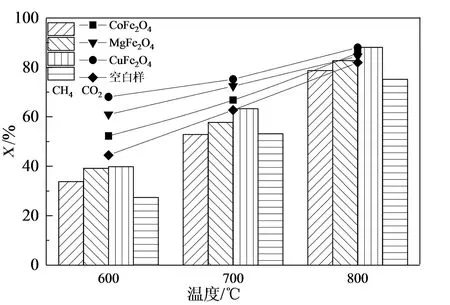
各催化劑在GHSV=6 000 h-1、VCH4/VCO2=1的反應條件下對沼氣重整反應過程CO2、CH4轉化率以及H2、CO選擇性的影響如圖5所示。由圖5可知,CO2和CH4轉化率以及H2和CO選擇性都隨溫度的升高呈增加趨勢,這是因為高溫有利于反應物分子的活化,增強了催化劑中的活性組分與載體之間的相互作用[28]。
相比于其他兩種催化劑,CuFe2O4催化劑具有更高的催化活性。這是因為在CuFe2O4中形成的Fe3O4最終還原成Fe,Fe作為促進CH4裂解催化劑,在高溫下容易與積碳形成Fe3C,而Fe3C也是促進CH4裂解的催化劑[29];此外,從CuFe2O4析出的Cu對Fe表面的積碳形成有抑制作用[23]。因此,選擇CuFe2O4為催化沼氣重整反應中的最優催化劑。
(a)轉化率
2.3 沼氣干氣催化重整研究
2.3.1 溫度的影響
如圖6所示,以CuFe2O4為催化劑,在保持其他實驗條件不變的條件下,考察了溫度對沼氣干氣催化重整反應各產物組分轉化率以及選擇性的影響。從圖6可以看出,產物由H2、CH4、CO以及CO2組成;當溫度從600 ℃升到800 ℃時,H2和CO選擇性顯著提高,分別從65.95%和70.33%增加到87.60%和89.79%;CH4和CO2的轉化率也隨溫度的升高而升高,分別由原來的39.81%和67.78%增加到88.13%和87.77%。上述結果表明:高溫有利于沼氣干氣催化重整反應的進行,這是因為干氣重整是一種強吸熱反應(式6),高溫有利于反應物分子的活化,增強了催化劑中的活性組分與載體之間的相互作用;高溫不僅有利于CH4和CO2的轉化,還有利于提高H2和CO選擇性。

圖6 溫度對沼氣干氣催化重整反應產物的影響(VCH4∶VCO2=1∶1,GHSV=6 000 h-1)Fig.6 Effect of reforming temperature on the yields of gaseous products over CuFe2O4(VCH4∶VCO2=1∶1,GHSV=6 000 h-1)
CH4+CO2→2H2+2CO,ΔH= 247.3 kJ/mol
(6)
2.3.2VCH4和VCO2比值的影響
從圖7可以看出,在VCH4和VCO2比值從3∶1降低到1∶1區間內,CH4和CO2轉換率下降,H2和CO選擇性上升,這是因為比值的適當減小有利于反應平衡向有利于氫氣生成的方向移動[30];當VCH4和VCO2比值小于1∶1時,CH4和CO2轉換率上升,H2和CO選擇性下降,且CO選擇性始終高于H2選擇性,原因是在該既定溫度下,比值的減少會促進逆水煤氣變換反應(式7)的進行,使得H2和CO選擇性下降[31]。
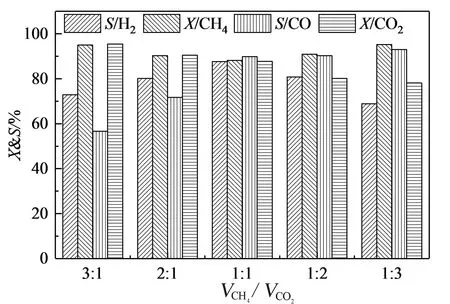
圖7 VCH4和VCO2比值對沼氣干氣催化重整反應產物的影響(t=800 ℃,GHSV=6 000 h-1)Fig.7 Effect of VCH4 and VCO2 ratio on the yields of gaseous products over CuFe2O4(t=800 ℃,GHSV=6 000 h-1)
CO2+H2→CO+H2O,ΔH= 41 kJ/mol
(7)
2.3.3 GHSV的影響
如圖8所示,空速從6 000 h-1增加到13 800 h-1的區間內,H2和CO選擇性以及CH4和CO2轉化率降低。這是由于隨著空速的增加,原料氣與催化劑的接觸時間減少,影響了反應物的轉化率;在高空速下,原料氣將快速通過催化劑床層,原料氣可能還沒有被預熱到反應溫度就發生了重整反應[32];H2和CO選擇性都隨著空速的增加而減小,這是因為沼氣重整反應較慢,而CH4裂解(式8)和逆水煤氣變換反應(式7)較快,空速增大、停留時間減小對沼氣干氣催化重整反應影響較大,而對兩種副反應影響較小[33]。
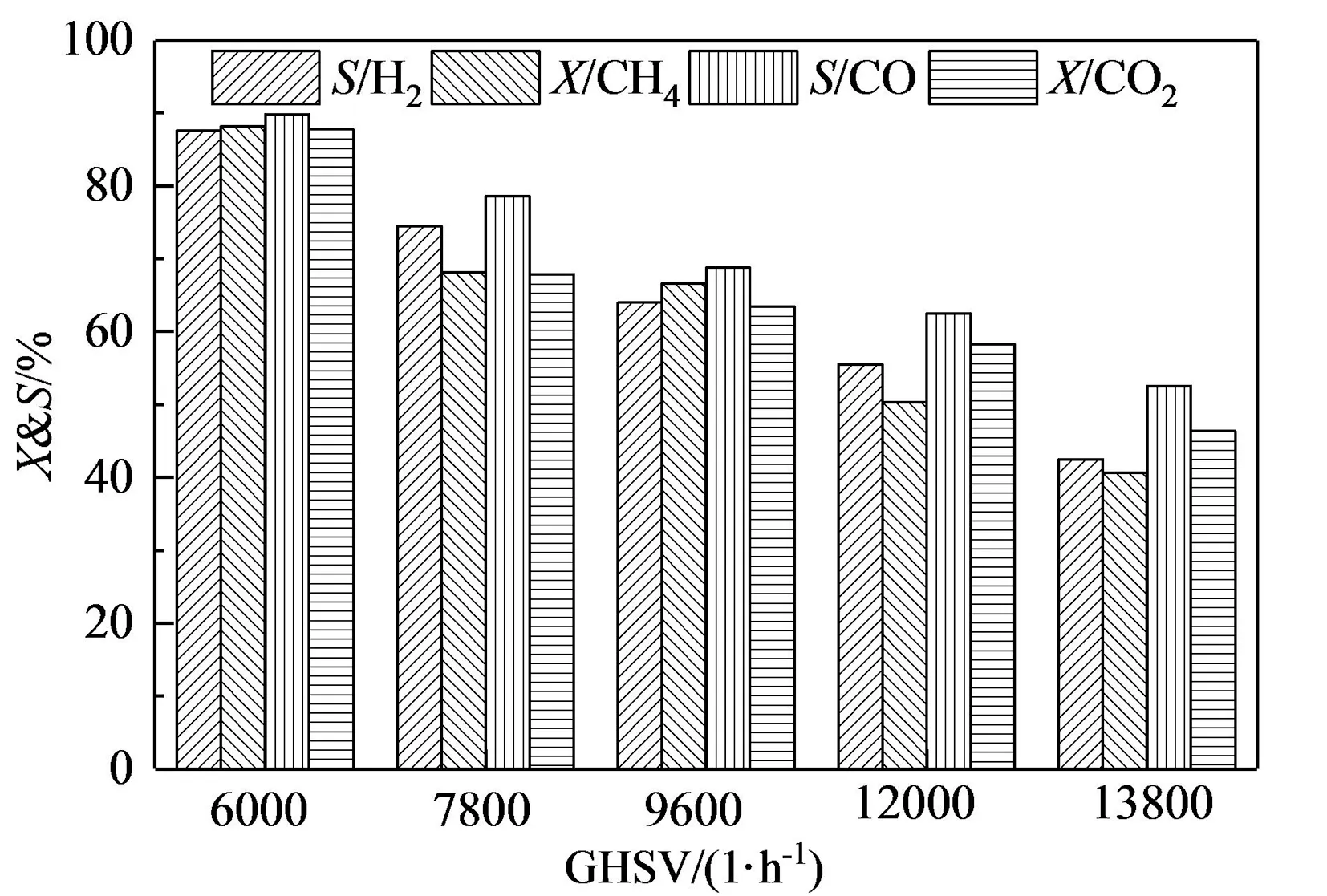
圖8 GHSV對沼氣干氣催化重整反應產物的影響(t=800 ℃,VCH4∶VCO2=1∶1)Fig.8 Effect of GHSV on the yields of gaseous products over CuFe2O4(t=800 ℃,VCH4∶VCO2=1∶1)
CH4→C+2H2,ΔH= 75 kJ/mol
(8)
3 結論
1)采用溶膠-凝膠法自制的MFe2O4(M=Co、Cu、Mg)均形成了典型的尖晶石晶體結構。
2) Cu和載體之間的相互作用有利于消除催化劑積碳,提高H2選擇性和催化劑的穩定性。
3)當VCH4∶VCO2=1∶1、GHSV=6 000 h-1、在800 ℃時,尖晶石CuFe2O4表現出最優的性能,獲得氫氣和一氧化碳選擇性分別為87.60%和89.79%。
4)溫度、VCH4和VCO2比值、GHSV是影響反應結果的重要因素。

