miR-486-3p與甲狀腺乳頭狀癌關系的生物信息學研究
趙曉海 王成志 孔建兵 鮑躍兵 邱永偉 賴瑞南
甲狀腺乳頭狀癌(papillary thyroid carcinoma,PTC)是甲狀腺癌中最常見的病理類型,占甲狀腺癌的80%以上,多見于年輕女性,患者常出現淋巴轉移以及局部侵襲、復發[1-2]。腫瘤直徑超過1 cm的PTC患者大多伴有中央區淋巴結轉移,目前臨床診斷困難,因此,治療效果往往不及預期[3]。miR-486-3p作為一種常見的抑癌miRNA,在甲狀腺癌中表達下調[4]。研究發現PTC細胞中miR-486-3p表達下調,能夠促進NF-κB信號通路的活性,加速PTC細胞的侵襲,促進PTC疾病進展[5]。此外,miR-486-3p表達下調與乳腺癌前哨淋巴結的轉移有關,能夠作為乳腺癌淋巴轉移診斷的分子標志物[6]。然而,目前鮮有關于miR-486-3p與PTC淋巴轉移相關的分子機制的研究。基于此,本研究對PTC樣本中miR-486-3p的差異基因進行生物信息學分析,并探討其靶基因差異表達情況及臨床意義,以期為其在PTC中的深入研究提供理論支持。
1 材料和方法
1.1 數據來源和整理 檢索腫瘤基因圖譜(The Cancer Genome Atlas,TCGA)數據庫(https://portal.gdc.cancer.gov/),下載PTC相關的mRNA表達數據,其中腫瘤樣本502例、癌旁正常組織樣本4例。
1.2 差異表達分析 使用limma R包對腫瘤標本與癌旁組織表達譜進行差異分析,選擇log2FC絕對值>1,P<0.05為篩選條件。將數據進行可視化并導出相應圖表。
1.3 差異基因功能及信號通路富集分析 使用ClusterProfiler R包對差異表達基因富集,隨后進行基因本體(gene ontology,GO)分析和京都基因和基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)注釋,繪制GO聚類圖。使用ggplot2 R包繪制GO二級分類柱形圖及KEGG注釋統計圖。
1.4 靶基因預測并與差異表達基因取交集 采用Targetscan(http://www.targetscan.org/vert_72/)與 miRDB(http://mirdb.org/)在線數據庫預測與miR-486-3p存在結合序列的靶基因,將得到的miR-486-3p差異表達基因與兩個數據庫中預測到的靶基因取交集,繪制韋恩(Venn)圖。
1.5 生存分析 保留TCGA數據集中包含生存資料的病例,根據中位數將患者分為基因高、低表達組。通過Survival R包對樣本進行生存分析,繪制Kaplan-Meier生存曲線,并計算HR值。
2 結果
2.1 miR-486-3p差異表達基因分析 對502例腫瘤樣本與4例配對樣本進行差異分析,根據limma R包的分析結果,差異基因表達火山圖見圖1(插頁),差異基因聚類分析熱圖見圖2(插頁)。結果顯示,74個基因上調,25個基因下調,上調、下調差異最顯著的各20個基因及相關信息見表1。
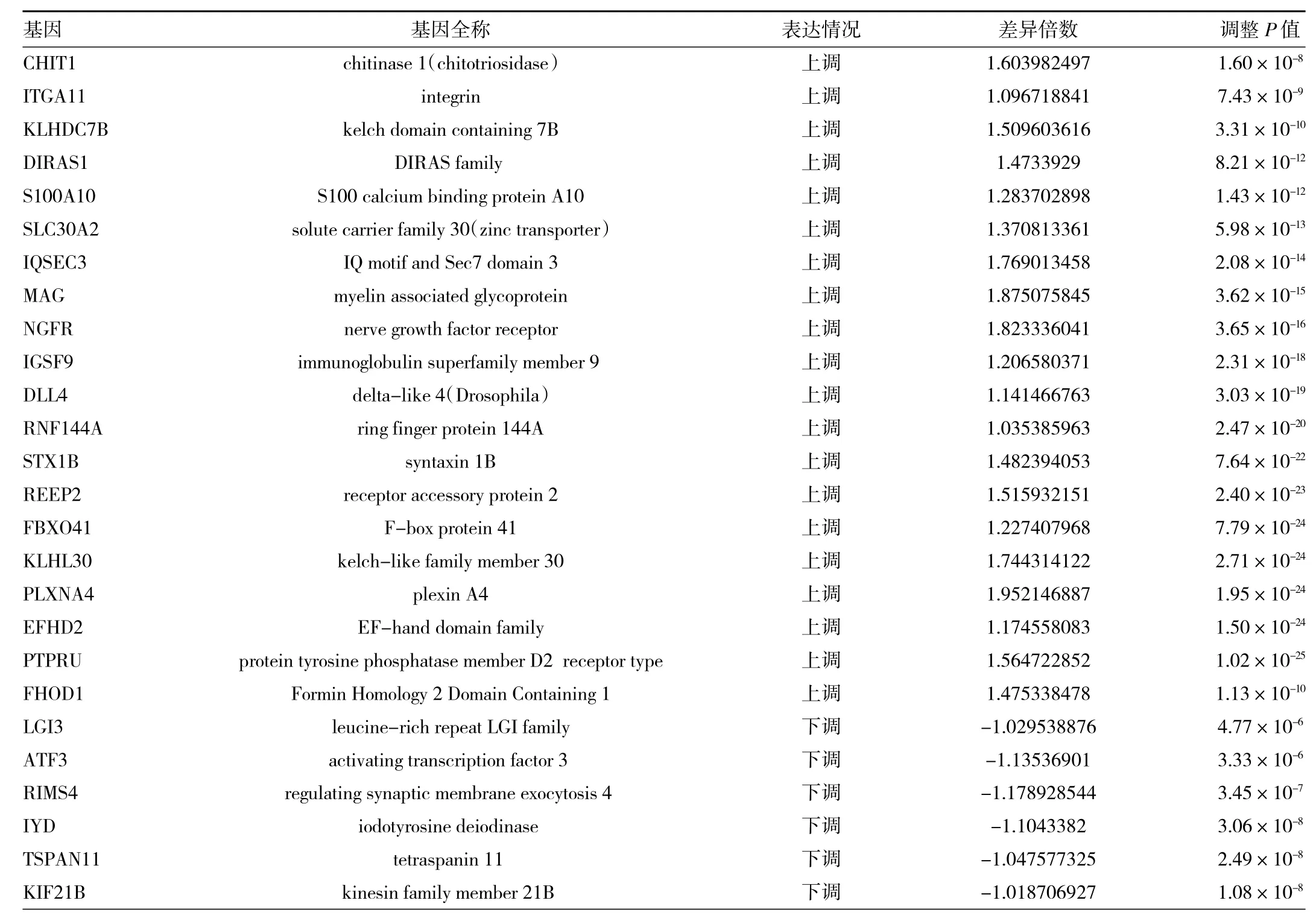
表1 篩選出的miR-486-3p差異表達基因

續表
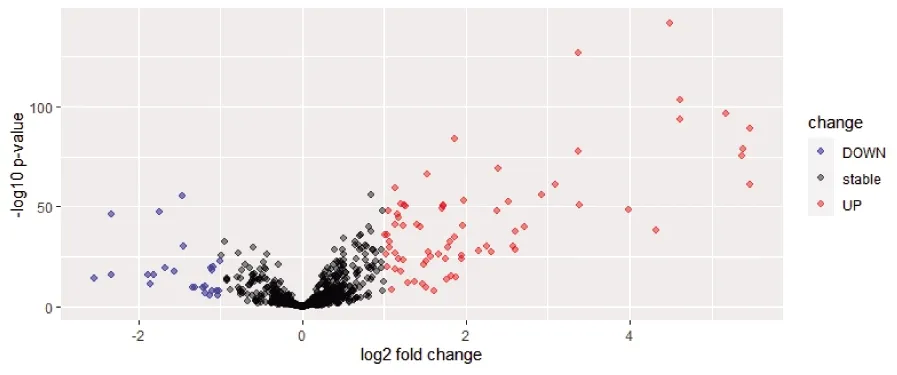
圖1 miR-486-3p差異表達基因的火山圖
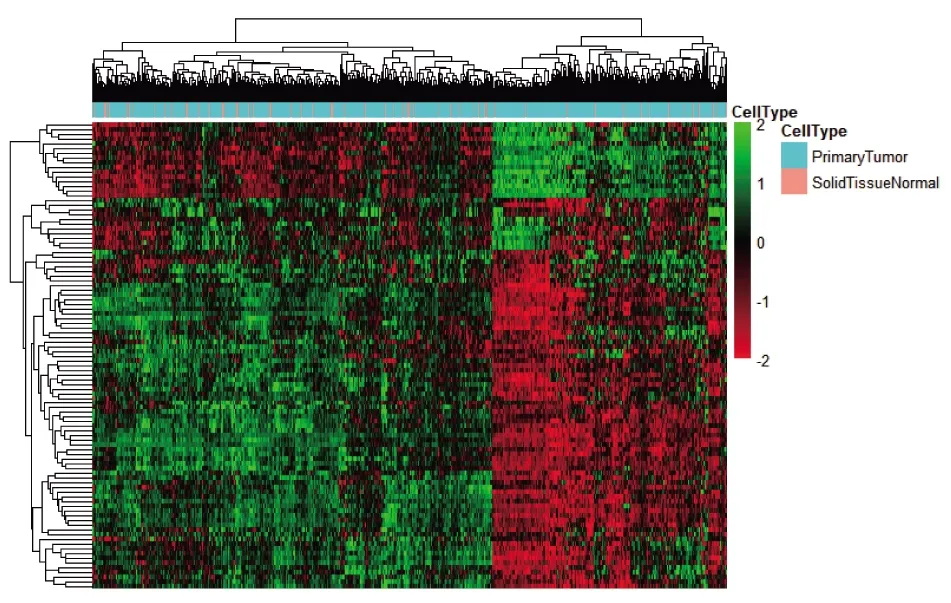
圖2 miR-486-3p差異表達基因聚類分析熱圖
2.2 GO功能注釋 使用ClusterProfiler R包對差異表達基因在生物學過程、分子功能、細胞成分、分子功能及細胞組分中的條目進行注釋。選取P值最小前10個上下表達的功能條目進行標示,發現差異表達的基因多與細胞組織結構、形態發育、ERK1/2通路等功能調控相關,見表 2、圖 3(插頁)。
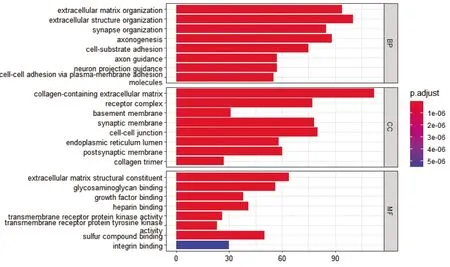
圖3 差異表達基因GO富集二級類別柱形圖
2.4 差異表達基因PTC患者的生存分析結果 將TCGA數據庫中PTC患者的臨床信息進行標準化處理后,發現miR-486-3p表達與患者的預后具有相關性,miR-486-3p低表達的PTC患者總生存率低于高表達的患者(P<0.05),生存曲線見圖 5(插頁)。
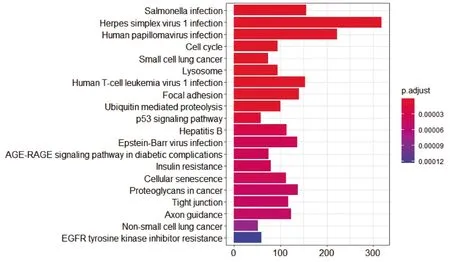
圖4 差異基因的KEGG注釋統計圖
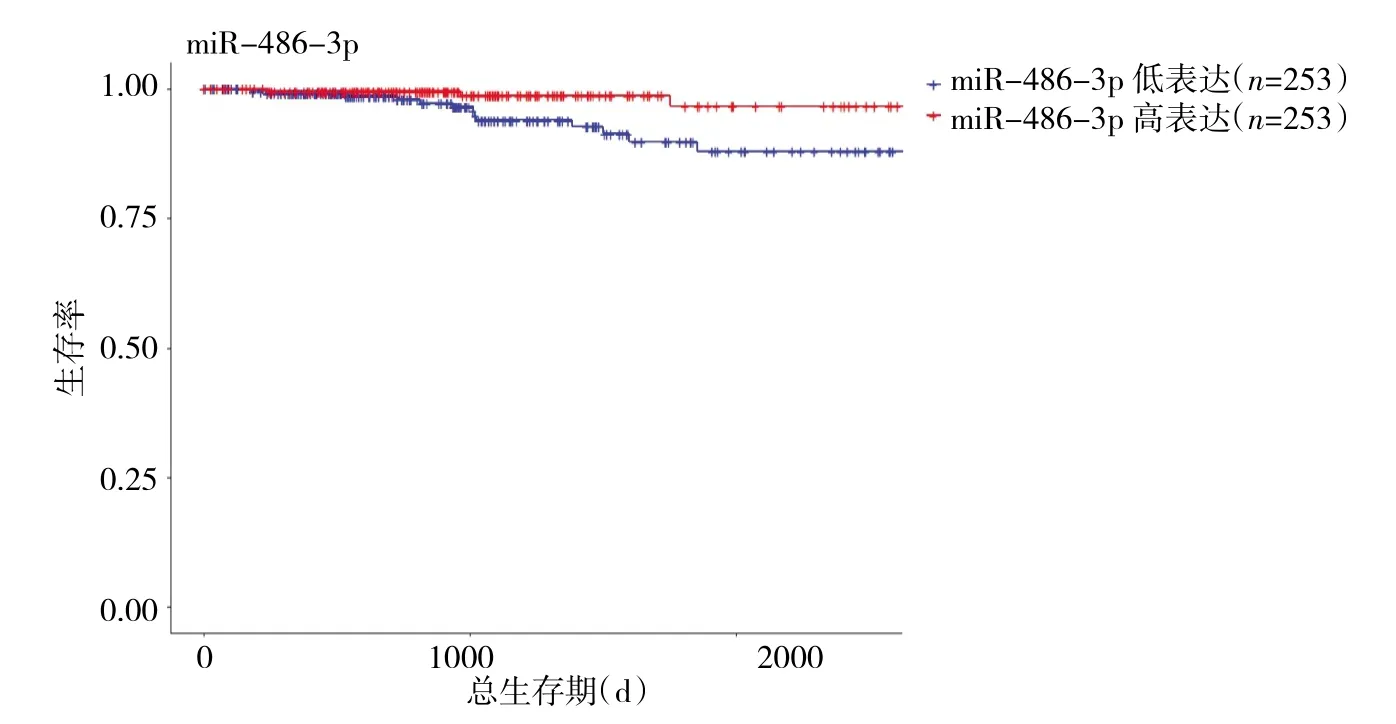
圖5 miR-486-3p高、低表達的PTC患者的生存曲線比較
2.3 差異基因的KEGG富集分析結果 PTC涉及相關通路主要有病毒感染、細胞周期、泛素化、蛋白水解、p53信號通路、細胞衰老等,見圖4(插頁)。
2.5 miR-486-3p靶基因預測與差異表達基因取交集 采用Targetscan、miRDB分別預測到miR-486-3p的5 263、941個靶基因,與miR-486-3p差異表達的15 128個mRNA取交集,得到包含689個基因的集合,見圖6,差異最明顯的前10個靶基因信息見表3。
3 討論
miRNA是由19~24個核苷酸組成的非編碼RNA,可以靶向互補mRNA來發揮調控基因的表達的功能,miRNA參與腫瘤的發生、發展和轉移等過程,miRNA的模擬物已被證明在癌癥的治療中具有巨大潛力[7-8]。本研究對PTC中的表達譜進行生物信息學分析,并研究了miR-486-3p在PTC中的表達及其靶基因分布情況,以期為PTC患者的臨床診治提供幫助。
本次分析共篩選出99個差異表達基因,其中74個基因上調,25個基因下調,GO注釋發現差異表達的基因多與細胞組織結構、形態發育、ERK1/2通路等功能調控相關,PTC差異通路主要涉及病毒感染、細胞周期、泛素化、蛋白水解、p53信號通路、細胞衰老等。研究表明多種miRNAs的表達失調可影響靶mRNA穩定性及介導翻譯抑制。miRNA通過參與組織穩態、細胞周期、免疫功能等生物過程來介導PTC淋巴轉移的發生[9]。除此之外,部分miRNAs可直接靶向p53來誘發BRAF突變,調控細胞周期進程、DNA修復和細胞凋亡從而參與PTC 的發生[9-10]。

表2 差異表達基因GO富集分析
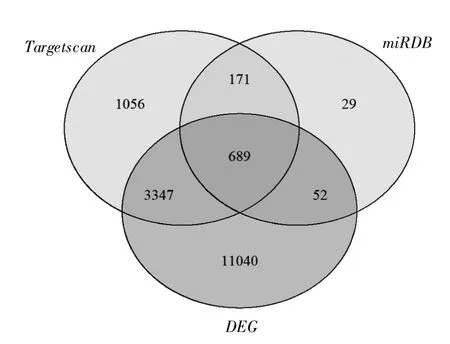
圖6 miR-486-3p差異表達基因與靶基因重疊的Venn圖
本研究還發現miR-486-3p低表達的PTC患者總生存率高,即miR-486-3p高表達的PTC患者預后不良。miR-486-3p的靶基因預測結果顯示LRP4、SRCIN1、HCN4、HPCAL4、SERPINA1、SLC34A2、SERINC2、GRM4、CTXN1、FIBCD1 可能是 miR-486-3p 在PTC中的靶點。Zhou等[11]學者研究發現LRP4作為潛在的PTC治療靶標,可上調PI3K磷酸化水平,增強PTC的增殖、遷移和侵襲能力。Zhang等[12]報道了SRCIN1作為新發現的Src結合蛋白,可通過C端Src激酶結構域調節Src活性,SRCIN1通過介導細胞G0/G1周期停止及細胞分化,并增強腫瘤細胞生長、遷移和侵襲的能力。SLC34A2通過結合肌動蛋白的復合結構域,誘導PTC細胞侵襲,促進PTC細胞的轉移能力[13]。上述基因均在PTC發生和轉移中起到關鍵作用,作為miR-486-3p的靶基因,筆者猜想miR-486-3p可能會通過靶向調控上述基因的表達來參與PTC的發生、發展過程,其具體調控的分子機制可為后續研究的方向。除此之外,有報道稱,miR-486-3p在多種惡性腫瘤中表達異常,miR-486-3p可作為腫瘤標志物,輔助肺癌早期診斷以及食管鱗癌、肌肉浸潤性膀胱癌患者的預后評估[14-16]。miR-486-3p在喉鱗狀細胞癌中會受到circFLNA的競爭性結合而表達下調,導致miR-486-3p調控FLNA蛋白的能力增強,從而介導腫瘤細胞遷移發生[17]。這些研究從多個方面輔證了本研究的結論,即miR-486-3p通過調控下游靶基因參與PTC的發生、發展。

表3 miR-486-3p靶基因預測與差異表達基因取交集
綜上所述,本研究通過生物信息學方法綜合分析了miR-486-3p的差異表達及臨床意義,發現miR-486-3p可在PTC中參與調節腫瘤細胞的生物學功能,且低表達miR-486-3p的PTC患者預后不良,這提示miR-486-3p可能作為抑癌基因及生物標志物在PTC發生、發展中發揮重要作用。

