細菌富硒代謝及生物活性的研究進展
劉昊 張宇靖 李婧祎 拓曉宏

[摘 要] ?硒是人和動物代謝所必需的微量元素,具有抑癌抗癌、抗自由基、解除重金屬中毒、提高機體免疫力、延緩衰老、維持正常細胞功能等作用。富硒微生物能通過生物轉化將無機硒轉變?yōu)榧{米硒,這種納米硒生產過程具有成本較低、硒濃度高、生物利用率高、環(huán)境污染小等優(yōu)勢。細菌硒納米顆粒具有獨特的硒原子排列,不同于化學合成納米硒的結構、理化和光電特性,已經在新一代光電、生物化學傳感器上進行了開發(fā)利用;同時納米硒顆粒作為藥物載體和富硒菌及納米硒顆粒具有的抗菌、抗氧化、抗金屬毒性、抗腫瘤和調節(jié)免疫作用的生物活性受到廣泛的關注。
[關鍵詞] ?富硒菌;富硒代謝途徑;納米硒;生物活性
[中圖分類號] ?O 613.52 ?[文獻標志碼] A ?[文章編號] 1005-0310(2020)04-0071-08
Abstract: Selenium (Se),an essential trace element across the tree of life, plays a significant role in the metabolism of human and animal life. Selenium is known to be capable of a range of functions, including anti-cancer, anti-free radical, improving immunity, anti-aging, relieving heavy metal poisoning, maintaining normal cell function and so on. Selenium-enriched microorganisms convert inorganic selenium into SeNp through biotransformation with the advantages of lower cost, higher bioavailability, higher selenium content, and less environmental pollution. The selenium nanoparticles synthesized by selenium-rich bacteria have complex and unique selenium atom arrangement, which gives it unique structural, physical, chemical and photoelectric properties different from chemical synthesis, and have been developed and utilized in a new generation of photoelectric and biochemical sensors. Selenium nanoparticles have been increasingly attracting the attention of researchers over the recent years, one of the reasons is Selenium nanoparticles as a drug carrier and meanwhile selenium-enriched bacteria and Selenium nanoparticles have been widely concerned with the biological activities of antibacterial, anti-oxidation, anti-metal toxicity, anti-tumor and immune regulation.
Keywords: Selenium-enriched bacteria; Selenium-enriched metabolism; Nano-selenium particles; Bioactivity
0 引言
富硒微生物通過生物轉化把無機硒轉變成納米硒,具有成本較低、生物利用率較高、硒含量較高、對環(huán)境污染小等優(yōu)勢,富硒菌生物轉化得到的納米硒相比于無機硒的毒性更小,安全性更高,也易被機體吸收,同時納米硒顆粒作為藥物載體和富硒菌及納米硒顆粒具有的抗菌、抗氧化、抗金屬毒性、抗腫瘤和調節(jié)免疫作用的生物活性受到廣泛的關注。然而細菌富硒轉化率受許多因素影響,本文主要介紹影響細菌合成納米硒粒子的代謝途徑、影響細菌富硒代謝的主要因素,進一步了解細菌的富硒代謝機制,進而提高細菌富硒的硒轉化率,并為生物納米硒的開發(fā)應用提供研究基礎。
1 細菌合成生物納米硒粒子的代謝途徑
自然界中存在的耐硒菌能將有高度可溶性的SeO32-、SeO42-還原為高度不溶性的低毒Se0,一般還原的終產物為不同結構形式的納米硒粒子。多種細菌和古菌都具有還原SeO32-和SeO42-的性質,圖1展示了pubmed數據庫中近10年報道的主要硒氧陰離子還原細菌的系統(tǒng)發(fā)育樹(基于16S rRNA基因序列)[1-5],使用MEGA6軟件通過鄰接法構建樹,在節(jié)點處,引導值以百分比的形式給出。細菌的納米硒顆粒合成過程可分為4個階段[6]:① 硒氧陰離子向胞內的運輸;② 胞內的還原反應;③ 硒單質向胞外的運輸;④ 硒單質組裝為納米硒顆粒。該過程中,②和④的合成過程是必然發(fā)生的,①和③的發(fā)生與否取決于②和④在胞內發(fā)生的位置,只有SeO32-、SeO42-在細菌胞內還原為Se0且Se0在胞外組裝時,③才會發(fā)生。
1.1 硒氧陰離子向胞內的運輸
耐硒菌中目前暫未發(fā)現專門的硒酸鹽轉運系統(tǒng),細菌對硒酸鹽的吸收轉運可通過在結構上與其相似的氧陰離子(如硫酸鹽或鉬酸鹽)吸收系統(tǒng)來實現。研究發(fā)現在大腸桿菌中,硒酸鹽和亞硒酸鹽通過硫酸鹽 ABC轉運通透酶系統(tǒng)(CysAWTP)進入細胞[7];但抑制硫酸鹽通透酶的表達并不會完全抑制大腸桿菌對亞硒酸鹽吸收,因此硫酸鹽通透酶不是亞硒酸鹽進入大腸桿菌的唯一通道。在Ralstonia metallidurans富硒過程中,亞硒酸鹽經歷開始的緩慢吸收后會出現一個快速吸收過程,這可能與細胞中亞硒酸鹽吸收系統(tǒng)的緩慢激活有關。光合細菌Rhodobacter sphaeroides中存在一個多羥基化合物轉運系統(tǒng)介導的亞硒酸鹽進入胞內,酵母細胞中也發(fā)現與亞硒酸鹽轉運有關的一種質子偶聯的單羧酸鹽轉運體Jen1p;除此之外,光合細菌中還存在一種機制尚未明確的低效率陰離子轉運體,其在高鉬酸鹽濃度下被證明可以轉運硒酸鹽和亞硒酸鹽[8]。還有大腸桿菌中的GutS、Rhodobacter sphaeroides中的SmoK 和 Ralstonia metallidurans中的DedA等蛋白也參與亞硒酸鹽的轉運[9-10]。
1.2 硒氧陰離子的還原
硒氧陰離子到單質硒的還原過程分為兩個階段,首先是硒酸鹽轉化為亞硒酸鹽,然后是亞硒酸鹽還原為單質硒。
目前,約有16種細菌能夠通過硒氧陰離子的異化還原而厭氧生長,厭氧菌通過厭氧呼吸還原硒酸鹽得到紅色的納米硒顆粒,這種單質硒Se0具有均勻的單斜晶體結構[8]。通過硒化氫(H2Se)化學氧化形成的非晶態(tài)Se0以及亞硒酸鹽和抗壞血酸化學還原形成的黑色玻璃狀Se0的光譜特性與微生物合成Se0納米球有很大差異。微生物合成Se0納米球具有獨特的、復雜的、緊湊的硒原子結構排列。這可能與異化還原中參與反應的多種酶有關,而在不同的細菌中參與異化還原的酶各不相同[11],因而不同富硒菌得到的納米硒在光學性質(紫外-可見吸收和拉曼光譜)上表現出很大差異,如巴氏鏈霉菌(Sulfurospirillum barnesii)、硒化芽孢桿菌(Bacillus selenitireducens)和亞硒酸桿菌(Selenihalanaerobacter shriftii)[1]。亞硒酸鹽的還原并不總是作為細菌呼吸鏈上的電子受體,Thauera selenati可以利用硒酸鹽作為厭氧呼吸的電子受體,該菌對亞硒酸鹽的還原伴隨著O2的釋放,并產生氧化應激,這可能是亞硒酸鹽的細胞毒性機理之一[7, 9]。
同時,細菌通過還原反應對胞內金屬硒鹽進行解毒,耐受硒鹽的Ralstonia metallidurans CH34在亞硒酸鹽存在下過表達超氧化物歧化酶,表明其胞內硫醇可能參與對可溶的亞硒酸鹽的解毒過程。Thauera selenati中存在一種位于細胞周質空間的硝酸還原酶,能將SeO32- 還原為Se0,而周質缺乏硝酸還原酶的突變株則不能還原SeO32-,表明硝酸還原酶是Thauera selenati還原SeO32- 的必要酶[6, 8]。細菌還原亞硒酸鹽的主要酶系統(tǒng):硝酸鹽和亞硝酸鹽周質還原酶、硫化物介導的亞硒酸鹽還原以及胞內硫醇參與的還原系統(tǒng)。細菌還原硒氧陰離子的基本反應式:
Se(VI)O42-+2e-+2H+Se(IV)O32-+H2O,
Se(IV)O32-+4e-+6H+Se0+3H2O。
除了上述兩種還原途徑外,細菌還可以通過硫酸鹽還原途徑還原,細菌首先將硫酸鹽還原為硫化物(S2-),并釋放到胞外,當環(huán)境中存在SeO2-時,S2-便與SeO2-反應,生成硒-硫顆粒黏附于細胞表面[12],近年來Li等又發(fā)現Shewanella oneidensis R-1周質中的富馬酸酯還原酶介導還原亞硒酸鹽[13]。Eswayah等發(fā)現莢膜甲基球菌(Methylococcus)和三甲基甲烷菌(Methylosinus trichosporium)厭氧呼吸系統(tǒng)的硝酸還原酶途徑參與亞硒酸鹽還原[14],然而,已知的還原亞硒酸鹽的微生物數量遠高于還原硒酸鹽的微生物[7],這提示細菌中對硒氧陰離子的還原可能存在協(xié)同作用。
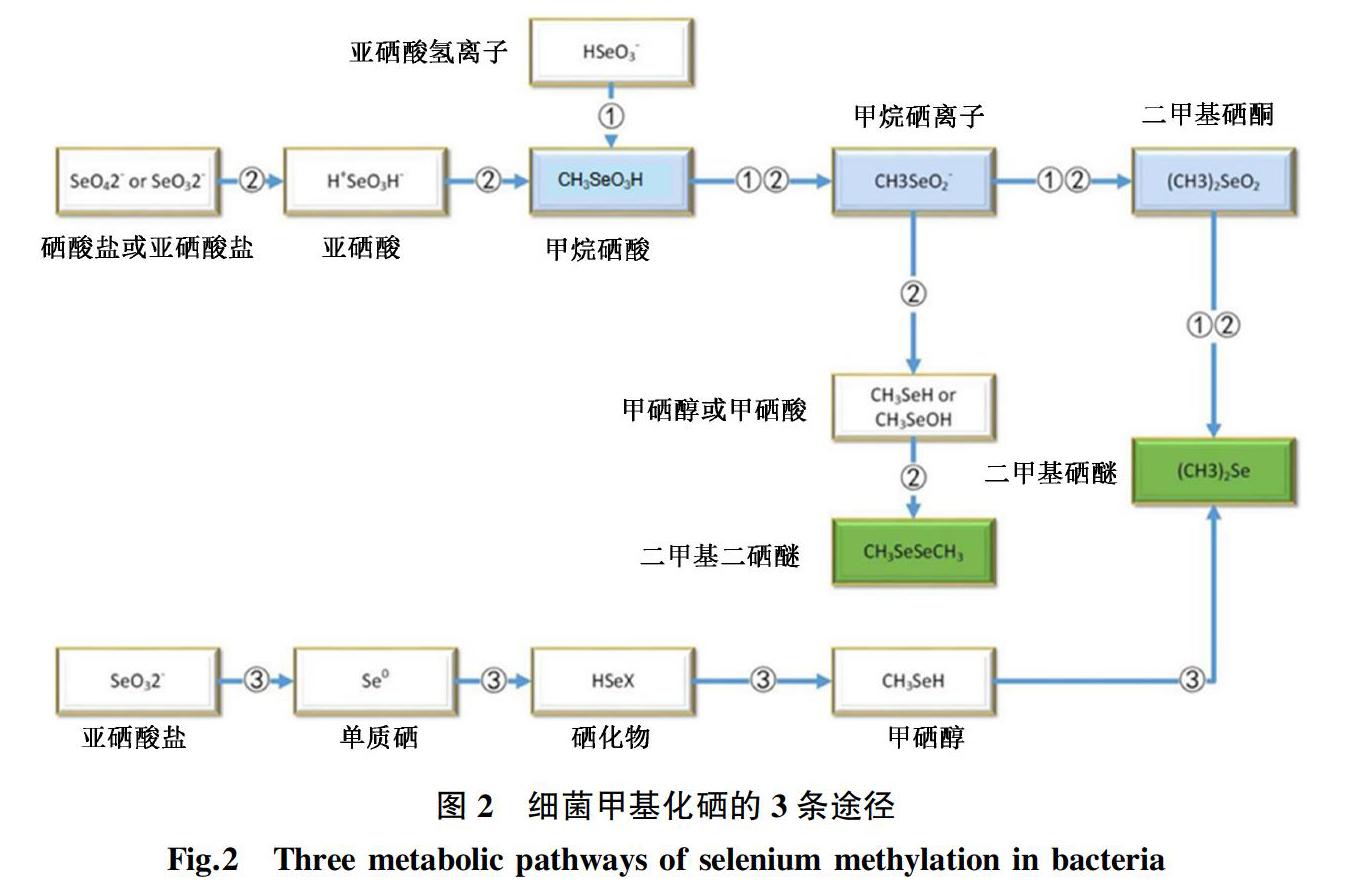
1.3 硒的甲基化
許多環(huán)境中的微生物可將硒(包括SeO42-,硒半胱氨酸和硒蛋氨酸)甲基化為揮發(fā)性化合物硒化二硒化物(DMSe,二甲基硒)和二甲基異戊烯(DMDSe,二甲基二硒)。因為產物具有揮發(fā)性,因而硒的甲基化在硒向大氣的自然循環(huán)中很重要,可利用微生物合成揮發(fā)性硒化合物法從含硒水中回收硒,也可作為一種重金屬的解毒機制[15]。在原核生物中,硒的甲基化需要甲基轉移酶的參與。Rehan等發(fā)現了3種不同的甲基轉移酶:巰基嘌呤甲基轉移酶(bTPMT)、烯二炔類抗生素(卡奇霉素)甲基轉移酶的同源物和甲基轉移酶家族MmtA[7]。
目前發(fā)現微生物主要有3條途徑來進行硒的甲基化(圖2)。途徑①是真菌硒甲基化的原始途徑,該途徑涉及硒原子的甲基化和還原,通過4個步驟形成DMSe作為最終產物。途徑②中微生物在低質量濃度的SeO32-(1~10 mg/L)下主要產生DMSe,而在高質量濃度的SeO32-(10~1 000 mg/L)下主要產生DMDSe;當Se0為唯一硒來源時,DMSe是唯一產物[16]。 在棒狀桿菌中發(fā)現了途徑③的硒甲基化過程,該過程需要先將SeO32-還原為Se0,然后再還原為硒化物,硒化物最終被甲基化生成DMSe。但是棒狀桿菌中SeO32-還原為Se0后是通過什么樣的機制來決定Se是被組裝為納米硒顆粒還是被甲基化,目前還不清楚。
1.4 納米硒顆粒的組裝和分泌
硒納米顆粒含有與其相關的微生物蛋白,它們在納米硒粒子的形成、生長及控制顆粒大小方面起著重要作用。納米球在有氧和厭氧條件下均可產生,Thauera selenatis 在細胞周質空間對亞硒酸鹽進行還原,一旦亞硒酸鹽被還原為Se0,一種約95 kDa的硒蛋白SeFA會結合到Se0上形成硒納米球,然后被分泌到胞外,但是SeFA-Se0被運出胞外的過程尚不清楚[17]。同樣納米硒是如何被組裝的也不清楚。對于納米硒顆粒向胞外的運輸,除了與SeFA結合后被分泌到胞外,在嗜麥芽窄食單胞菌中,Eleonaro等提出一種可能機制,即還原得到的胞內納米硒顆粒通過有效的SeNp分泌系統(tǒng),或者細胞破裂后運出胞外[18]。
納米硒顆粒的表征發(fā)現不同細菌合成的納米硒顆粒具有不同的直徑,直徑較大的納米硒顆粒是由小直徑的顆粒聚合而成。納米硒粒子的生物學特性取決于顆粒大小,一般認為較小的粒子具有較高的生物活性。顆粒的大小影響它們被細胞的攝取,在體外細胞攝取納米硒顆粒的研究中發(fā)現,細胞攝取0.1 μm顆粒的量,分別是1 μm、10 μm顆粒的2.5倍、6倍[19]。所以顆粒直徑<100 nm的納米硒顆粒作為藥物靶向治療載體或膳食硒有明顯優(yōu)勢,因而弄清納米硒顆粒組裝的機制對微生物生產納米硒顆粒具有重要意義。
2 細菌富硒代謝的主要影響因素
盡管富硒菌能夠將無機硒轉化為有機硒,但菌種的類別以及具體的富硒條件對富硒效率有著較大的影響。一般來講無機硒質量濃度、細菌生物量、加硒時間、培養(yǎng)基pH、碳源、氮源和無機鹽離子對硒的生物轉化率都有影響。
細菌富硒的硒源常選擇硒酸鹽和亞硒酸鹽,不同的硒源對細菌的生長有不同的作用[7]。細菌富硒中一般選可溶亞硒酸鹽為硒源,一定范圍內提高培養(yǎng)基中亞硒酸鈉質量濃度,有利于增加干菌體中硒含量,但隨著硒質量濃度增大到一定值后,硒轉化量逐漸減少[20]。這可能是因為在低質量濃度下, Se 主要用于維持細胞的完整性,作用于微生物體內的必需酶,如在某些梭菌中的煙酸脫氫酶和黃嘌呤脫氫酶,硒是這些酶的含鉬輔助因子活性位點的一部分,并促進輔酶 Q 及細胞的 DNA和RNA的生物合成,一定的硒質量濃度對于細胞的正常生長及其生物活性至關重要。當硒質量濃度大于10 mg/L時,則主要表現為毒性作用,可能是因為硒與生物大分子的巰基作用,使巰基過氧化形成S-Se-S鍵,致使蛋白質破壞而失去活性,從而抑制了細胞的正常分裂和增殖[21]。
在細菌生長過程中,加入無機硒的時間和接種菌的生物量對細菌富硒也有顯著影響。王勁松等研究無機硒的加入時間對類球紅細菌體生長和轉硒效率的影響,結果顯示細菌對于亞硒酸鈉的生物轉化具有時間峰值,在12 h后達到轉化峰值43.1%,隨著生長時間的延長,其轉化率迅速下降,至42 h時達1.2%。在延滯期之后對數生長期之前,即接種后12 h左右加入無機硒是最好的選擇;過早加入會使低濃度的菌體受到較高濃度的亞硒酸鈉脅迫而生長受到抑制,從而影響轉化硒效率[22]。相比最佳的亞硒酸鹽質量濃度、加硒時間以及初始的接種量,確定在一定生長階段的細菌群體最佳的亞硒酸鹽濃度更有意義。當確定了某特定細菌相應生長階段的最佳亞硒酸鹽濃度,理論上可使硒的生物轉化率達到最大。江曙等研究初始接種量對紅栓菌多糖無機硒生物轉化的影響,結果顯示,隨著初始接種量的增加,硒轉化率先升高后降低。不同的初始細菌接種量影響紅栓菌所受的亞硒酸鹽脅迫,這和硒加入時間影響硒轉化率的本質是一致的。此外,紅栓菌在接種量過大時會導致菌絲體繁殖過快,營養(yǎng)物質消耗過快,溶解氧不足,最終也會導致菌體的生長和多糖的合成受到抑制,影響多糖對硒的結合。因此在進行微生物富硒的研究時,不僅要考慮細菌合成富硒代謝產物的能力,還要考察細菌次生代謝產物對硒的生物結合能力[23]。在細菌的工業(yè)連續(xù)發(fā)酵時,隨著菌體濃度的增加,硒的生物轉入率都有較大的提高,故工業(yè)上通過分批補料來提高菌體培養(yǎng)濃度的同時,也提高了菌體內有機硒的絕對量[22]。
培養(yǎng)基的pH、添加的無機鹽離子和金屬離子、培養(yǎng)基氮源和碳源也會影響細菌對硒的轉化。在酵母細胞中,硒酸鹽或亞硒酸鹽的轉運受溫度、pH、碳源種類的影響,而且與磷、 硫兩種元素有關[23]。乳酸菌 Dfa-301-30 利用葡萄糖進行富硒代謝的能力要高于其他碳源,但當葡萄糖含量達到一定值時,增加葡萄糖含量,菌體的富硒含量基本保持不變,而該菌對無機氮源的利用率低于有機氮源,牛肉粉中含有豐富的營養(yǎng)成分及植物乳桿菌生長所需的生長因子,從而促進菌體的富硒生長代謝[24]。
3 富硒菌及其納米硒顆粒的生物活性 3.1 抗病毒和抑菌作用
SeNPs具有諸如毒性低、活性優(yōu)、可改善體內免疫反應等特點,其抗病毒能力也在臨床應用中得以彰顯。例如硒缺乏小鼠感染H1N1型流感病毒的死亡率比接受一定劑量Na2SeO 3的小鼠感染病毒的死亡率高3倍;血清硒濃度低的小鼠體內TNF-α和IFN-γ的水平較低,同時伴有體重明顯減少。被奧司他韋(OTV)表面修飾的SeNPs具有預防H1N1型病毒對某些動物細胞的感染、抑制流感病毒糖蛋白-血凝素和神經氨酸酶的活性來干擾H1N1進入宿主細胞、阻止Madin-Darby犬腎細胞感染后的染色質濃縮和DNA片段化、抑制細胞腫瘤抗原p53和Akt磷酸化的激活、顯著降低因H1N1進入宿主細胞產生的高水平活性氧ROS含量等多種抗病毒功效,可以對傳染性呼吸道疾病進行預防[11]。
富硒菌種類廣泛,其中富硒乳酸菌具有抑制致病性鼠傷寒沙門氏菌、大腸桿菌、金黃色葡萄球菌和單核細胞增生李斯特菌等的作用[19],通過酵母細胞內生物合成并提取出的SeNPs具有抗念珠菌活性[25]。一定濃度的SeNPs對銅綠假單胞菌、金黃色葡萄球菌、大腸桿菌和化膿性鏈球菌的生長抑制率可高達99%。除此之外,富硒益生菌具備益生菌和有機硒的雙重功能且可發(fā)揮大于二者的功效,通過營養(yǎng)競爭、產生有機酸及細菌素有利地抑制機體內致病性大腸桿菌的感染、促進腸道優(yōu)勢菌群數量,具有改善小鼠腸道內菌群結構的作用[26-27]。
3.2 抗氧化作用
谷胱甘肽過氧化物酶 (GSH-Px) 作為一種重要的過氧化物分解酶在機體內廣泛存在,而硒是其組成物質和酶活性的重要組分。有機硒可顯著提高血液中的GSH-Px活力、SOD活性和丙二醛的含量,從而有效提高機體的總抗氧化能力,且其對機體抗氧化能力的改善效果比無機硒的效果要好[27-28]。富硒酵母的抗氧化能力強于抗壞血酸,并且富硒酵母的自由基清除率與其濃度呈現線性關系,具有實用價值[25]。此外,酵母硒可抑制雄性SD高脂血癥大鼠體內脂質過氧化,并使SOD、谷胱甘肽還原酶的活性升高,谷胱甘肽的含量增加,血脂水平得到降低,從而體現其抗氧化能力。SeNPs能對于鉛給動物實質性器官、肌肉、外周血淋巴細胞以及卵巢和睪丸等組織的總抗氧化能力(T-AOC)、SOD、GST、GSH-Px、GSH和CAT等活性帶來的抑制作用起到拮抗效果,提高機體酶抗氧化系統(tǒng)的耐受力,起到抗氧化的作用[29]。Atteia等發(fā)現硒納米顆粒可通過調節(jié)硒酶和抑制miR-224防止乙酸鉛誘導的甲狀腺功能減退癥和雄性大鼠甲狀腺組織的氧化損傷[30]。
Shakibaie等在里海發(fā)現生產SeNPs的芽孢桿菌。將其全細胞裂解物中的硒納米顆粒進行純化,并用DPPH法測定抗氧化活性,將SeNPs和SeO2溶液的抗氧化結果進行對比。結果顯示在200 μg/mL 的相同質量濃度下,相比SeO2溶液13.2±3.1%的清除效果,SeNPs的清除效果為23.1±3.4%,顯示出生物合成的硒納米顆粒具有更強的抗氧化活性[31]。
3.3 抗金屬毒性作用
大量研究報道了硒在動物和細胞水平上對金屬毒性的保護作用,并解釋了許多相關的機制。金屬汞能結合GSH-Px中的巰基形成穩(wěn)定的硫醇鹽而使GSH-Px失活。而硒是谷胱甘肽過氧化物酶的活性中心,硒酵母可提高GSH-Px的活性,對汞中毒引起的GSH-Px活性下降具有明顯的拮抗效應,硒對鎘毒性具有細胞保護的作用,其機制包括降低脂質過氧化、保護線粒體損傷、調節(jié)細胞凋亡信號轉導通路等。硒(硒代蛋氨酸)對神經細胞SH-SY5Y和PC12以及體內重金屬鉛的神經毒性具有拮抗作用[27,32]。此外,補充一定量的富硒酵母可以通過減輕銅離子介導的脂質過氧化等可能的機制來降低由銅負荷而引起的肝功能損傷[33]。
3.4 抗腫瘤作用
人體一般很難直接吸收利用無機硒,但可通過腸壁的主動運輸而吸收有機硒。硒在微生物發(fā)酵的過程中從無機形態(tài)轉化為有機形態(tài),具有生物利用度高、食用安全、毒性低等優(yōu)點。它可以輔助肝癌、腸癌、 胃癌、肺癌、惡性淋巴瘤、乳腺癌、生殖細胞瘤等疾病的治療,且有一定的預防作用。李保珍[34]用沼澤紅假單胞菌菌株還原亞硒酸鹽得到了高純度的生物源納米硒,并且證明了SeNPs可以誘導肝癌HepG2細胞凋亡,抑制肝癌細胞的生長,具有濃度效應關系。富硒酵母還發(fā)現通過降低ACF的數量和大小,改變P53、BCL2、CD31等蛋白的功能等多種機制來降低結直腸癌的進展[35]。
納米硒比其他硒化合物具有更高的抗癌功效,通過流式細胞儀監(jiān)測SeNPs對Hela細胞周期阻滯的影響,可見G1期細胞百分比下降而S期細胞百分比上升,SeNPs在S期破壞細胞DNA合成并使G2期檢查點失活,從而阻斷細胞周期。同時,納米硒可通過破壞HeLa細胞中線粒體膜電位、引起細胞空泡化等作用誘導細胞凋亡;形成的空泡可能是細胞在活性內吞作用過程中形成的囊泡膜融合,進一步揭示了Hela細胞在納米硒誘導下凋亡的潛在機制,也為富硒細菌生成的納米硒作為抗癌劑提供了理論基礎。SeNPs治療改變了腫瘤細胞的生物力學特性,特別是顯著降低了粘附力和楊氏彈性模量。SeNPs還可通過介導真核細胞起始因子3(eIF3)蛋白復合物的失調使細胞周期停滯在S期、觸發(fā)細胞凋亡信號轉導誘導細胞凋亡等途徑抑制其生長能力。除了直接抗癌作用外,SeNPs還作為潛在的抗癌藥物遞送載體間接發(fā)揮抗癌作用。通過偶聯葉酸、螺旋藻多糖(SPS)等作為癌癥靶向劑,功能化的SeNPs還可用作125I輻射增敏劑促進抗癌進程[11,36]。
4 結束語
利用微生物合成的生物源性納米硒顆粒在醫(yī)學領域具有廣泛的應用前景,但納米硒顆粒的生物活性取決于其顆粒大小,微生物最終分泌的納米硒顆粒是由較小粒徑的納米硒顆粒聚合成的,研究納米硒顆粒聚合的過程及機制,研究硒鹽的濃度、無機硒加入的時間以及富硒培養(yǎng)基的氮源、碳源、pH、加入的離子等對合成粒徑小于100 nm的SeNPs的影響,能夠更好發(fā)揮納米硒在醫(yī)學應用上的優(yōu)勢。而多金屬納米粒子比單個金屬納米粒子具有更好的性能,因而要開發(fā)生產雙相納米粒子的新方法。此外,還需要研究SeNPs表面功能,將SeNPs與藥物結合,特別是探索生物源性納米硒顆粒作為抗結核和抗病毒藥物、催化劑和靶向藥物的潛力,為生物醫(yī)學開辟新的途徑。弄清微生物對全球硒的分布和硒在環(huán)境中遷移的影響,從而找到一種切實可行的方法,利用微生物消除硒污染環(huán)境中的硒。對于微生物最佳富硒條件的探索,是否更應該確定在一定生長階段的細菌群體最佳的亞硒酸鹽脅迫濃度,從而使某特定細菌相應生長階段總是有最佳亞硒酸鹽脅迫濃度,理論上使其硒的生物轉化率達到最大。微生物合成納米硒顆粒的途徑和硒甲基化的途徑在前半部分是共同的,但還原得到單質硒后既可以通過納米硒顆粒組裝途徑合成分泌納米硒顆粒,也可以通過甲基化途徑甲基化硒,因此是否可以抑制這類微生物甲基化硒而明顯加強納米硒顆粒的合成和分泌,或抑制納米硒顆粒的合成分泌從而增強硒的甲基化,或將成為微生物富硒代謝開發(fā)的研究方向。
[參考文獻]
[1] WANG Y T, SHU X, HOU J Y, et al. Selenium nanoparticle synthesized by proteus mirabilis yc801: an efficacious pathway for selenite biotransformation and detoxification[J]. Int J Mol Sci, 2018, 19(12): 3809.
[2] SONG D G, LI X X, CHENG Y Z, et al. Aerobic biogenesis of selenium nanoparticles by Enterobacter cloacae Z0206 as a consequence of fumarate reductase mediated selenite reduction[J]. Sci Rep-UK, 2017, 7(1): 3239.
[3] XU C L, QIAO L, MA L, et al. Biosynthesis of polysaccharides-capped selenium nanoparticles using lactococcus lactis nz9000 and their antioxidant and anti-inflammatory activities[J]. Front Microbiol, 2019(10): 1632.
[4] WANGY T, SHU X, ZHOU Q, et al. Selenite reduction and the biogenesis of selenium nanoparticles by alcaligenesfaecalis se03 isolated from the gut of monochamus alternatus (coleoptera: cerambycidae)[J]. Int J Mol Sci, 2018, 19(9): 2799.
[5] ZHENG S X, SU J, WANG L, et al. Selenite reduction by the obligate aerobic bacterium Comamonas testosteroni S44 isolated from a metal-contaminated soil[J]. BMC Microbiol, 2014, 14(1): 204.
[6] ESWAYAH A S, SMITH T J, GARDINER P H. Microbial transformations of selenium species of relevance to bioremediation [J]. Appl Environ Microbiol, 2016, 82(16): 4848-4859.
[7] REHAN M, ALSOHIM A S, EI-ADLY G, et al. Detoxification and reduction of selenite to elemental red selenium by Frankia[J]. Antonie Van Leeuwenhoek, 2019, 112(1): 127-139.
[8] TUGAROVA A V, KAMNEV A A. Proteins in microbial synthesis of selenium nanoparticles [J]. Talanta, 2017(174): 539-547.
[9] MCDERMOTT J R, ROSEN B P, LIU Z J. Jen1p: a high affinity selenite transporter in yeast [J]. Mol Biol Cell, 2010, 21(22): 3934-3941.
[10] 徐巧林, 吳文良, 趙桂慎,等. 微生物硒代謝機制研究進展[J]. 微生物學通報, 2017, 44(1): 207-216.
[11] HOSNEDLOVA B, KEPINSKA M, SKALICKOVA S, et al. Nano-selenium and its nanomedicine applications: a critical review [J]. Int J Nanomed, 2018(13): 2107-2128.
[12] NELSON D C, CASEY W H, SISON J D, et al. Selenium uptake by sulfur-accumulating bacteria[J]. Geochim Cosmochim Ac, 1996(60): 3531-3539.
[13] LI D B, CHENG Y Y, WU C, et al. Selenite reduction by Shewanella oneidensis MR-1 is mediated by fumarate reductase in periplasm[J]. Sci Rep-UK, 2014(4): 3735.
[14] ESWAYAH A S, SMITH T J, SCHEINOST A C, et al. Microbial transformations of selenite by methane-oxidizing bacteria [J]. Appl Environ Microbiol, 2017, 101(17): 6713-6724.
[15] ULLAH H, LIU G, YOUSAF B, et al. A comprehensive review on environmental transformation of selenium: recent advances and research perspectives [J]. Environ Geochem Hlth, 2019, 41(2): 1003-1035.
[16] 黃文峰, 楊惠超. 硒對重金屬毒性的頡頏作用[J]. 畜牧與飼料科學, 2011, 32(12): 56-57.
[17] WADHWANI S A, UTKARSHA U S, RICHA S, et al. Biogenic selenium nanoparticles: current status and future prospects [J]. Appl Microiol Biot, 2016, 100(6): 2555-2566.
[18] ELEONARO C, MARZIA B, ILSE V, et al. Biogenic selenium nanoparticles synthesized by Stenotrophomonas maltophilia SeITE02 loose antibacterial and antibiofilm efficacy as a result of the progressive alteration of their organic coating layer[J]. Microb Biotechnol, 2018 11(6):1037-1047.
[19] YANG J P, WANG J, YANG K, et al. Antibacterial activity of selenium-enriched lactic acid bacteria against common food-borne pathogens in vitro [J]. J Dairy Sci, 2018, 101(3): 1930-1942.

