[Gly14]-humanin對人臍靜脈內(nèi)皮細(xì)胞膽固醇外排的促進(jìn)作用研究
祝娃娃 王健達(dá) 張險峰 俞靈鶯
動脈粥樣硬化(atherosclerosis,AS)是由于動脈內(nèi)膜在早期局部損傷后,膽固醇尤其是氧化低密度脂蛋白(oxidized-low density lipoprotein,ox-LDL) 引起血管壁脂質(zhì)堆積,進(jìn)而導(dǎo)致動脈內(nèi)膜纖維組織增生以及內(nèi)膜增厚,最后形成動脈粥樣斑塊[1-2]。細(xì)胞內(nèi)膽固醇酯主要受清道夫受體和膽固醇逆轉(zhuǎn)錄蛋白調(diào)節(jié)[3]。膽固醇逆轉(zhuǎn)錄蛋白如腺苷三磷酸結(jié)合盒轉(zhuǎn)運體A-1(ABCA-1)和腺苷三磷酸結(jié)合盒轉(zhuǎn)運體G-1(ABCG-1)在游離膽固醇流出中起主要作用[4-6]。ABCA-1和ABCG-1協(xié)同作用維持細(xì)胞內(nèi)膽固醇攝取和流出的動態(tài)平衡,阻止脂質(zhì)在細(xì)胞內(nèi)蓄積繼而泡沫化[7]。
Humanin(HN)是一種內(nèi)源性抗細(xì)胞凋亡多肽,2001年首次在阿爾茨海默病患者大腦中發(fā)現(xiàn),在許多細(xì)胞里起抗氧化、細(xì)胞保護(hù)、抗炎癥的作用[8-9]。[Gly14]-humanin(HNG)是HN肽鏈第14位氨基酸甘氨酸取代色氨酸形成的,與HN相比,在阿爾茨海默病患者中其細(xì)胞保護(hù)活性提高了將近1 000倍[10]。本課題組前期研究表明外源性給予HNG可以通過抑制脂質(zhì)攝取從而減少ox-LDL在人臍靜脈內(nèi)皮細(xì)胞(HUVECs)的聚集[11],然而HNG對內(nèi)皮細(xì)胞脂質(zhì)外排的具體機制還有待進(jìn)一步研究。因此本研究擬探討HNG對ox-LDL誘導(dǎo)的內(nèi)皮細(xì)胞膽固醇外排的作用,進(jìn)而闡明在HUVECs中HNG對ABCA-1和ABCG-1蛋白表達(dá)的影響。
1 材料和方法
1.1 材料 HUVECs購自上海凱基生物有限公司。
1.2 主要試劑及儀器 HNG購自美國Sigma-Aldrich公司;ox-LDL購自中國奕源生物公司;ABCA-1兔單克隆抗體購自英國Abcam公司;ABCG-1兔單克隆抗體購自美國Immunoway公司;凝膠成像分析系統(tǒng)購自美國Bio-Rad公司;酶聯(lián)免疫檢測儀購自美國Tecan公司Infinite 200。Power PAC2000電泳儀購自美國Bio-Rad公司;垂直電泳槽、轉(zhuǎn)移電泳槽均購自美國Bio-Rad公司。
1.3 方法
1.3.1 細(xì)胞復(fù)蘇 取出HUVECs細(xì)胞凍存管迅速置于37℃的水浴鍋中持續(xù)快速振蕩使細(xì)胞融化;先吸取5 ml DMEM培養(yǎng)基,再快速從凍存管吸取2 ml細(xì)胞液,置于15 ml離心管中,1 200 r/min離心5 min,吸出上清液,加入含10%小牛血清的DMEM完全培養(yǎng)基5 ml中,混勻后將細(xì)胞懸液加入細(xì)胞培養(yǎng)皿中,吹打均勻,置于37℃、含5% CO2的培養(yǎng)箱培養(yǎng)。
1.3.2 細(xì)胞傳代 從培養(yǎng)箱中取出貼壁生長近100%的細(xì)胞,吸出上清液,加入1.0 ml的0.25%Trypsin,靜置1 min,至細(xì)胞觸角開始回縮;吸去培養(yǎng)皿中的培養(yǎng)液,加入含10%FBS的DMEM培養(yǎng)基混勻,以1∶4種入新的培養(yǎng)皿,最后放置37℃、5% CO2的培養(yǎng)箱培養(yǎng)。
1.3.3 HUVECs細(xì)胞分組與處理 將對數(shù)生長期的HUVECs細(xì)胞接種于6孔板中并隨機分組,其中采用ox-LDL 處理的5組:0 μg/ml ox-LDL組、30 μg/ml ox-LDL組、60 μg/ml ox-LDL 組、90 μg/ml ox-LDL 組、120 μg/ml ox-LDL組;采用HNG處理的5組:0 nM HNG組、50 nM HNG 組、100 nM HNG 組、1 μM HNG 組、10 μM HNG組;聯(lián)合用藥處理的5組:空白組、ox-LDL組、ox-LDL+100 nM HNG 組、ox-LDL+1 μM HNG 組、ox-LDL+10 μM HNG組,分別使用不同濃度的HNG預(yù)處理HUVECs細(xì)胞1 h,隨之加入60 μg/ml ox-LDL;經(jīng)培養(yǎng)及不同藥物濃度作用12 h后收集細(xì)胞樣品。另設(shè)HNG作用不同時間 5組:0 h HNG 組、3 h HNG 組、6 h HNG 組、12 h HNG組、24 h HNG組,將1 μM的HNG按上述時間處理細(xì)胞后再收集細(xì)胞樣品。
1.3.4 ABCA-1、ABCG-1蛋白表達(dá)水平檢測 采用Western blot法。用預(yù)冷的PBS洗滌HUVECs細(xì)胞2次以上,加入100 μl的RIPA細(xì)胞裂解液,4℃、13 200 r/min離心15 min,取上清液,進(jìn)行蛋白質(zhì)定量后,常規(guī)進(jìn)行聚丙烯酰胺凝膠電泳,上樣量為50 μg,轉(zhuǎn)膜、封閉后轉(zhuǎn)印至膜,加入兔單克隆抗體ABCA-1或兔單克隆抗體ABCG-1和β-actin作為一抗,4℃孵育過夜后,加入與一抗所相對應(yīng)的二抗,ECL化學(xué)發(fā)光,分析條帶的灰度值并與各自的內(nèi)參β-actin的比值來判斷目的蛋白的表達(dá)水平。
1.4 統(tǒng)計學(xué)處理 采用SPSS 17.0和GraphPad Prism 5統(tǒng)計軟件。計量資料以±s表示,多組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。P<0.05為差異有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 不同濃度ox-LDL處理后ABCA-1、ABCG-1蛋白表達(dá)水平比較 與 0 μg/ml ox-LDL 組相比,60、90、120 μg/ml ox-LDL組ABCA-1、ABCG-1蛋白表達(dá)水平均明顯升高,差異均有統(tǒng)計學(xué)意義(均P<0.05),見圖1和表1。

圖1 不同濃度氧化低密度指蛋白(ox-LDL)處理后腺苷三磷酸結(jié)合盒轉(zhuǎn)運體A-1(ABCA-1)、腺苷三磷酸結(jié)合盒轉(zhuǎn)運體G-1(ABCG-1)蛋白表達(dá)的電泳圖(a:ABCA-1蛋白;b:ABCG-1蛋白)
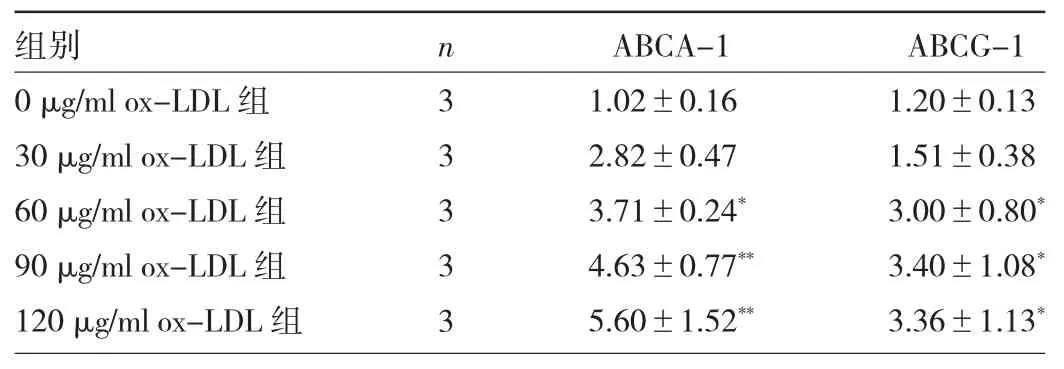
表1 不同濃度ox-LDL處理后ABCA-1、ABCG-1蛋白表達(dá)水平比較
2.2 不同濃度HNG處理后ABCA-1、ABCG-1蛋白表達(dá)水平比較 與0 nM HNG組相比,1、10 μM HNG組ABCA-1、ABCG-1蛋白表達(dá)水平均明顯升高,差異均有統(tǒng)計學(xué)意義(均P<0.05),見圖2和表2。
2.3 不同時間HNG處理后ABCA-1、ABCG-1蛋白表達(dá)水平比較 與0 h HNG組相比,12、24 h HNG組ABCA-1、ABCG-1蛋白表達(dá)水平均明顯升高,差異均有統(tǒng)計學(xué)意義(均P<0.05),見圖3和表3。
2.4 HNG與ox-LDL聯(lián)合處理后ABCA-1和ABCG-1蛋白表達(dá)水平比較 與空白組比較,ox-LDL組ABCA-1、ABCG-1蛋白表達(dá)水平均明顯升高,差異均有統(tǒng)計學(xué)意義(均 P<0.05);而與 ox-LDL 組相比,ox-LDL+1 μM HNG 組、ox-LDL+10 μM HNG 組 ABCA-1、ABCG-1 蛋白表達(dá)水平均明顯升高,差異均有統(tǒng)計學(xué)意義(均P<0.05),見圖 4 和表 4。
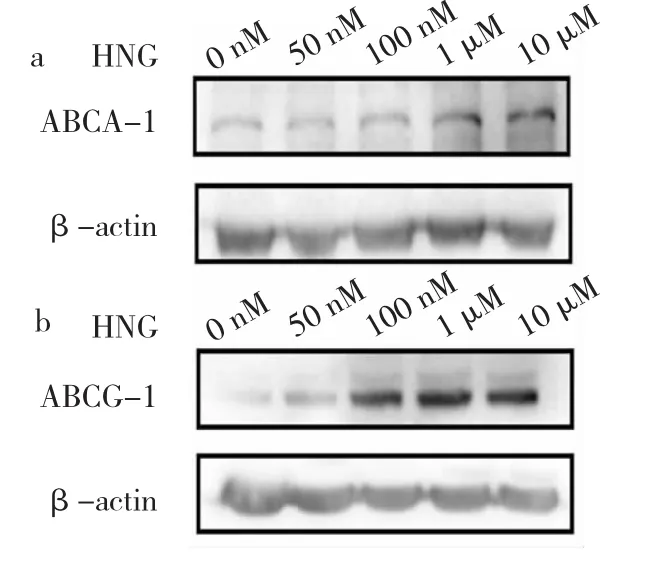
圖2 不同濃度[Gly14]-humanin(HNG)處理后腺苷三磷酸結(jié)合盒轉(zhuǎn)運體A-1(ABCA-1)、腺苷三磷酸結(jié)合盒轉(zhuǎn)運體G-1(ABCG-1)蛋白表達(dá)的電泳圖(a:ABCA-1蛋白;b:ABCG-1蛋白)
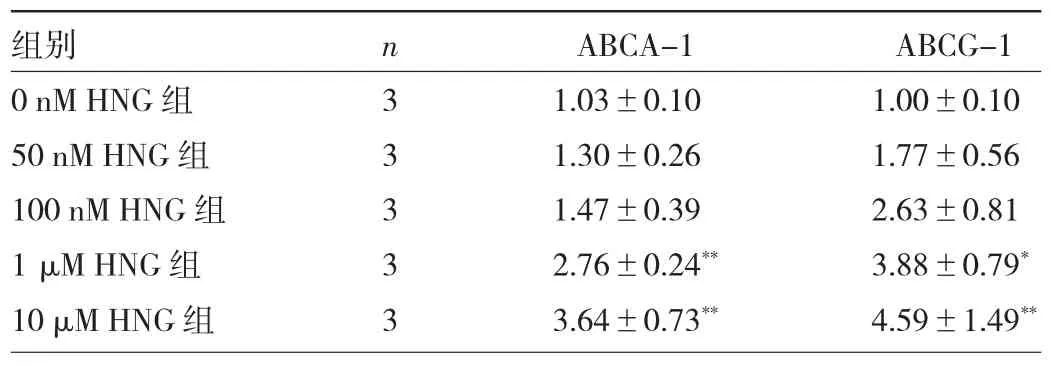
表2 不同濃度HNG處理后ABCA-1和ABCG-1蛋白表達(dá)水平比較
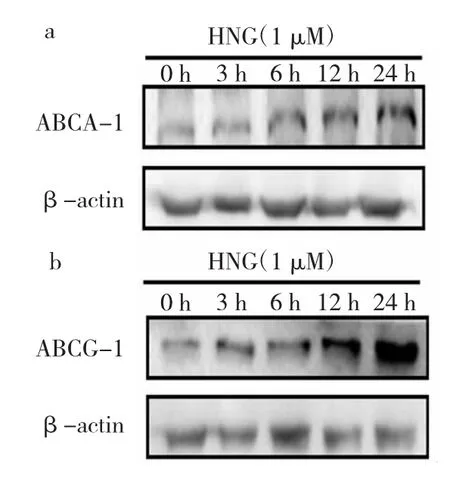
圖3 不同時間[Gly14]-humanin(HNG)處理后腺苷三磷酸結(jié)合盒轉(zhuǎn)運體A-1(ABCA-1)、腺苷三磷酸結(jié)合盒轉(zhuǎn)運體 G-1(ABCG-1)蛋白表達(dá)的電泳圖(a:ABCA-1蛋白;b:ABCG-1蛋白)
3 討論
動脈內(nèi)膜下沉積過量的膽固醇尤其是ox-LDL并逐漸形成泡沫細(xì)胞是動脈粥樣硬化的主要特征,ox-LDL是慢性冠脈疾病的重要危險因子,是導(dǎo)致動脈粥樣斑塊形成和斑塊不穩(wěn)定性重要原因[12-13]。血液中的ox-LDL逐漸被酯化、處理、儲存和聚集成細(xì)胞脂質(zhì)滴沉積在血管內(nèi)膜下,從而導(dǎo)致泡沫細(xì)胞形成[14]。ox-LDL濃度與動脈粥樣硬化進(jìn)程呈正相關(guān),是引起動脈粥樣硬化最危險的因子[15]。清道夫受體介導(dǎo)的ox-LDL的攝取和逆轉(zhuǎn)錄受體介導(dǎo)的膽固醇外排是調(diào)節(jié)脂質(zhì)代謝平衡兩條關(guān)鍵途徑[16]。他汀類藥物可通過抑制TC和LDL水平而降低血脂及穩(wěn)定斑塊等起到抗動脈粥樣硬化的重要作用,但長期使用該類藥物會引起肝毒性和肌溶癥等不良反應(yīng)而影響它的臨床應(yīng)用。而積極尋找一種新的毒性低、療效好的降脂藥物可能對動脈粥樣硬化的治療很有應(yīng)用前景。
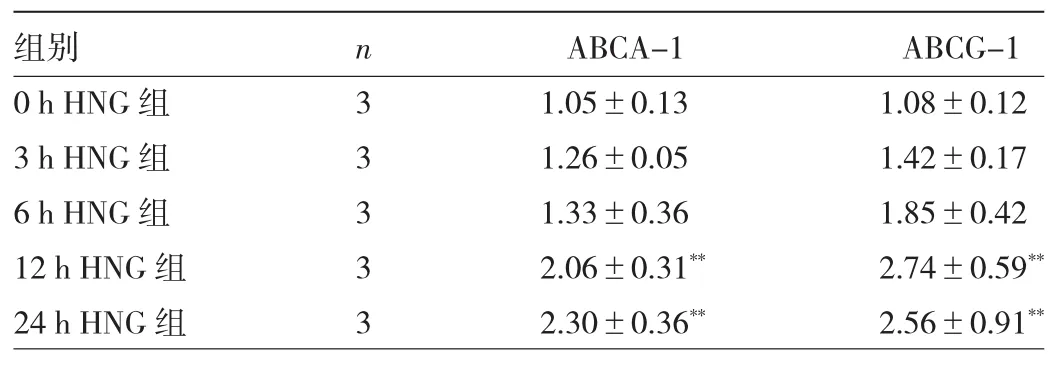
表3 不同時間HNG處理后ABCA-1、ABCG-1蛋白表達(dá)水平比較

圖4 [Gly14]-humanin(HNG)與氧化低密度脂蛋白(ox-LDL)聯(lián)合處理后腺苷三磷酸結(jié)合盒轉(zhuǎn)運體A-1(ABCA-1)和腺苷三磷酸結(jié)合盒轉(zhuǎn)運體 G-1(ABCG-1)蛋白表達(dá)的電泳圖(a:ABCA-1蛋白;b:ABCG-1蛋白)
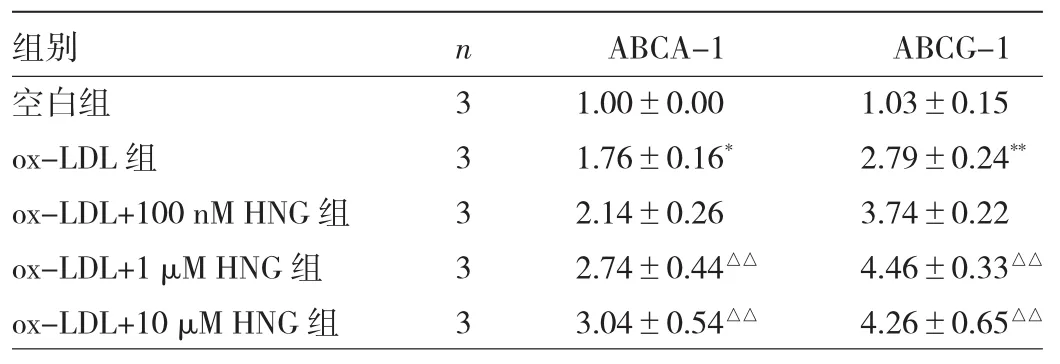
表4 HNG與ox-LDL聯(lián)合處理后ABCA-1和ABCG-1蛋白表達(dá)水平比較
HN是一種由24個氨基酸所組成的抗凋亡多肽,能夠?qū)褂傻矸蹣拥鞍譊所誘導(dǎo)的神經(jīng)細(xì)胞凋亡[17]。HN也參與了動脈粥樣硬化的發(fā)生、發(fā)展,在動脈粥樣硬化患者頸動脈脂質(zhì)斑塊及人類血管內(nèi)皮細(xì)胞和中均發(fā)現(xiàn)有HN的表達(dá)[18]。研究表明,使用HNG干預(yù)高脂飲食誘導(dǎo)的小鼠后,可增加肝微粒體甘油三酯轉(zhuǎn)移蛋白(MTTP)的表達(dá)并促進(jìn)肝臟TG的分泌,而顯著降低小鼠體內(nèi)肝TG的蓄積[19]。筆者前期研究發(fā)現(xiàn),HNG通過抑制植物凝集素樣氧化型低密度脂蛋白受體-1(LOX-1)入胞,減少ox-LDL在血管內(nèi)皮細(xì)胞的聚集[11]。然而,HNG對內(nèi)皮細(xì)胞脂質(zhì)外排的具體機制還有待進(jìn)一步的研究。
細(xì)胞內(nèi)膽固醇從血管壁外排到細(xì)胞外的受體,主要包括ABCA-1和ABCG-1受體[3]。ABCA-1是膽固醇外排最重要的逆轉(zhuǎn)錄受體,在人和動物中,ABCA-1對動脈粥樣硬化的保護(hù)起到了關(guān)鍵的作用,敲減ABCA-1基因會增加細(xì)胞內(nèi)膽固醇的聚集[20]。此外,許多種具有抗動脈粥樣硬化作用的藥物,例如槲皮素、Apelin-13及大蒜提取主要成S-烯丙基半胱氨酸等都能增加ABCA-1的表達(dá),而促進(jìn)巨噬細(xì)胞膽固醇的流出[21-23]。除了ABCA-1對脂質(zhì)外排的重要作用外,逆轉(zhuǎn)錄受體ABCG-1在膽固醇逆轉(zhuǎn)錄中也發(fā)揮重要作用。以往研究顯示多種物質(zhì)包括桉樹酚(在茶和草本的一個小芳香化合物)和巖藻甾醇(海藻中豐富的膽固醇)可通過激活肝臟X受體(LXR)和類視黃醛受體(RXR)而增加ABCG-1的表達(dá)[24-25]。ABCG-1基因敲除后可明顯減少巨噬細(xì)胞逆轉(zhuǎn)錄的作用,而增加ABCG-1的表達(dá)后可顯著促進(jìn)巨噬細(xì)胞膽固醇的外排進(jìn)而抑制泡沫細(xì)胞的形成[26]。
綜上所述,ABCA-1和ABCG-1在膽固醇外流起著關(guān)鍵作用。筆者在本實驗中,通過Western blot法檢測ABCA-1和ABCG-1蛋白的表達(dá)。在ox-LDL誘導(dǎo)下,隨著ox-LDL濃度的增加,ABCA-1和ABCG-1蛋白的表達(dá)逐漸增加。而HNG單獨處理后,ABCA-1和ABCG-1的蛋白表達(dá)隨著濃度和時間的增加而逐漸增加,表明HNG單獨處理可以促進(jìn)HUVECs細(xì)胞脂質(zhì)的外排。最后,HNG與ox-LDL聯(lián)合作用后,HUVECs細(xì)胞ABCA-1和ABCG-1的蛋白表達(dá)比ox-LDL單獨處理后的表達(dá)量顯著增加。總之,降脂治療已經(jīng)被證實能夠降低臨床事件的發(fā)生,HNG在HUVEC內(nèi)皮細(xì)胞的保護(hù)作用中,為我們提供了新的見解。HNG有減少內(nèi)皮細(xì)胞脂質(zhì)蓄積的作用,可能成為預(yù)防動脈粥樣硬化發(fā)展新的合適研究藥物。

