右美托咪定對肺葉切除術患者肺組織炎癥反應和細胞焦亡相關因子的影響
辛苗 張春光 于京福 代汭 萬效梅 王燕 王曉
胸外科手術通過雙腔氣管實現的單肺通氣(OLV)會導致通氣血流比值失調、肺泡上皮細胞和毛細血管內皮細胞的損傷,從而造成肺間質和肺泡水腫,臨床表現為進行性低氧血癥和呼吸窘迫,其發展到嚴重階段稱為急性呼吸窘迫綜合征[1]。OLV引發急性肺損傷的機制包括中性粒細胞的活化、炎癥反應、細胞凋亡和T細胞失衡[2],如何減輕OLV引起的肺損傷是當今臨床醫生研究的熱點問題。右美托咪定是一種高度選擇性α2受體激動劑,可用于ICU患者短期和長期鎮靜[3]。有研究表明,右美托咪定可減輕膿毒癥引起的急性肺損傷[4]。但在目前關于右美托咪定改善OLV引起肺損傷的研究多為小樣本、單中心研究,缺乏臨床研究的內部真實性。細胞焦亡是組織程序性壞死的另一種形式,可誘導細胞因子的轉錄、細胞質內巨噬細胞的模式識別受體(PRRs)激活,也可以誘導刺激炎癥反應[5]。有研究表明右美托咪定減輕大鼠離體肺缺血再灌注損傷的機制可能與抑制細胞焦亡有關[6],目前只局限于動物研究;右美托咪定是否通過細胞焦亡機制減輕肺葉切除術患者OLV引起的急性肺損傷,國內外尚未見相關研究。本研究擬評價右美托咪定對肺葉切除術患者肺組織炎癥反應和細胞焦亡相關因子的影響,進一步明確右美托咪定減輕肺損傷的作用機制。
1 對象和方法
1.1 對象 選取2018年11月至2019年11月青島大學附屬醫院210例、青島市市立醫院228例需行胸腔鏡肺葉切除術患者共438例,男221例,女217例,ASA分級Ⅰ 或Ⅱ級,年齡30~70歲,體重50~80 kg。采用隨機數字表法分為對照組(C組)和右美托咪定組(D組),每組219例。納入標準:(1)心力衰竭分級(NYHA分級)Ⅰ或Ⅱ級;(2)無腦外傷、腦出血、腦梗死病史;(3)肝腎功能正常;(4)近期無酗酒濫用藥物史;(5)既往無精神心理疾病病史,且近期未服用抗精神病藥物;(6)手術時間120~180 min;(7)患者知情且愿意配合試驗。排除標準:(1)NYHA 分級Ⅲ~Ⅳ級;(2) 術前肺功能嚴重下降(PaO2<60 mmHg或用力呼氣量<50%);(3)凝血功能異常或血小板減少;(4)既往曾接受放療、化療或免疫治療;(5)全身或局部感染(包括C反應蛋白升高、白細胞增多或體溫>38℃);(6)患者中途拒絕繼續配合試驗或者死亡;(7)圍術期發生嚴重的不良事件,如心律失常、氣道插管困難、過敏性休克等。C組手術暫停7例,不同意參與本研究5例,術中出現大出血8例惡性心律失常4例,術后1 d心臟停搏2例,最終納入193例。D組手術暫停5例,不同意參與本研究4例,術中出現大出血8例、惡性心律失常9例,術后1 d體溫>38℃3例,最終納入190例。兩組患者一般資料比較差異均無統計學意義(均P>0.05),見表l。本研究經青島市市立醫院倫理委員會批準,所有患者均提供書面知情同意書。
1.2 方法
1.2.1 麻醉方法 患者入手術室后開放動靜脈,連接心電監護。D組于麻醉誘導前10 min經靜脈輸注右美托咪定(江蘇恒瑞醫藥股份有限公司)負荷劑量1.0 μg/kg,隨后以0.3 μg/(kg·h)的速率靜脈輸注至術畢前30 min,C組以同樣方式靜脈輸注等容量0.9%氯化鈉注射液。麻醉誘導采用靶控輸注異丙酚,初始濃度1.0 μg/ml,逐步增加到 0.3 μg/ml,直到腦電雙頻指數(BIS)值 40~55,靜脈注射咪達唑侖0.03 ml/kg、舒芬太尼0.5 μg/kg和羅庫溴銨0.9 mg/kg。麻醉誘導后行雙腔氣管導管插管術,采用纖維支氣管鏡確定雙腔氣管導管位置,氣管插管完成后,潮氣量8 ml/kg,吸氣與呼氣比為1∶2,呼吸頻率為8次/min。持續輸注丙泊酚4~8 mg/(kg·h)、瑞芬太尼0.1~0.2 μg/(kg·min)和順阿曲庫銨0.3~0.4 mg/kg維持麻醉,維持BIS值40~60。手術前將通氣模式改為OLV,調整呼吸頻率和潮氣量以維持脈搏血氧飽和度和呼吸末二氧化碳分壓。患者恢復自主呼吸拔管后進入麻醉后監護病房(PACU),Steward評分>4后離開PACU。術中應保持患者血流動力學穩定,術畢均連接13960自控鎮痛泵(美國Abbott公司)行靜脈自控鎮痛(PCIA),維持靜態視覺模擬評分法(VAS)<3分,鎮痛藥配方:酒石酸布托啡諾注射液10 mg,用0.9%氯化鈉注射液稀釋到100 ml,負荷量為2 ml,背景輸注速率為2 ml/h,PCIA劑量為0.5 ml,鎖定時間為15 min。
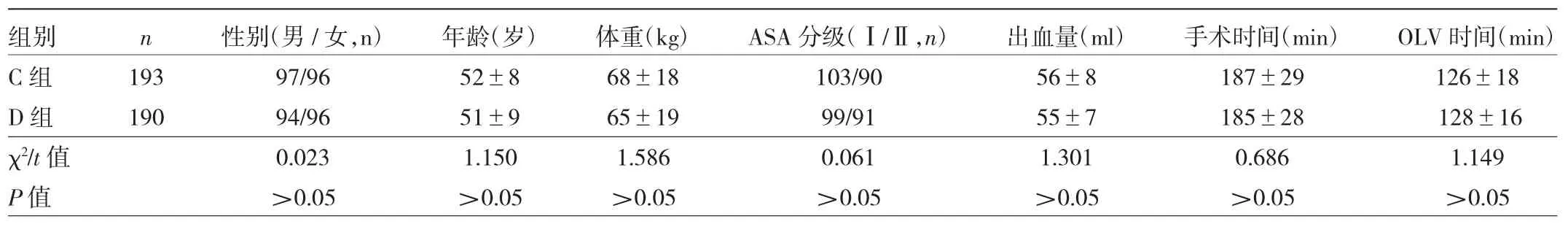
表1 兩組患者一般資料的比較
在麻醉的影響下,平均動脈壓(MAP)低于基線20%或MAP<60 mmHg持續超過30 s為低血壓,予去氧腎上腺素40 μg。靜脈注射阿托品0.3 mg治療心動過緩(心率<60次/min)。
1.2.2 肺組織采集及測定 術中距離病變區8 cm以上獲取4 mm×4 mm×4 mm肺組織標本3份,-80℃冰箱保存,采用Western blot法檢測肺組織消皮素D(GSDMD)、NOD 樣受體家族蛋白 3(NLRP3)、凋亡相關微粒蛋白(ASC)和半胱天冬酶-1(Caspase-1)的表達。取1份肺組織標本按照每20 mg組織加200 μl裂解液,超聲裂解,4℃離心后取上清液,12 000 r/min 3~5 min,BCA法測定蛋白濃度,加入5×上樣緩沖液100℃變性5 min,-20℃凍存電泳完畢將膠上的蛋白轉移到PVDF膜(美國Millipore公司)上,然后用5%脫脂奶粉室溫封閉2 h,取出膜,于搖床上用TBST洗膜5 min×3次。孵育袋中加入封閉液稀釋的兔GSDMD多克隆抗體(稀釋度 1∶1 000,英國 Biorbyt公司)、兔 NLRP3多克隆抗體(稀釋度 1∶1 000,英國 Biorbyt公司)、兔 ASC 多克隆抗體(稀釋度 1∶800,美國 Santa Cruz公司)、兔 Caspase-1多克隆抗體(稀釋度1∶1 000,英國 Biorbyt公司)、β-actin(稀釋度 1∶2 000,美國 Santa Cruz公司),4 ℃孵育過夜。TBST洗膜5 min×3次,辣根過氧化物酶標記的二抗(稀釋度1∶2 000,美國Jackson公司)室溫孵育2 h。TBST洗膜15 min×5次。膜于化學發光檢測試劑(試劑A∶試劑 B=1∶1)反應 2 min,取出膜,甩去多余的液體,用保鮮膜包好PVDF膜,暗室中用X線膠片感光、顯影、定影。采用凝膠圖像Image J軟件(美國NIH公司)分析蛋白條帶灰度值,以目的蛋白條帶灰度值與內參βactin條帶灰度值的比值反映其表達水平。
另選1份肺組織稱濕重(W)后,將肺組織在電烤箱中以70℃烘烤至恒重,稱干重(D),并計算肺組織的干濕重(W/D)值。另1份肺組織經HE染色后用BX41型顯微鏡(日本Olympus公司)觀察,參考文獻[7]進行肺組織病理學損傷評分。
1.3 觀察指標 (1)記錄患者手術過程中出血量(從手術切口到皮膚閉合)、手術時間(從手術切口到皮膚閉合)、OLV 時間。(2)分別于開始 OLV 即刻(T1)、15 min(T2)、30 min(T3)、60 min(T4)和恢復雙肺通氣 1 h(T5)采集動脈血2 ml進行血氣分析并計算氧合指數(OI),OI=PaO2/吸入氧濃度(FiO2)。(3)術后情況:記錄術后 48 h 內兩組患者肺炎、肺不張的發生情況,記錄術后住院時間。
1.4 統計學處理 采用SPSS 17.0統計軟件。計量資料以±s表示,組間比較采用t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者不同時點OI的比較 與 T1時比較,兩組患者 T2~5時 OI均降低(均 P<0.05);與 C 組比較,D組 T2~5時 OI升高(P<0.05),見表 2。
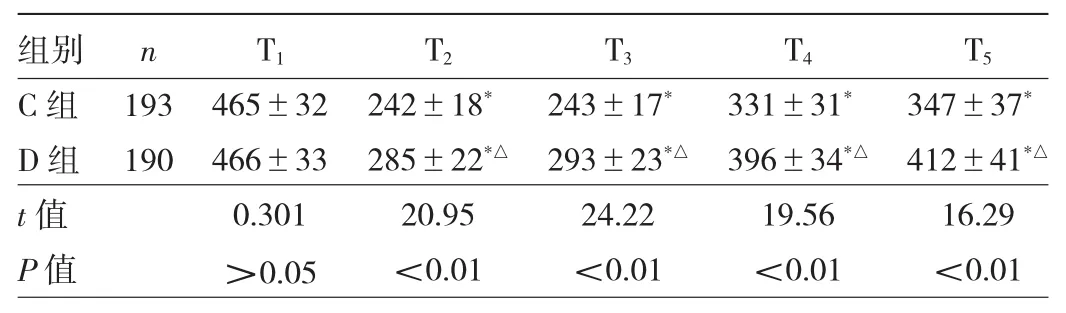
表2 兩組患者不同時點OI的比較
2.2 兩組患者肺組織病理觀察比較 光鏡下,C組肺組織炎性細胞浸潤、肺泡壁增厚、充血明顯。肺泡內可見較多粉紅色、均勻的水腫液,見圖 1。D組肺泡結構完整,肺泡腔內滲出較少,見圖2。

圖2 D組肺組織病理檢查所見(HE染色,×400)
2.3 兩組患者肺組織W/D值和肺病理學損傷評分的比較 與C組比較,D組肺組織W/D值降低(P<0.05),肺病理學損傷評分降低(P<0.05),見表3。
2.4 兩組患者肺組織GSDMD、NLRP3、ASC和Caspase-1表達的比較 與C組比較,D組肺組織GSDMD、NLRP3、ASC和Caspase1的表達均降低(P<0.05),見表4和圖3。
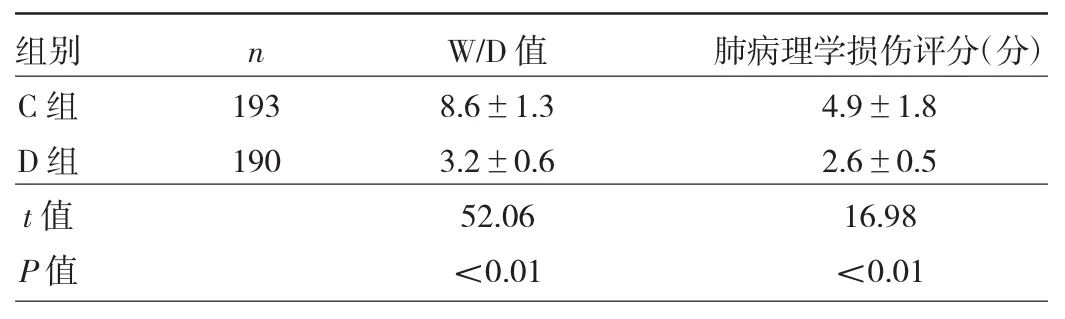
表3 兩組患者肺組織W/D值和肺病理學損傷評分的比較
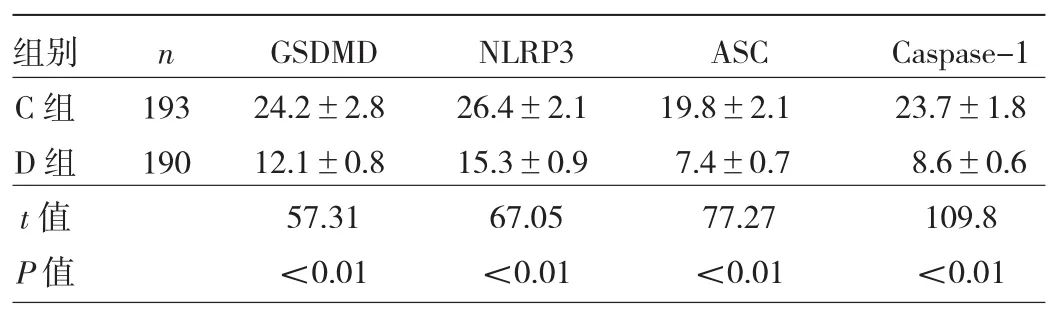
表4 兩組患者肺組織GSDMD、NLRP3、ASC和Caspase-1表達的比較
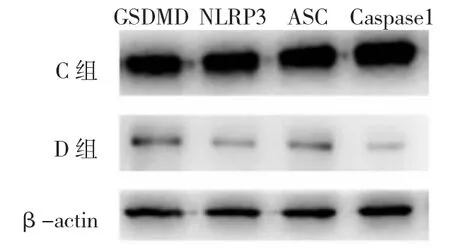
圖3 兩組患者肺組織消皮素D(GSDMD)、NOD樣受體家族蛋白3(NLRP3)、凋亡相關微粒蛋白(ASC)和半胱天冬梅 -1(Caspase-1)表達電泳圖
2.5 兩組患者術后肺炎、肺不張、呼吸衰竭發生率及術后住院時間的比較 與C組比較,D組術后肺炎和肺不張發生率降低,術后住院時間明顯縮短(均P<0.05),兩組患者術后均未見呼吸衰竭發生。見表5。
表5 兩組患者術后肺炎、肺不張、呼吸衰竭發生率及術后住院時間的比較
3 討論
肺切除手術可引起術后肺部并發癥包括肺不張、肺炎和急性呼吸窘迫綜合征。呼吸機引起的肺損傷和急性呼吸窘迫綜合征是肺切除術后高發病率和高死亡率的主要原因[8]。隨著微創技術的應用,OLV已成為胸腔內手術必須的操作手段,有研究發現,OLV與術后肺部并發癥有關[9]。另有研究發現,開胸手術后有4%~15%的患者發生急性肺損傷[10]。此外,有研究發現,肺切除手術中使用正呼氣末壓(PEEP)或持續氣道正壓(CPAP)≥5 cmH2O,可顯著降低急性肺損傷的發病率[11],因此如何減輕胸科手術引起的急性肺損傷是近年來研究的熱點。
NLRP3炎性小體由NLRP3、ASC和Caspase-1組成,這些蛋白具有親同性相互作用的保守結構域[12],NLRP3炎性小體可與pyrin結構域(PYD)之間的相互作用為ASC寡聚提供支架,參與炎癥的發生過程,發揮促炎作用[13]。ASC蛋白分子包含195個氨基酸殘基,是參與細胞凋亡信號轉導蛋白[14]。ASC作為細胞中一種重要的連接蛋白,通過Caspase-l活化途徑參與并在NLRP3炎性小體的組成中發揮重要作用[15]。Caspase-l可促進GSDMD的裂解和易位,形成膜孔,促進胞內炎性物質的釋放,最終導致焦亡。已有研究證實,導致ALI/ARDS的多種內外源性因素可活化NLRP3炎癥小體,加重炎癥反應[16]。因此本研究觀察肺組織GSDMD、NLRP3、ASC和Caspase-1蛋白含量的變化。
本研究結果顯示,使用右美托咪定可使肺病理學損傷評分降低、肺組織W/D值降低,OLV15、30、60 min及恢復雙肺通氣1 h OI升高,術后肺炎、肺不張的發生率降低,術后住院時間縮短表明右美托咪定可通過減輕肺水腫,改善雙肺通氣氧合,降低患者術后并發癥從而改善OLV肺損傷。此外本研究還發現當使用右美托咪定肺組織 GSDMD、NLRP3、ASC和 Caspase-1表達下調,提示右美托咪定可抑制肺組織細胞焦亡,從而降低炎癥反應,減輕肺葉切除術引起的急性肺損傷,其機制可能是右美托咪定通過激活中樞α2腎上腺受體抑制交感神經活性,使體內迷走神經相對興奮,激活膽堿能抗炎途徑,與α7亞基的煙堿樣乙酰膽堿受體(α7nAChR)作用發揮抗炎作用,降低血漿中高遷移率族蛋白B1(HMGB1)濃度[17-18],同時顯著降低循環中兒茶酚胺的水平[19];右美托咪定可阻止肺泡巨噬細胞NF-κB 的核易位和轉錄降低 IL-6、IL-1β、TNF-α 等炎性因子濃度[20],減輕 IL-6、IL-1β、TNF-α 等炎性因子對肺泡巨噬細胞的應激,減少HMGB1的釋放和分泌,減弱炎癥級聯反應[21];其次,右美托咪定可能通過刺激α2腎上腺受體亞型增加酪氨酸磷酸化發揮其穩定肺泡巨噬細胞和增加肺泡巨噬細胞可塑性的作用[22],減少細胞破壞,從而減少HMGB1的釋放。HMGB1是人體內非常重要的內源性炎癥介質,被鑒定為核非組蛋白DNA結合蛋白,參與核小體的穩定轉錄的結構和調節。HMGB1從細胞核轉移到胞質,然后被釋放到細胞外空間,在那里它作為一個典型的DAMP,通過與細胞受體結合來控制炎癥功能障礙包括Toll樣受體4(TLR-4)。TLR4是HMGB1的主要受體之一,經過TLR4得到一系列的級聯,包括髓樣分化因子 88(MyD88),是在IRAKs激活后開始的。隨后IKK-α/IKK-β導致 IκB-α磷酸化和退化,最終導致激活NF-κB。有研究證實多氯聯苯29-pQ(PCB29-pQ)激活NLRP3炎性小體,介導Caspase-1活化,進而促進GSDMD的裂解和易位,形成膜孔,促進胞內炎性物質的釋放,最終導致細胞焦亡[23]。有研究提示,HMGB1表達增加能夠正反饋調節NLRP3炎癥小體而加重急性肺損傷[24]。因此右美托咪定減少肺泡巨噬細胞內HMGB1的釋放后降低肺泡巨噬細胞內NLRP3炎癥小體,NLRP3炎性小體抑制procaspase1為Caspase-1裂解,從而下調肺泡巨噬細胞內GSDMD的表達從而抑制肺泡巨噬細胞焦亡,改善OLV引起的急性肺損傷。但是右美托咪定改善肺葉切除術由于OLV所引發的急性肺損傷發生、發展的機制復雜,目前尚不能完全預防,仍需多中心、大樣本探索其發病機制,為臨床預防提供依據。
綜上所述,本研究通過多中心、前瞻性、雙盲、隨機、對照研究發現右美托咪定可通過抑制肺泡巨噬細胞焦亡改善肺葉切除術患者肺組織炎癥反應從而減輕急性肺損傷。

