高良姜的化學成分及細胞毒活性研究
魏晴 魏娜

摘要 [目的]對高良姜(Alpinia officinarum Hance)正丁醇部位的化學成分進行分離純化,并測定化合物的細胞毒活性。[方法]采用硅膠柱色譜、ODS柱色譜、制備和半制備型HPLC法及重結晶等技術手段對高良姜正丁醇萃取部位進行分離純化,利用1H-NMR、13C-NMR、MS等現代波譜技術,結合參考文獻進行結構鑒定。通過MTT法測試分離得到化合物對肝癌細胞、胃癌細胞(3株)和乳腺癌細胞的細胞毒活性。[結果]從高良姜的正丁醇部位分離得到9個化合物,通過現代波譜學技術分別鑒定為:ethyl-β-D-glucopyranoside(1)、2,6-dimethoxy-4- hydroxyphenol-1-O-glucopyranoside(2)、3,5-dimethoxy-4-hydroxy-benzoic acid-7-O-β-D-glucopyranoside(3)、uridine(4)、Staphylionoside D(5)、3-methoxy-4-methyl-benzaldehyde(6)、4-(4′-hydroxy-3′-methoxyphenyl)-phenyl-2-butanone(7)、protocatechuic aldehyde(8)、protocatechuic acid(9)。[結論]從山姜屬中首次分離得到化合物1~4和化合物6,該植物中首次分離得到化合物5、7、8、9。MTT結果顯示化合物1、2、3和6具有微弱的細胞毒活性。
關鍵詞 高良姜;化學成分;結構鑒定;細胞毒活性
中圖分類號 R284.1 ?文獻標識碼 A ?文章編號 0517-6611(2020)21-0179-04
Abstract [Objective]The chemical components of the nbutanol part of Alpinia officinarum were separated and purified, and the cytotoxic activity of the compound was determined. [Method]The silica gel column chromatography, ODS column chromatography, preparative and semipreparative HPLC method and recrystallization were used to separate and purify the extraction part of Alpinia officinarum nbutanol. Refer to the literature for structural identification. The MTT method was used to test the cytotoxic activity of the compound on liver cancer cells, gastric cancer cells (3 strains) and breast cancer cells. [Result]9 compounds were isolated from the nbutanol part of Alpinia officinarum, which were identified as: ethylβDglucopyranoside (1), 2,6dimethoxy4hydroxyphenol1Oglucopyranoside(2), 3,5dimethoxy4hydroxybenzoic acid7OβDglucopyranoside(3), uridine (4), Staphylionoside D(5); 3methoxy4methylbenzaldehyde (6), 4(4′hydroxy3′methoxyphenyl)phenyl2butanone (7), protocatechuic aldehyde(8), protocatechuic acid (9). [Conclusion]Compounds 1 to 4 and 6 are isolated for the first time from Alpinia, and compounds 5, 7, 8, 9 were isolated for the first time in this plant. MTT results showed that compounds 1, 2, 3 and 6 had weak cytotoxic activity.
Key words Alpinia officinarum Hance;Chemical constituents;Structural identification;Cytotoxic activity
基金項目 國家自然科學基金項目(81660649)。
作者簡介 魏晴(1989—),女,黑龍江齊齊哈爾人,講師,博士,從事中藥化學成分與藥效學研究。*通信作者,教授,博士,碩士生導師,從事中藥化學成分與藥效學研究。
收稿日期 2020-05-12;修回日期 2020-06-03
高良姜是姜科山姜屬植物高良姜(Alpinia officinarum Hance)的干燥根莖,別名高涼姜、良姜,性熱、味辛,具有溫胃止吐、散寒止痛之功效,始載于《名醫別錄》,歷版《中國藥典》均有收載[1]。高良姜主產于廣東和海南兩省[2]。高良姜也可用作藥食同源中藥,在食品調味劑及抗氧化劑中也有應用,用于食品保鮮和保質期延長,是十三香的組成之一[3-4]。臨床應用中主要用于治療消化不良、嘔吐、胃潰瘍等消化道系統疾病。現代研究已從高良姜中分離出多種化學成分,主要以揮發油、黃酮類和二芳基庚烷類為主[5-6],且其在抗氧化、抗潰瘍、抑制腫瘤惡性增殖和消炎止痛方面有突出的作用[710]。
魏晴等[11-12]前期通過大孔樹脂法對高良姜中的化學成分進行拆分,并對拆分組分的藥理作用進行研究,發現高良姜有很好的抗潰瘍作用和抗腫瘤作用。但迄今為止,高良姜中大極性成分仍未得到系統全面的研究報道。該研究以高良姜為研究對象,采用95%乙醇進行回流提取并對正丁醇萃取部位進行分離,根據理化性質和核磁波譜進行結構鑒定。
1 材料與方法
1.1 材料
高良姜藥材于2013年1月采于海南省海口市,經黑龍江中醫藥大學藥用植物教研室王振月教授鑒定為姜科(Zingiberaceae)山姜屬(Alpinia)植物高良姜(Alpinia officiniarum Hance)的干燥根莖。原植物標本保存于黑龍江中醫藥大學中藥炮制教研室(HZY2013012237)。
1.2 方法
1.2.1 提取分離。
取高良姜干燥的根莖2.8 kg,用95%乙醇回流提取,提取液減壓濃縮得乙醇提取物120 g。將提取物蒸餾水分散后用正丁醇萃取,減壓濃縮得正丁醇部位浸膏(26 g)。
正丁醇部位浸膏26 g,通過硅膠柱色譜分離,二氯甲烷-甲醇梯度洗脫,最后用甲醇進行洗脫。經過TLC檢查合并相同組分共得到7個組分。組分2經正相硅膠色譜柱用二氯甲烷-甲醇系統梯度洗脫,得到5個組分Fr.2.1~Fr.2.5。Fr.2.1經反相ODS柱分離,以甲醇-水洗脫,接著用半制備HPLC純化,以25%甲醇洗脫,得到化合物2和化合物3。Fr.2.2利用制備型HPLC純化,以25%甲醇洗脫,得到化合物8和化合物9。
組分3經正相硅膠色譜柱用二氯甲烷-甲醇系統梯度洗脫,得到3個組分Fr.3.1~Fr.3.3。進一步Fr.3.2經Sephadex LH-20柱色譜分離,以三氯甲烷-甲醇(1∶1)洗脫,再經半制備HPLC純化,以30%甲醇洗脫,得化合物1和化合物4;組分4經正向硅膠柱色譜分離,以二氯甲烷-甲醇(15∶1~0∶100)洗脫,分為5個組分Fr.4.1~Fr.4.5,組分Fr.4.2經反相ODS柱色譜洗脫,以甲醇-水(9∶1~100∶0)洗脫,接著用半制備HPLC純化,以20%甲醇洗脫,得到化合物5、化合物6和化合物7。
1.2.2 細胞毒活性篩選。
1.2.2.1 供試品和對照品的配制。
將獲得的單體化合物分別用DMSO溶解,然后用RPMI-1640培養液將供試品分別稀釋至不同濃度,陽性藥五氟尿嘧啶也通過RPMI-1640稀釋至0.25 μg/mL。
1.2.2.2 細胞毒活性測試。
細胞毒活性測試參考魏晴等[11]的方法,每組試驗重復3次,結果取平均值。
2 結果與分析
2.1 結構鑒定
根據理化性質和核磁波譜進行結構鑒定,從高良姜的正丁醇部位分離得到9個化合物,其結構如圖1所示,其中糖苷類化合物5個、酚酸類化合物4個。從山姜屬中首次分離得到化合物1~4和化合物6,該植物中首次分離得到化合物5、7、8、9。
2.1.1 化合物1。無色粉末,分離得到9.3 mg,易溶于甲醇;電噴霧電離質譜ESI-MS:m/z 209.09[M+H]+;分子式為C8H16O6;1H-NMR(CD3OD,400 MHz),δH:4.25(1H,d,J=7.8 Hz,H-1),3.85(1H,dd,J=3.0,12.0 Hz,H-6a),3.62(1H,dd,J=4.8,12.0 Hz,H-6b),3.35(1H,m,H-5),3.33(1H,m,H-3),3.28(1H,m,H-4),3.18(1H,m,H-2),3.95(2H,m,H-1′),1.24(3H,t,J=7.4 Hz,H-2′);13C-NMR(CD3OD,100 MHz)δC:104.2(C-1),78.3(C-5),78.0(C-3),75.2(C-2),71.8(C-4),66.3(C-1′),62.9(C-6),15.6(C-2′)。以上數據與文獻[13]報道的ethyl-β-D-glucopyranoside一致,故確定該化合物為ethyl-β-D-glucopyranoside。
2.1.2 化合物2。白色粉末,分離得到10.0 mg,易溶于甲醇;ESI-MS:m/z 333.11[M+H]+;分子式為C14H20O9;1H-NMR(CD3OD,400 MHz),δH:6.17(2H,s,H-3,H-5),4.68(1H,d,J=7.6 Hz,H-1′),3.48-3.85(6H,m,H-2′~H-6′),3.82(6H,s,H-2-OCH3);13C-NMR(CD3OD,100 MHz),δC:156.1(C-4),152.9(C-2,C-6),129.6(C-1),106.4(C-1′),94.8(C-3,C-5),78.4(C-5′),78.1(C-3′),75.3(C-2′),71.5(C-4′),62.8(C-6′),57.0(C-2-OCH3,C-6-OCH3)。以上數據與文獻[14]報道的2,6-dimethoxy-4- hydroxyphenol-1-O-glucopyranoside一致,故確定該化合物為2,6-dimethoxy-4- hydroxyphenol-1-O-glucopyranoside。
2.1.3 化合物3。無色針狀結晶,分離得到9.5 mg,易溶于甲醇;ESI-MS:m/z 361.11[M+H]+;分子式為C15H20O10;1H-NMR(CD3OD,400 MHz),δH:7.40(2H,s,H-2,H-6),5.70(1H,d,J=7.72 Hz,H-1′),3.90(6H,s,H-3-OCH 3,H-5-OCH3),3.88(1H,dd,J=3.2,12.0Hz,H-6a′),3.67(1H,dd,J=4.8,12.0 Hz,H-6b′),3.44-3.85(4H,m,H-2′~H-5′);13C-NMR(CD3OD,100 MHz),δC:166.9(C=O),149.1(C-3,C-5),142.8(C-4),120.9(C-1),108.9(C-2,C-6),57.1(C-3-OCH3,C-5-OCH3),96.4(C-1′),79.0(C-5′),78.3(C-3′),74.2(C-2′),71.3(C-4′),62.5(C-6′)。以上數據與文獻[15]報道的3,5-dimethoxy-4-hydroxy-benzoic acid-7-O-β-D-glucopyranoside一致,故確定該化合物為3,5-dimethoxy-4-hydroxy-benzoic acid-7-O-β-D-glucopyranoside。
2.1.4
化合物4。無色針狀結晶,分離得到8.7 mg,易溶于甲醇和水;ESI-MS:m/z 276.10[M+H]+;分子式為C9H12N2O6;1H-NMR(CD3OD,400 MHz),δH:8.00(1H,d,J=8.0 Hz,H-6),5.90(1H,d,J=4.6 Hz,H-1′),5.70(1H,d,J=8.0 Hz,H-5),4.19(1H,m,H-3′),4.17(1H,m,H-2′),4.02(1H,m,H-4′),3.88(2H,m,H-5′);13C-NMR(CD3OD,100 MHz),δC:166.3(C-4),152.6(C-2),142.9(C-6),102.8(C-5),90.9(C-1′),86.5(C-4′),75.8(C-3′),71.4(C-2′),62.9(C-5′)。以上數據與文獻[16]報道的Uridine一致,故確定該化合物為Uridine。
2.1.5
化合物5。白色粉末,分離得到10.9 mg,易溶于甲醇;ESI-MS:m/z 387.19[M+H]+;分子式為C19H30O8;1H-NMR(CD3OD,400 MHz),δH:5.83(1H,s,H-8),4.45(1H,d,J=7.8 Hz,H-1′),4.35(1H,d,J=13.0 Hz,H-3),3.88(1H,dd,J=3.2,12.0 Hz,H-6a′),3.67(1H,dd,J=4.8,12.0 Hz,H-6b′),3.16(1H,m,H-2′),2.38(1H,m,H-4),2.19(3H,s,H-10),2.10(1H,m,H-2),1.47(1H,m,H-2),1.46(1H,m,H-4),1.39(3H,s,H-13),1.38(3H,s,H-11),1.16(3H,s,H-12);13C-NMR(CD3OD,100 MHz),δC:211.6(C-9),201.0(C-7),120.2(C-6),102.9(C-1′),101.3(C-8),78.4(C-5′),78.1(C-3′),75.3(C-2′),72.7(C-3),72.5(C-5),71.5(C-4′),62.8(C-6′),48.2(C-4),46.8(C-2),37.2(C-1),32.4(C-12),31.0(C-13),29.6(C-11),26.7(C-10)。以上數據與文獻[17]報道的Staphylionoside D一致,故確定該化合物為Staphylionoside D。
2.1.6
化合物6。無色針狀結晶,分離得到8.6 mg,易溶于甲醇和水,ESI-MS:m/z 151.07[M+H]+;分子式為C9H10O2;1H-NMR(DMSO-d6,400 MHz),δH:9.77(1H,s,H-1-CHO),7.51(1H,dd,J=1.9,8.2 Hz,H-6),7.43(1H,d,J=1.8 Hz,H-2),6.88(1H,d,J=8.2 Hz,H-5),3.82(3H,s,H-3-OCH3),2.49(3H,s,H-4-CH3);13C-NMR(DMSO-d6,100 MHz),δC:196.0(C=O),151.6(C-3),147.5(C-1),128.8(C-5),123.3(C-4),114.9(C-6),111.2(C-2),55.6(C-3-OCH3),26.1(C-4-CH3)。以上數據與文獻[18]報道的3-methoxy-4-methyl-benzaldehyde一致,故確定該化合物為3-methoxy-4-methyl-benzaldehyde。
2.1.7
化合物7。白色粉末,分離得到9.3 mg,易溶于甲醇;ESI-MS:m/z 195.09[M+H]+;分子式為C11H14O3;1H-NMR(DMSO-d6,400 MHz),δH:6.75(1H,d,J=1.9 Hz,H-2′),6.64(1H,d,J=8.0 Hz,H-6′),6.55(1H,dd,J=2.0,8.0 Hz,H-5′),3.80(3H,s,H-3′-OCH3),2.70(4H,m,H-3,H-4),2.08(3H,s,H-1);13C-NMR(DMSO-d6,100 MHz),δC:207.8(C-2),147.3(C-3′),144.5(C-4′),131.8(C-1′),120.2(C-6′),115.2(C-5′),112.5(C-2′),55.6(C-3′-OCH3),44.5(C-3),29.7(C-4),28.7(C-1)。以上數據與文獻[19]報道的4-(4′-hydroxy-3′-methoxypheyl)-phenyl-2-butanone一致,故確定該化合物為4-(4′-hydroxy-3′-methoxypheyl)-phenyl-2-butanone。
2.1.8
化合物8。黃色粉末,分離得到8.2 mg,易溶于甲醇;ESI-MS:m/z 139.03[M+H]+;分子式為C7H6O3;1H-NMR(DMSO-d6,400 MHz),δH:9.71(1H,s,H-1-CHO),7.26(1H,dd,J=2.0,8.0 Hz,H-6),7.24(1H,d,J=2.0 Hz,H-2),6.91(1H,d,J=8.0 Hz,H-5);13C-NMR(DMSO-d6,100 MHz),δC:190.7(C=O),151.8(C-4),145.3(C-3),128.5(C-1),124.0(C-6),115.2(C-5),114.1(C-2)。以上數據與文獻[20]報道的原兒茶醛(protocatechuic aldehyde)一致,故確定該化合物為原兒茶醛(protocatechuic aldehyde)。
2.1.9
化合物9。白色粉末,分離得到13.1 mg,易溶于甲醇;ESI-MS:m/z 155.03[M+H]+;分子式為C7H6O4;1H-NMR(DMSO-d6,400 MHz),δH:9.63(1H,s,H-3-OH),9.25(1H,s,H-4-OH),7.37(1H,dd,J=2.0,8.0 Hz,H-6),7.31(1H,d,J=2.0 Hz,H-2),6.81(1H,d,J=8.0 Hz,H-5);13C-NMR(DMSO-d6,100 MHz),δC:167.0(-COOH),149.7(C-4),144.6(C-3),121.7(C-1),121.5(C-6),116.3(C-5),114.9(C-2)。以上數據與文獻[21]報道的原兒茶酸(protocatechuic acid)一致,故確定該化合物為原兒茶酸(protocatechuic acid)。
2.2 細胞毒活性
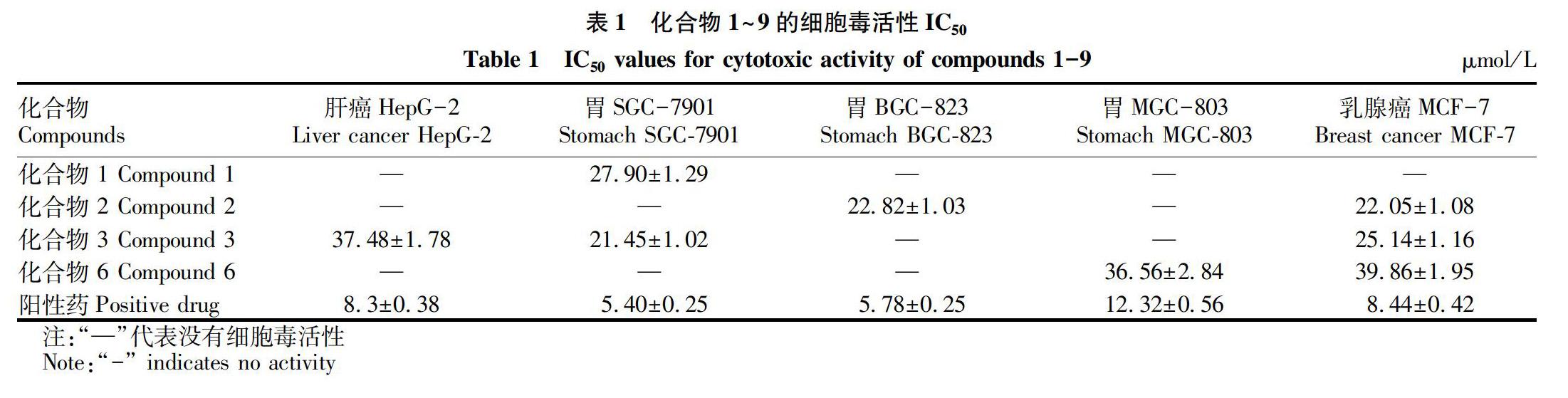
從表1可以看出,化合物3對肝癌細胞HepG-2具有微弱的細胞毒活性,化合物2對胃癌細胞BGC-823有微弱的細胞毒活性,化合物1和化合物3對胃癌細胞SGC-7901具有微弱的細胞毒活性,化合物6對胃癌細胞MGC-803具有微弱的細胞毒抑制作用,化合物2和化合物3對乳腺癌細胞MCF-7具有微弱的細胞毒抑制作用。
3 討論與結論
高良姜現代臨床主要用于胃痛、胃炎、胃潰瘍及胃癌等疾病的治療,是治療胃潰瘍的常用藥之一。目前對高良姜化學成分研究主要集中在黃酮和二芳基庚烷類,對其他類型成分研究較少。該研究從高良姜正丁醇共分離并鑒定出9個化合物,包括糖苷類化合物5個:ethyl-β-D-glucopyranoside(1)、2、6-dimethoxy-4-hydroxyphenol-1-O-glucopyranoside(2)、3,5-dimethoxy-4-hydroxy-benzoic acid-7-O-β-D-glucopyranoside(3)、uridine(4)、Staphylionoside D(5);酚酸類化合物4個:3-methoxy-4-methyl-benzaldehyde(6)、4-(4′-hydroxy-3′-methoxyphenyl)-phenyl-2-butanone(7)、protocatechuic aldehyde(8)、protocatechuic acid(9)。從山姜屬中首次分離得到化合物1~4和化合物6,該植物中首次分離得到化合物5、7、8、9。該研究豐富了高良姜化學成分的信息,也為藥理學及質量控制研究奠定了物質基礎。
參考文獻
[1]國家藥典委員會.中華人民共和國藥典:一部[S].北京:中國醫藥科技出版社,2015:287.
[2]楊全,嚴寒靜,龐玉新,等.南藥高良姜藥用植物資源調查研究[J].廣東藥學院學報,2012,28(4):382-386.
[3]潘坤,高炳淼,王阿超,等.基于ISSR標記的海南高良姜種質資源遺傳多樣性分析[J].分子植物育種,2016,14(8):2224-2231.
[4]胡佳惠,閆明.高良姜的研究進展[J].時珍國醫國藥,2009,20(10):2544-2546.
[5]LU W,JIANG L H.Chemical constituents and pharmacological activities of Alpinia officinarum Hance[J].China pharmaceuticals,2006,15(3):19-21.
[6]李洪福,李永輝,王勇,等.高良姜化學成分及藥理活性的研究[J].中國實驗方劑學雜志,2014,20(7):236-244.
[7]鄒俊波,張小飛,邰佳,等.水蒸氣蒸餾法提取高良姜揮發油類成分提取動力學研究[J].中國中藥雜志,2018,43(21):4231-4239.
[8]高振虎,陳艷芬,楊全,等.南藥高良姜的研究進展[J].廣東藥學院學報,2016,32(6):817-821.
[9]馬小妮.高良姜化學成分及其抗癌活性研究[D].廣州:廣東藥科大學,2016.
[10]TABATA K,YAMAZAKI Y,OKADA M,et al.Diarylheptanoids derived from Alpinia officinarum induce apoptosis,Sphase arrest and differentiation in human neuroblastoma cells[J].Anticancer research,2009,29(12):4981-4988.
[11]魏晴,魏娜,王秋紅.高良姜抗腫瘤活性部位篩選[J].時珍國醫國藥,2015,26(7):1621-1622.
[12]魏娜,譚銀豐,魏晴,等.高良姜不同提取部位對實驗性胃潰瘍的影響及作用機理研究[J].海南醫學院學報,2015,21(2):158-160.
[13]王興娜,杜建廠,譚仁祥,等.擔子菌黃卷緣齒菌的化學成分[J].中草藥,2005,36(8):1126-1130.
[14]WU Z J,OUYANG M A,WANG S B.Two new phenolic watersoluble constituents from branch bark of Davidia involucrata[J].Natural product research,2008,22(6):483-488.
[15]董禮,李磊,廖志華,等.柴胡紅景天化學成分的研究[J].西北植物學報,2007,27(12):2564-2567.
[16]魏華,何春年,彭勇,等.川木香化學成分研究[J].中國中藥雜志,2012,37(9):1249-1253.
[17]QIAN Y,MATSUNAMI K,OTSUKA H,et al.Staphylionosides AK:Megastigmane glucosides from the leaves of Staphylea bumalda DC.[J].Chemical pharmaceutical bulletin,2005,53(7):800-807.
[18]鄭健,趙東升,吳斌,等.留蘭香中化學成分的分離與鑒定[J].中國中藥雜志,2002,27(10):749-751.
[19]FENG W S,ZHENG X K,WANG Y Z,et al.Isolation and structure identification of the chemical constituents from pine needles of Pinus massoniana Lamb.[J].Acta pharmaceutica sinica,2004,39:190-193.
[20]張倩,康文藝.芭蕉根活性成分研究[J].中國中藥雜志,2010,35(18):2424-2427.
[21]孫連娜,洪永福.中藥木瓜的化學成分研究[J].中國藥學:英文版,2000,9(1):6-9.

