代謝綜合征及其組分對胰腺癌患者預后的影響
陳 歡, 李 婷, 王紫潔, 王忠瓊, 羅 剛, 鄧明明
西南醫科大學附屬醫院 消化內科, 四川 瀘州 646000
胰腺癌患者病死率居全球癌性致死率第12位[1],其在美國地區的癌癥死亡占比已超過結腸癌,上升到第4位[2]。胰腺癌的治療方法正在不斷更新,但這并未顯著降低患者的病死率[3]。不僅因為胰腺癌具有很強的侵襲性,還有一個重要原因是大部分患者在確診時已經是胰腺癌晚期[4]。如何預防胰腺癌的發展和改善其預后尚未得到很好的解決。前期研究[5-6]探討了許多與胰腺癌相關的危險因素,包括遺傳、ABO血型、吸煙、飲酒、慢性胰腺炎、肥胖癥、糖尿病等,然而并非以上所有因素都與預后有關。
代謝綜合征(metabolic syndrome,MS)是以肥胖、高血糖、高血壓、高血脂等為主要表現的癥候群[7]。MS已經成為一種全球范圍內的公共衛生挑戰,其患病率在我國已高達19.58%[8]。研究[9-11]表明,MS與較晚的腫瘤分期有關,甚至可能降低癌癥患者的生存率。胰腺是人體代謝中必不可少的腺體,當胰腺細胞不受控制的生長和分裂并形成腫瘤時,胰腺的內、外分泌功能就會受損,自然會伴隨著代謝異常。近年來,MS與胰腺癌患者預后之間關系的研究有所增加,但是仍然有爭議[12-14]。
關于MS對胰腺癌患者預后影響的研究眾多,但幾乎所有的研究都包含有接受了抗癌治療的患者。本研究選擇了完全未經抗瘤治療的胰腺癌患者,對其病歷資料和健康檢查報告及個人史進行回顧性分析,旨在探討MS與胰腺癌自然病程預后的關系。
1 方法
1.1 研究對象 選取2013年8月-2018年11月在本院經病理組織學證實診斷為胰腺癌的患者。排除標準:(1)病史數據不完整;(2)隨訪失敗或隨訪不到1年且無臨床結果;(3)無法TNM分期;(4)接受了抗癌治療的患者,包括手術、放化療、生物制劑、基因治療和免疫治療等。
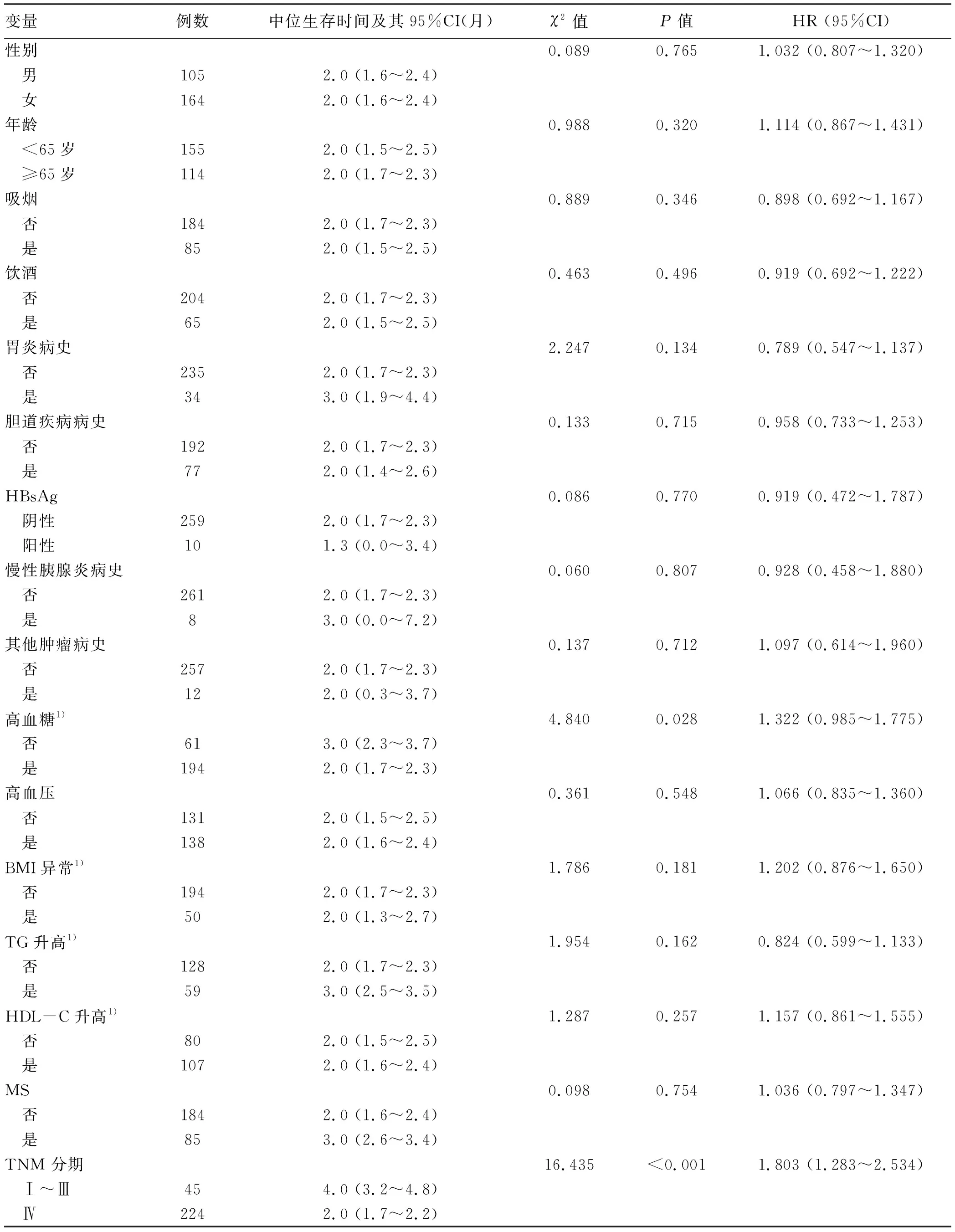
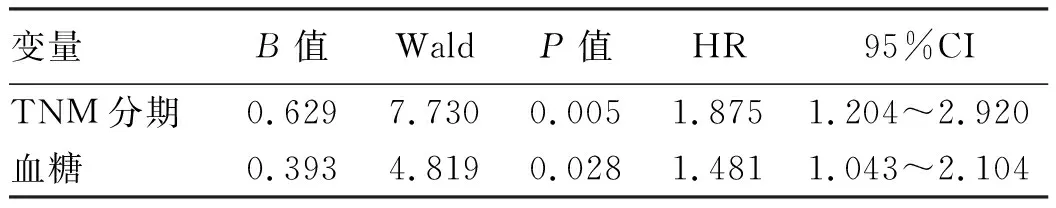
1.2 MS診斷標準 (1)腹型肥胖(即中心型肥胖):男性腰圍≥ 90 cm,女性≥85 cm;(2)高血糖:空腹血糖≥6.1 mmol/L或糖負荷后2 h血糖≥7.8 mmol/L,和/或已確診為糖尿病并治療者;(3)高血壓:血壓≥130/85 mm Hg和/或已確診為高血壓并治療者;(4)空腹甘油三酯(TG)≥1.70 mmol/L;(5)空腹高密度脂蛋白膽固醇(HDL-C)男性<0.9 mmol/L、女性 1.3 肥胖診斷標準 以BMI作為判定是否肥胖的標準。判斷標準為:BMI<18.5 kg/m2為體質量過低,18.5 kg/m2≤BMI<24 kg/m2為正常體質量,24 kg/m2≤BMI<28 kg/m2為超重,BMI≥28.0 kg/m2為肥胖。研究[17]發現,在BMI≥25 kg/m2中國人群中,男性腰圍約為90 cm,女性約為 85 cm,故將BMI≥25 kg/m2代替MS診斷標準中的腰圍。 1.4 觀察指標 由兩名經過培訓且具有醫學背景的人員使用既定的信息表提取臨床信息。收集的資料包括:年齡、性別、體質量、身高、BMI、吸煙、飲酒、慢性胰腺炎病史、膽道疾病和胃炎病史、慢性乙型/丙型肝炎病史、其他癌癥病史、一級親屬患胰腺癌、血糖、血壓、HDL-C、TG水平、MS以及TNM分期[18]。隨訪信息通過電話及門診隨訪記錄獲得。主要結果變量為總體生存時間,即從患者診斷到死亡的時間段。 1.5 倫理學審查 本研究獲得西南醫科大學附屬醫院臨床試驗倫理委員會批準,批號:KY2020051。所有患者均簽署知情同意書。 1.6 統計學方法 本研究采用Epidata進行數據錄入,采用SPSS 20.0進行數據分析。符合正態分布的計量資料以表示,不符合正態分布的計量資料以M(P25~P75)表示。生存時間采用中位生存時間及其95%CI進行統計描述,采用log-rank檢驗比較各組生存曲線間是否有差異,采用單因素Cox回歸模型和多因素Cox回歸模型分析生存期的影響因素。P<0.05為差異有統計學意義。 2.1 一般資料 2013年-2018年本院診斷為胰腺癌的患者共1080例,符合納入標準的269例,其中男105例,女164例。平均年齡(67.98±11.42)歲,中位年齡68歲。其中,85例有吸煙史(占31.6%),65例有飲酒史(占24.2%),有胃炎或膽道疾病的患者分別為34例(占12.6%)和77例(占28.6%),8例有慢性胰腺炎病史(占3%),12例有其他腫瘤史(占4.5%),僅有2例一級家屬中有胰腺癌病史(占0.7%),有慢性乙型/丙型肝炎病史者分別為10例(占3.7%)和1例(占0.4%)。在明確胰腺癌的診斷時,224例已為Ⅳ期,138例合并有高血壓,136例存在高血糖,所有患者平均基線BMI為22.23 kg/m2,其中35例體質量過低,39例超重,50例肥胖。 2.2 生存時間及其影響因素分析 269例胰腺癌患者中,僅1例在研究截止時間尚存活。所有患者的平均生存時間為3.22個月,中位生存時間2(1~4)個月。如表1所示,Ⅰ~Ⅲ期患者和Ⅳ期患者中位生存時間差異具有統計學意義(HR=1.803,95%CI:1.283~2.534,P<0.001)(圖1)。高血糖患者與無高血糖患者中位生存時間差異亦具有統計學意義(HR=1.322,95%CI:0.985~1.775,P=0.028)(圖2)。年齡、性別、吸煙或飲酒、慢性胰腺炎病史、其他癌癥病史、胰腺癌家族史、胃炎和膽道疾病病史對中位生存時間無明顯影響(P值均>0.05)。有無高血壓、高TG、高HDL-C或BMI異常的患者之間的中位生存時間差異無統計學意義(P值均>0.05)。合并MS患者的中位生存時間似乎比沒有MS患者的中位生存時間有增多趨勢,但差異無統計學意義(P=0.754)。 表1 269例胰腺癌患者生存時間相關因素的單因素Cox回歸分析 單獨對Ⅳ期患者的生存時間影響因素進行分析(表2),結果與前述結果一致,僅有高血糖對患者的中位生存時間有影響(HR=1.473,95%CI:1.073~2.024,P=0.004)(圖3)。將表1、2中差異有統計學意義的變量納入多因素Cox風險回歸模型中,結果顯示,影響預后的危險因素為TNM分期和血糖(表3、4)。 表3 269例胰腺癌患者的多因素Cox回歸分析 表4 224例Ⅳ期胰腺癌患者的多因素Cox回歸分析 在本研究中,83.3%的病例在診斷胰腺癌時處于晚期,平均年齡為68歲,且未經治療的胰腺癌患者病死率(99.6%)接近100%,與既往研究[19]一致。本研究通過單因素和多因素分析發現,較晚TNM分期和血糖升高的胰腺癌患者生存期更短。 腫瘤局限于器官的患者生存率要高于腫瘤超出器官生長的患者——TNM分期系統主要根據這一公認的事實對腫瘤進行分期:不僅反映了新生物的生長速度和范圍,還反映出腫瘤分型和宿主與腫瘤的關系。普遍認為,腫瘤TNM分期越晚的患者預后越差,這在本研究中得以證實——TNM分期晚的胰腺癌患者,其生存期更短。然而,一項多中心隊列研究[20]表明,修訂的T期與生存率相關性很低;Li等[21]報道ⅠB和ⅡA期患者的生存時間無顯著差異。這些結果可能與樣本量小,缺乏病理評估標準以及不同治療方案的干預有關。 既往研究[22]表明,MS與消化系統惡性腫瘤密切相關,包括胃癌、結腸癌、膽管癌和胰腺癌。惡性腫瘤是一種消耗性疾病,它獨特的能量獲取途徑——糖酵解可進一步加劇能量的浪費。惡性腫瘤患者往往快速消耗脂肪和蛋白質,使其處于代謝異常狀態。另外,胰腺癌患者往往會出現胰腺外分泌功能障礙,尤其是在慢性胰腺炎患者中,并且85%胰腺癌為腺癌,其分泌功能異常可能進一步加重代謝紊亂[23-24]。這可能是胰腺癌患者容易出現代謝異常的部分原因,而不同程度的代謝異常將在胰腺癌的發展中發揮作用。因此,胰腺癌和代謝綜合征可能是兩個相互影響、相互促進的過程。 Zhou等[25]研究發現,高血糖會導致癌癥死亡率線性增加,本研究得到了類似的結果——高血糖可能與胰腺癌患者的生存時間縮短有關。一方面,腫瘤組織對胰島的破壞和胰管的阻塞可能導致患者葡萄糖耐量降低,而胰腺癌也可能通過產生淀粉樣蛋白肽島而降低胰島素敏感性,從而導致糖尿病[26]。另一方面,糖尿病可以通過多種機制加速胰腺癌的發展。首先,胰島素抵抗會導致高胰島素血癥,后者的促有絲分裂活性將促進腫瘤的發展[27]。其次,除了為腫瘤細胞提供能量,過量的葡萄糖能促進氧化應激,而后者可通過不同的途徑造成DNA損傷,從而導致原癌基因突變[28]。第三,糖尿病是一種低度慢性炎癥性疾病,這種狀態有利于腫瘤細胞的增殖[29]。 曾有報道[30]脂肪酸代謝是胰腺癌的標志。脂肪酸代謝紊亂很容易導致高脂血癥,從而影響糖酵解途徑并引起高血糖癥[31]。脂肪酸還可引起線粒體活性氧的產生,導致 DNA破壞和原癌基因突變[32]。低密度脂蛋白膽固醇(LDL-C)在各種病理條件下更容易被氧化,從而在氧化應激期間導致較高的脂質過氧化[33]。載脂蛋白A是HDL顆粒的主要成分,可以降低游離TNFα的水平并導致腫瘤形成受到抑制[34]。然而,在高脂血癥中HDL明顯降低、LDL升高,意味著對腫瘤的抑制作用減弱、促進作用增加。 表2 224例Ⅳ期胰腺癌患者生存時間相關因素的單因素Cox回歸分析 研究[35]報道,肥胖是包括胰腺癌在內的惡性腫瘤的不良預后因素。首先,過量的脂肪組織及其功能障礙導致胰島素抵抗和高胰島素血癥。其次,脂肪細胞可以分泌瘦素,而后者可通過影響上皮-間質轉化、細胞黏附和細胞外基質蛋白的水解等過程增加腫瘤侵襲性,促進轉移[36]。體質量減輕是胰腺癌患者的常見臨床表現,Dalal等[37]認為體質量、骨骼肌和內臟脂肪組織減輕較多的患者生存時間更短。但Jiang等[6]對胰腺癌患者不同時期的BMI進行分析仍未發現其對患者生存的影響。遺憾的是,本研究未能收集到患者患病前的BMI并對其進行分析。 還有學者[38]提出高血壓與癌癥相關。作為MS的一部分,高血壓可能通過影響其他MS成分而影響腫瘤細胞。目前關于高血壓與胰腺癌的相關性研究較少,胰腺神經內分泌腫瘤分泌促腎上腺皮質激素導致血壓不穩定,但這種情況非常罕見。Gong等[39]研究表明,與心血管疾病有關的基因——GATA4可能通過上調P53基因的表達而對胰腺癌細胞的增殖和分化起抑制作用。 從以上分析似乎可以得出結論,MS各組分與胰腺癌患者預后不良有關。然而,在本研究結果中除了高血糖外,MS或其他組分異常都沒有對胰腺癌患者的預后產生明顯的不良影響,可能的原因如下:首先,MS是一個可變因素,可以通過飲食、鍛煉和改變生活方式來改善;其次,患者的代謝指標可能相對于自己的基線值發生了變化,但由于它們的臨床標準范圍很廣而未被判斷為異常;細微代謝變化的統計力可能被病理分期和分化程度等因素減弱;此外,本研究中大多數受試者都是晚期患者,生存期太短,無法充分觀察到代謝異常對其預后的影響。 筆者回顧了既往文獻[40-43]報道的其他可能影響胰腺癌發病和預后的因素,如吸煙、飲酒、慢性胰腺炎、消化系統微生態失調等,結果表明這些因素均未顯著影響患者的生存時間。 本研究的優點體現在以下幾方面:(1)納入的所有患者均未行抗癌治療,結果更有意義;(2)收集了多個可能為危險因素的指標,分別進行單因素及多因素分析;(3)為了排除TNM分期對結果的影響,對Ⅳ期患者進行了單獨分析,得到的結果與之前一致。本研究尚存在一定局限性:(1)本研究為回顧性研究,具有選擇偏倚和其他潛在偏倚;(2)電話隨訪的失訪率較高;(3)研究對象多為Ⅳ期患者;(4)研究對象集中于西南地區;(5)沒有分析不同病理類型對預后的影響。 總之,本研究通過對未抗癌治療的胰腺癌患者進行生存分析表明,TNM分期及血糖升高與患者的生存時間有關,且高血糖與晚期患者較短的生存期有關,BMI及血脂異常、高血壓等對其影響不明顯。這些結果需要更多的前瞻性臨床試驗進行進一步驗證。 利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突,特此聲明。 作者貢獻聲明:陳歡負責課題設計,資料分析,撰寫論文;李婷、王紫潔、王忠瓊參與收集數據,統計分析;羅剛提供資金支持,并負責擬定寫作思路;鄧明明指導撰寫文章并最后定稿。2 結果

3 討論