論建模思想下的高中化學解題技巧
王 燕
(福建省莆田華僑中學 351115)
化學模型是對現實化學過程的抽象.解題教學中注重建模思想的應用講解,使學生體會運用建模思想解題的具體過程,對深化學生理解,提高學生的解題水平與解題能力具有重要意義.
一、運用晶體模型思想解題
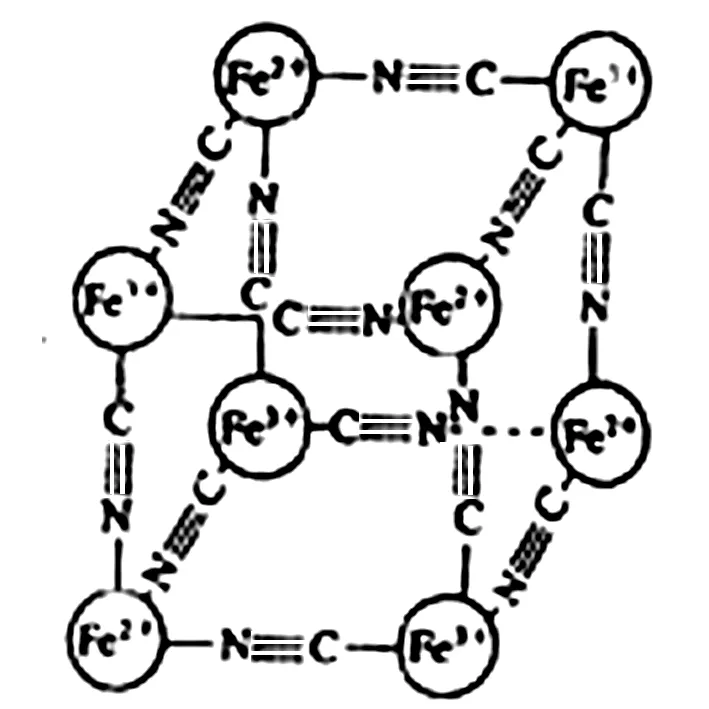
圖1
例1分析化學常用X射線研究晶體結構,有一種藍色晶體可表示為:[MxFey(CN)z],研究表明它的結構特性是Fe2+、Fe3+分別占據立方體的頂點,自身互不相鄰,而CN-位于立方體的棱上,其晶體中的陰離子晶胞結構如圖1所示,下列說法正確的是( ).
A.該晶體屬于原子晶體
B.M的離子位于上述立方體的面心,呈+2價
C.M的離子位于上述立方體的體心,呈+1價
D.晶體的化學式為MFe2(CN)6,且M為+1價
解析A項該結構中存在陰、陽離子,因此,為離子晶體,錯誤.B項,由晶體結構模型可知,Fe2+、Fe3+分別占據立方體的頂點,其對應的個數為4×1/8=1/2,CN-位于立方體的棱上對應的個數為12×1/4=3,因此,M、Fe、CN-的個數比為x∶2∶6,則x+2+3=6,即,x=1,則該晶體的化學式為MFe2(CN)6,且M為+1價,錯誤.因為鐵離子與亞鐵離子的個數為4×1/8=1/2,相當于2個晶胞擁有1個M+,C項錯誤.經上述分析可知D項正確.答案為D.
解題技巧點撥回顧晶體模型,正確運用分攤法計算晶胞中含有的原子個數是解題的關鍵.
二、運用核外電子排布模型解題
例2科學研究表明:核外電子的能量不僅與電子所處的能層、能級有關,還與核外電子數目及核電荷數有關.氬原子與硫離子的核外電子排布相同(1s22s22p63s23p6).下列說法正確的是( ).
A.兩粒子的1s能級上的電子能量相同
B.兩粒子的3p能級上的電子離核的距離相同
C.兩粒子的電子發生躍遷時,產生的光譜不同
D.兩粒子都達8電子穩定結構,化學性質相同
解析由核外電子排布模型可知,A項,盡管具有相同的電子數,但核電荷數并不相同,因此電子能量并不相同.B項,在3p能級上,氬原子具有較大的核電荷數,對電子吸引力較大,因此,和原子核的距離較近,錯誤.C項,電子具有的能量不同,發生躍遷時產生的光譜不同,C項正確.D項,硫離子得到電子形成8電子穩定結構,但其失電子能力較強,兩者的還原性并不同,D項錯誤.
解題技巧點撥準確把握核外電子排布模型中能量、數量規律是解題的關鍵,即,離核由近到遠,電子能力由低到高.每層最多容納2n2個電子,最外層不超過8個,第一層為最外層時不超過2個.
三、運用原電池模型思想解題
例3科學家發明了一種新型可控電池-鋰水電池,工作原理如圖2所示,以下說法錯誤的是( ).
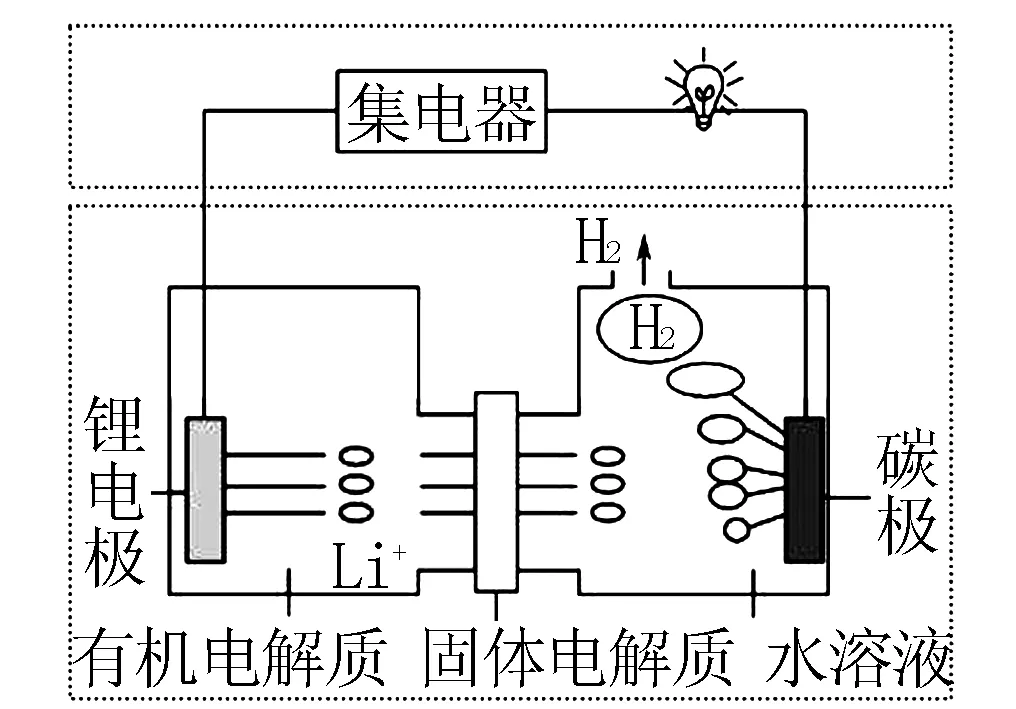
圖2

B.有機電解質和水溶液不可以互換區域
C.標準狀況下產生22.4L的氫氣時正極消耗鋰的質量為14g
D.該裝置不僅可提供電能,還可得到清潔的氫氣

解題技巧點撥原電池中發生的化學反應屬于氧化還原反應,因此,認真觀察圖中內容,根據生成物,準確的判斷正、負極,并根據電極反應方程式進行相關量的計算.
四、運用溶解平衡模型解題
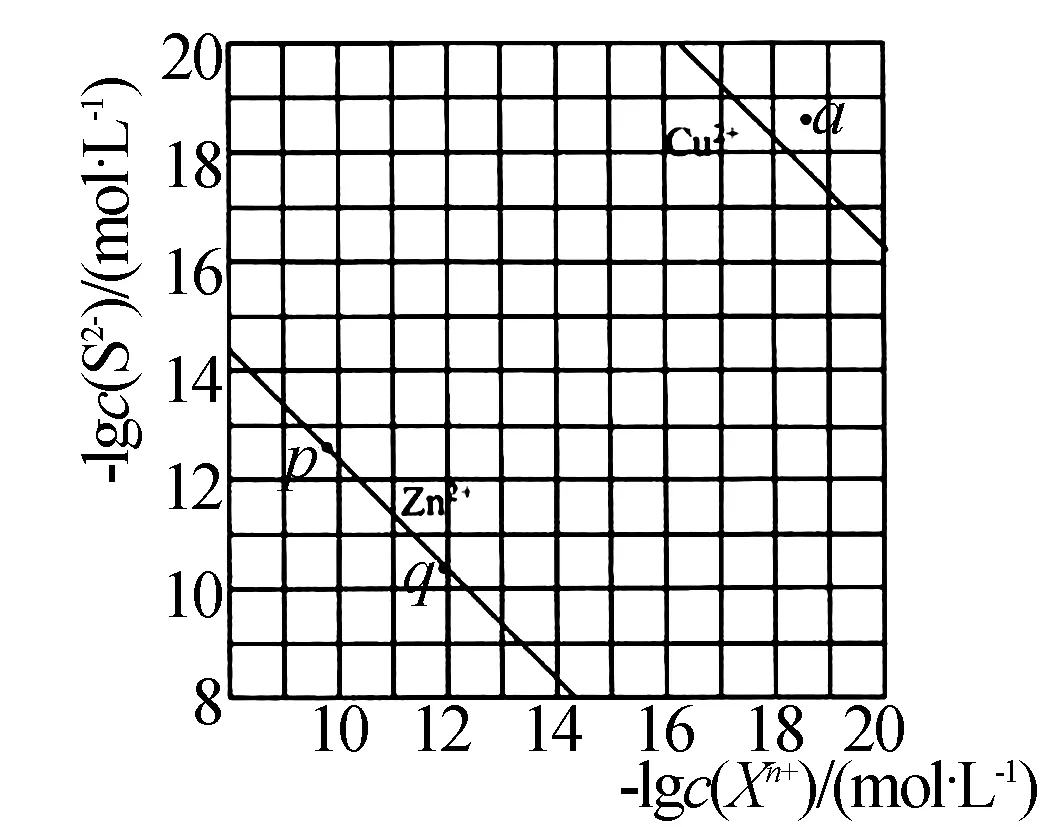
圖3
例4 向廢水中加入硫化物可依次獲得CuS、ZnS納米粒子.常溫下,H2S的Ka1=1.3×10-7,Ka2=7.1×10-15,溶液中平衡時離子濃度關系如圖3所示,以下說法錯誤的是( ).
A.Ksp(CuS)的數量級為10-37
B.a點對應的CuS溶液為不飽和溶液
C.向p點的溶液中加入少量NaS固體,溶液組成由p向q方向移動

解析根據溶解平衡模型以及圖中內容可知,當c(Cu2+)=10-18mol/L時,c(S2-)=10-18.3,則Ksp(CuS)=c(Cu2+)×c(S2-)=10-36.3,數量級為10-37,A項正確.由A項可知,在a點的離子積濃度為10-37 解題技巧點撥認真審題,理解橫軸與縱軸表示的含義.通過準確計算離子積濃度判斷溶液是否達到飽和.根據溶解平衡常數計算結果判斷化學反應進行的程度. 高中化學解題中運用建模思想可使學生少走彎路,提高解題效率,因此教學中應提高認識,做好高中化學常見模型知識的講解與歸納,并為學生展示如何運用建模思想解答相關的化學習題,使其掌握運用建模思想解題的思路以及細節,提高其建模思想應用意識,指引其以后更好的解題.

