建立模板 突破酸堿溶液混合難題
——一道鹽酸與氨水混合圖像題解答
李傳雄
(廣東省深圳外國語學校 518083)
選擇性必修課程《化學反應原理》,主題3“水溶液中的離子反應與平衡”,研究什么呢?研究電解質(zhì)溶液,即酸、堿、鹽溶液.因為酸、堿、鹽不是孤立的物質(zhì),之間相互關聯(lián)、相互反應,反應有“酸+堿=鹽+水”、“酸+鹽=酸+鹽”、“堿+鹽=堿+鹽”等,而且,酸有強酸、弱酸,堿有強堿、弱堿,所以學生學習該主題時,總是理不清頭緒.我用一個模板理順全部內(nèi)容,并以此為基礎解答習題,收到事半功倍的效果.
一、建立模板——“酸+堿=鹽+水”
《化學反應原理》主題3“水溶液中的離子反應與平衡”,內(nèi)容雖多,但規(guī)律性強,若用“酸+堿=鹽+水”表示,就足以概括該主題.課堂上,教師引導,學生討論完成,建立如下模板一,分析鹽酸與氨水溶液混合變化過程,討論五種情況:①鹽酸溶液;②鹽酸與氨水恰好反應;③鹽酸與氨水混合,恰好呈中性;④等物質(zhì)的量氯化銨與氨水混合;⑤氨水溶液.抓住“靜態(tài)”五個支點就能輕松分析鹽酸與氨水混合的“動態(tài)”變化過程.模板是“開放”的,學生既可以根據(jù)自己的理解補充內(nèi)容,也可以對某些很熟練知識簡化、去掉一部分內(nèi)容.
模板一 鹽酸與氨水混合情況分析
支點一:HCl溶液,未加NH3·H2O
①c(H+)=c(HCl),c(OH-)=Kw/c(H+)
②溶液中的電荷守恒式:
c(H+)=c(Cl-)+c(OH-)
③溶液呈酸性,pH<7
④溶液中離子濃度大小比較:
c(H+)>c(Cl-)>c(OH-)
……
支點二:HCl與NH3·H2O恰好反應
①兩者恰好完全反應,既無HCl剩余,也無NH3·H2O剩余,反應后得NH4Cl溶液
②溶液中的物料守恒式:
③溶液中的電荷守恒式:
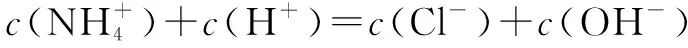
④溶液呈酸性,pH<7
⑤溶液中離子濃度大小比較:
……
支點三:HCl與NH3·H2O反應,溶液恰好呈中性
①兩者反應后,NH3·H2O過量,反應后為NH4Cl、NH3·H2O的混合溶液
②溶液中的守恒式:
③溶液中的電荷守恒式:
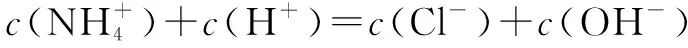
④溶液呈中性, pH=7
⑤溶液中離子濃度大小比較:
……
支點四:NH3·H2O過量,且有n(NH3·H2O)=n(NH4Cl)
①兩者反應后,NH3·H2O過量,反應后為NH4Cl、NH3·H2O的混合溶液,且有n(NH3·H2O)=n(NH4Cl)
②溶液中的物料守恒式:
③溶液中的電荷守恒式:
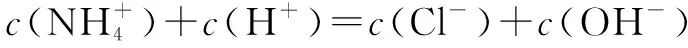
④溶液呈堿性, pH>7
⑤溶液中微粒濃度大小比較:
……
支點五:NH3·H2O溶液,未加HCl
①c(OH-)=c(NH3·H2O)×α,c(H+)=Kw/c(OH-)
②溶液中的電荷守恒式:
③溶液呈堿性,pH>7
④溶液中離子濃度大小比較:
……
二、習題解答
題已知常溫下,氨水中NH3·H2O的電離平衡常數(shù):Kb≈10-5.向1L 0.1mol/L NH4Cl溶液中,不斷加入固體NaOH,c(NH4+)與c(NH3·H2O)的變化趨勢如下圖所示(溶液體積和溫度的變化、氨的揮發(fā)均忽略不計),下列說法正確的是____.
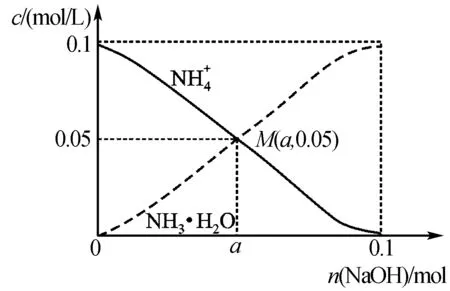
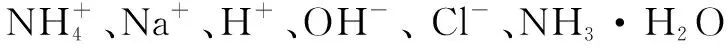
B.M點時,pH≈9
C.a=0.05mol

磨刀不誤砍柴功!通過模板一的建立與學習后,再看本題,一眼便看清M點.


答案:B.
三、題后反思
舉一反三,課后要求學生自主完成其他酸、堿混合情況分析,即強堿弱酸混合、強酸強堿混合、弱酸弱堿混合,建立對應的模板.

模板一 鹽酸與氨水混合情況分析師生課堂完成模板二 氫氧化鈉與醋酸混合情況分析學生自主完成模板三 氫氧化鈉與鹽酸混合情況分析學生自主完成模板四 醋酸與氨水混合情況分析學生自主完成
通過上述模板建立,充分復習、鞏固主題3的內(nèi)容,再輔以少量習題練習,酸、堿混合已再無難題.
主題3也是《化學反應原理》最核心內(nèi)容,它串聯(lián)著主題1“化學反應與能量”和主題2“化學反應的方向、限度和速率”,是“宏觀辨識與微觀探析”化學學科核心素養(yǎng)培養(yǎng)最好素材,建立模板,“看透”溶液,以五個支點“固定”溶液中離子平衡,突破難點,讓學生輕松學習,何樂而不為呢!

(2)模板三中,支點二、三重合,即恰好反應點亦為溶液呈中性點.

