淺談高中化學(xué)鹽類水解規(guī)律及其解題應(yīng)用
邱潤(rùn)容
(江西省贛縣中學(xué) 341100)
一、鹽類水解規(guī)律
1.“誰(shuí)強(qiáng)顯誰(shuí)性”
在高中化學(xué)知識(shí)的學(xué)習(xí)中,鹽類水解是較為基礎(chǔ)且重要的知識(shí).鹽類水解的實(shí)質(zhì)便是鹽中的弱堿陽(yáng)離子或弱酸陰離子與水電離后的OH-或H+結(jié)合生成難電離的分子或離子.“誰(shuí)強(qiáng)顯誰(shuí)性”便是鹽類水解中的一個(gè)規(guī)律,即只要鹽中存在弱堿陽(yáng)離子或弱酸陰離子,那么該鹽類就會(huì)進(jìn)行水解,產(chǎn)生離子,從而判斷溶液的酸堿性.在解題時(shí),學(xué)生們可以根據(jù)已知的這一規(guī)律,對(duì)問題中的鹽溶液進(jìn)行判斷,達(dá)到解出題目答案的目的.
2.“有弱就水解”
“有弱就水解”也是鹽類水解的規(guī)律之一,鹽中存在的離子所對(duì)應(yīng)的酸或堿越弱,那么水解就會(huì)越徹底.并且,在鹽類水解的知識(shí)內(nèi)容中,水的電離平衡也會(huì)影響溶液的pH:起初,水的電離正處于平衡狀態(tài),但是當(dāng)其平衡被破壞的程度越大時(shí),溶液的pH也會(huì)隨之越大.該規(guī)律可以用于判斷鹽溶液的pH和電解質(zhì)的相對(duì)強(qiáng)弱.在教學(xué)時(shí),教師們應(yīng)當(dāng)重點(diǎn)培養(yǎng)學(xué)生的應(yīng)用能力,引導(dǎo)學(xué)生們?cè)诮忸}時(shí)運(yùn)用已知的客觀規(guī)律,有效求解題目.
二、鹽類水解應(yīng)用
1.鹽溶液酸堿性的分析與判斷
鹽類水解問題中對(duì)鹽溶液酸堿性的判斷需要依據(jù)其規(guī)律進(jìn)行分析:誰(shuí)強(qiáng)顯誰(shuí)性,同強(qiáng)顯中性,即強(qiáng)堿弱酸鹽顯堿性、強(qiáng)酸弱堿鹽顯酸性、強(qiáng)酸強(qiáng)堿鹽顯中性.為了使得學(xué)生們能夠迅速判斷出問題所給出鹽溶液的酸堿性,教師們需要在日常教學(xué)中就引導(dǎo)學(xué)生們熟記鹽溶液酸堿性判斷的規(guī)律.在例1的求解中,學(xué)生只需要掌握判斷規(guī)律,就能夠輕易將題目求解得出.
例1在正常室溫下,下列說法中,有關(guān)于0.10mol·L-1的氨水說法正確的是( ).
A.與AlCl3溶液發(fā)生反應(yīng)時(shí),離子方程式為

C.用HNO3溶液完全中和后,溶液不顯中性
D.溶液pH為13
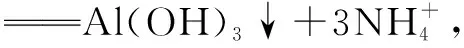
2.比較溶液中離子濃度大小
在化學(xué)考試中,經(jīng)常考察學(xué)生鹽類水解中離子濃度大小的問題.在該部分知識(shí)的考察中,學(xué)生們需要考慮到水解理論、電離理論、電荷守恒與物料守恒.如果在解題時(shí),僅僅考慮一部分,那么題目就有可能無法解答準(zhǔn)確.所以,在相關(guān)題目的練習(xí)時(shí),教師們需要讓學(xué)生們先根據(jù)“無弱不水解,越弱越水解”的規(guī)律對(duì)題目進(jìn)行判斷,寫出溶液中存在的所有離子.接著,再讓學(xué)生們根據(jù)電荷守恒與物料守恒明確溶液中各離子之間的等量關(guān)系,從而得出各離子濃度,最后進(jìn)行比較.
例2正常室溫下,將一元酸HA溶液與KOH溶液等體積混合,進(jìn)行相應(yīng)的實(shí)驗(yàn),見下表:
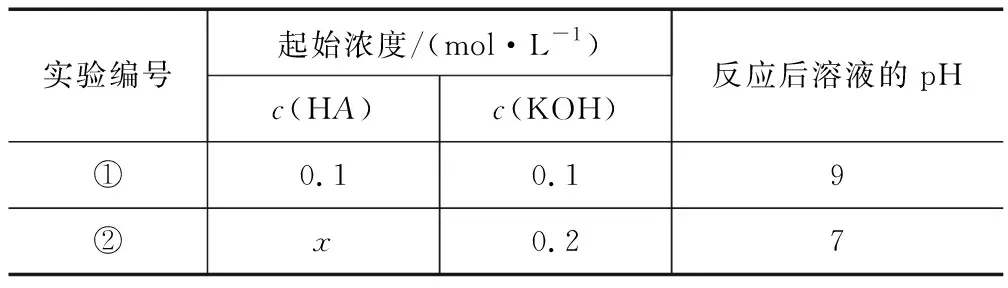
實(shí)驗(yàn)編號(hào)起始濃度/(mol·L-1)c(HA)c(KOH)反應(yīng)后溶液的pH①0.10.19②x0.27
下列說法不正確的是( )(忽略體積變化).
A.實(shí)驗(yàn)①反應(yīng)后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
C.實(shí)驗(yàn)②反應(yīng)后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.實(shí)驗(yàn)②反應(yīng)后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
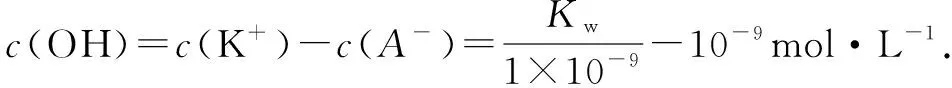
3.比較溶液中離子種類的多少
在有關(guān)離子種類多少的比較中,教師們需要在練習(xí)教學(xué)時(shí)讓學(xué)生們能夠清楚鹽類水解平衡的影響因素,及規(guī)律中的“越熱越水解,越稀越水解”.水解反應(yīng)中溫度可以使平衡進(jìn)行左右移動(dòng),同時(shí),改變平衡體系中的任意一種物質(zhì)的濃度,也可以使平衡進(jìn)行移動(dòng).其中升溫水解程度增大,物質(zhì)濃度縮小也會(huì)使水解程度增大.教師們可以利用例3對(duì)這部分知識(shí)進(jìn)行具體教學(xué).
例3NaHSO3溶液顯酸性,并且,溶液中具有以下平衡:


向0.10mol·L-1的NaHSO4溶液中分別加入以下物質(zhì),下列選項(xiàng)正確的是( ).
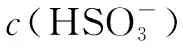
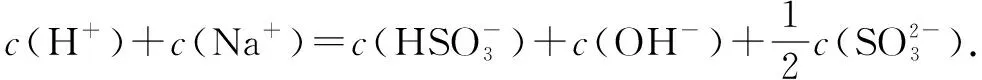
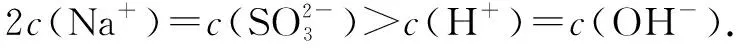
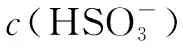
綜上所述,鹽類水解知識(shí)在高中化學(xué)學(xué)科中具有一定的難度,學(xué)生對(duì)該部分知識(shí)的掌握也存在困難.所以化學(xué)教師們需要以培養(yǎng)學(xué)生自主學(xué)習(xí)能力為教學(xué)目標(biāo),引導(dǎo)學(xué)生進(jìn)行一定量的專項(xiàng)訓(xùn)練,促使學(xué)生們能夠加強(qiáng)鹽類水解知識(shí)的內(nèi)化程度,從而在解題時(shí),能夠得心應(yīng)手而不是手足無措,瞎選一通.高中化學(xué)教師們需要重點(diǎn)提升學(xué)生解題的能力,使得學(xué)生們能夠夯實(shí)基礎(chǔ),不斷提升與發(fā)展.

