TRIPs plus 藥品知識產權強保護爭議焦點及根源分析
劉慧娟,楊雁玲
(南京工業大學浦江學院商學院,江蘇 南京211100)
一、 引言
在國際貿易及投資中,知識產權保護具有重要的地位,而醫藥產業作為技術密集型產業,藥品知識產權保護是其根本。2017年10月和2019年11月,中國政府頒布了一系列改革措施引領醫藥行業發展,其中包含了三項最重要的制度優化,分別為藥品專利鏈接制度、藥品專利期限補償制度、藥品試驗數據保護制度,這與國際上的TRIPs plus 類型的條款相對應。TRIPs plus 條款是2016年2月4日簽署的TPP 協議知識產權中的章節,體現了美國在知識產權保護領域的基本立場。作為近年來最高規格的規則文本,在一定程度上代表了發達國家的利益,也呈現出未來知識產權國際保護的走向。未來知識產權國際保護仍將繼續沿用這一高標準的保護規則,因此,對其進行了解有利于更全面地認識藥品知識產權國際強保護。
二、 美式FTA 積極推行藥品知識產權保護
藥品數據保護及藥品專利保護期延長制度作為美國推行高水平知識產權保護在醫藥產業的具體主張,美國曾采用“特別301 條款”批判并催促其他國家推行藥品知識產權保護制度,也通過FTA 談判將相關條款納入協定中。如美國“特別301 報告”中,指出智利沒有提供美國認為合理的知識產權保護。隨后,在醫藥領域,智利開始了一系列的醫藥專利改革,建立了藥品專利與監管部門連接的系統,以避免商業化的產品涉及專利侵權。
美國與其他發展中國家簽訂的FTA 包含了藥品專利延長期及藥品數據保護的條款(表1)。美國-約旦FTA 中增加了對藥品或農業化學產品的數據保護,并要求約旦在至少5年內確保美國批準的藥品試驗數據在本國免于不正當商業利用。美國認為約旦在國內立法中還應延長藥品的專利保護期,以彌補醫藥行政審批機構為批準藥品上市而造成的延誤。事實上,約旦雖修改了國內專利法,但并沒有明確地提出專利保護的延長期。美國-智利FTA 中也有延長藥品專利保護期的規定,專利持有者有權在遭遇行政延遲時請求超過5年的額外專利保護期,但沒有專門規定對藥品數據給予保護。

表1 美國FTA 中與藥品知識產權保護相關的TRIPs plus 條款

續表
分析美國—約旦FTA 的藥品知識產權保護可以了解美國在發展中國家推行該條款的深層次原因。約旦的醫藥產業自主研發能力較弱,因此依賴國外藥品而生產仿制藥品。而醫藥技術水平世界領先的美國藥企能夠依據美國—約旦FTA 從而獲得更強的知識產權保護,專利期延長及藥品數據保護進一步增強美國藥企競爭力。約旦國內的仿制藥難以與國外藥品競爭,嚴重限制了該國國內仿制藥的生產及銷售。發展中國家與發達國家簽署的藥品知識產權條款明顯使得發展中國家處于弱勢地位,Danzon 和Furukawa(2004)指出墨西哥在實施了1993年署的NAFTA 中的藥品知識產權保護條款后,國內藥品價格飛漲,以至于藥價已與歐盟國家相當。約旦國內的藥企認為TRIPs 及TRIPs plus 的實施使得廉價仿制藥延遲6~9年上市,藥企只能被迫生產一些早已過了20年專利保護期的藥品,這嚴重影響了約旦仿制藥品的出口,因而藥企對此十分不滿。
三、 TRIPs plus 與締約國藥品知識產權保護水平差距大
美式FTA 是美國進行其他區域性自貿協定談判的基礎,并在此基礎上提高藥品知識產權保護水平。藥品專利期延長至多5年的保護制度及生物藥品數據保護期8年的設置是TPP 爭議的核心所在,成員國國內民眾對TPP 嚴格的藥品知識產權保護也進行了強烈抗議。美國積極推行藥品知識產權保護TRIPs plus 條款,原因在于新興市場已成為其重要的藥品貿易伙伴。發展中國家也在努力減少貧困,居民收入水平的提高使得醫療支出水平也在提高,對西藥的需求也將增大。嚴格的知識產權保護可以保證美國醫藥企業保持藥品壟斷權從而獲得可觀的利潤。美國醫藥產業將長期處于全球領先地位,即便美國拋棄了TPP 協議,但仍會繼續推動其他發展中國家提高其國內醫藥知識產權保護水平,立場不會改變。
(一)藥品專利保護期延長
美國提出各談判方應當延長藥品專利保護期,以補償藥品在走完市場準入程序這一過程而損失的有效專利保護期,正如美國國內立法規定藥品專利保護期延長至多5年。國內知識產權保護水平較低的談判方沒有專利延長期的規定,因此最初并不認可美國關于延長專利期的提議。談判方認為藥品行政審批耗費較長時間是正常的并且可接受,如果延長藥品專利保護期,則進一步為藥品專利提供了更長的保護期。經過長時間的磋商,各談判方以犧牲部分利益為代價接受藥品知識產權保護條款,各成員方同意延長藥品專利保護期至多5年。各成員國國內藥品專利保護水平參差不齊。在1997年,澳大利亞就開始對本國醫藥專利進行改革,即增加至多5年的專利延長期。新西蘭一直擔心過度的專利保護可能會帶來藥品可及性問題,因此并沒有延長專利保護期的規定。2013年,加拿大在知識產權立法中增加了藥品專利期補償及藥品數據保護,目前,加拿大藥品專利保護延長期為5年,墨西哥、智利、秘魯這三國對藥品專利期的延長沒有規定,日本專利期延長至多5年,在參與TPP 協議談判的四個東盟成員國(文萊、越南、新加坡、馬來西亞)中,只有新加坡和文萊提供了至多5年的專利延長期限,越南作為這四個國家中經濟發展水平最低的國家,國內立法沒有專利期延長的規定。表2 列出了TPP 各國在談判達成一致前國內的藥品專利期延長情況。
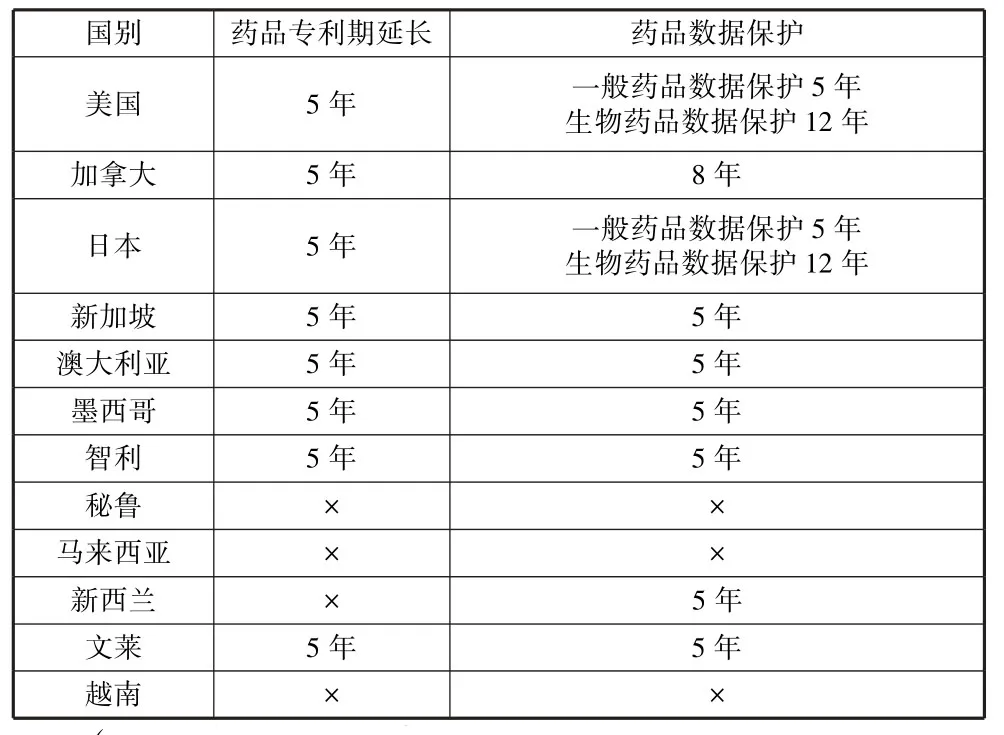
表2 TPP 達成前各談判國藥品知識產權保護期
(二)增加藥品數據保護期
美國國內對生物藥品數據保護期為12年,在區域協定談判中也不斷說服成員方能夠提供同樣的保護期限,從而激勵美國生物制藥創新并保證美國醫藥制造商的利潤,但該要求引起各成員方的不滿。澳大利亞、新西蘭和智利堅持藥品數據保護期限至多為5年,以便昂貴的生物藥品能盡快被廉價仿制藥代替,從而普通民眾能夠獲取低價藥物。雙方談判的結果是確定一個折中方案,即對藥品數據保護期規定為8年。作為美國生物技術行業領軍的吉利德科學公司(Gilead Sciences Inc.)和安進公司(Amgen Inc.)對達成的藥品知識產權保護提出了批評,認為8年的藥品數據保護期太短,原本應規定為12年。最終,TPP 官方文本規定對一般化學藥品數據保護期為5年,對生物藥品數據保護期為8年。加拿大于1995年修訂的《食品藥品條例》對藥品試驗數據保護期規定為5年,2006年后將這一期限改為8年。澳大利于1998年通過的《治療用品法修正案》首次納入藥品試驗數據保護條款,對藥品數據提供5年的保護期。新西蘭和新加坡提供5年的數據排他期,文萊則沒有藥品數據保護的規定,日本對生物醫藥數據獨占期規定為8年。
四、 結論
TRIPs 協定對藥品專利保護期規定為20年、藥品數據保護被納入TRIPs 協定到TRIPs plus 藥品知識產權保護條款更加嚴格,如延長藥品專利期、設置不同期限的藥品數據保護期。這一過程體現了藥品知識產權國際強保護的逐步形成過程。特別是TRIPs plus 延長藥品專利保護期并對生物藥品數據設置保護期,對于各國仿制藥生產商來說,這將限制仿制藥的生產和出口,并會進一步鞏固跨國制藥公司的壟斷地位。中國藥企目前整體上正處于由仿制轉向創新的關鍵節點,應及時全面了解各國的知識產權保護制度,從差異中及時抓住時機,在最新專利基礎上繼續創新,但應特別注意避免專利侵權。

