正、逆反應速率的概念辨析
◎
一、問題的提出
化學反應速率是化學反應原理的重要組成部分,是指某一物質在單位時間內物質的量濃度的變化,通常用以表述化學反應的快慢。《普通高中化學課程標準(2017 年版)》對化學反應速率的教學要求是“知道化學反應速率的表示方法,了解化學反應速率的簡單方法[1]”。根據課程標準的要求,化學反應速率的表示方法是高中化學知識的必講內容。
化學平衡是在化學反應速率和可逆反應的基礎上提出的一個新的概念性知識,其中化學平衡的定義以及影響因素是高中化學的重點和難點[2]。改變平衡的條件,判斷平衡移動的方向更是高考中重要的考點。學習化學平衡不僅能夠加深學生對化學反應速率的理解,而且是后續學習水解平衡、沉淀溶解平衡和電離平衡的基礎,在化學反應原理的學習中起著承上啟下的作用。掌握化學平衡的定義,在這一內容學習中顯得尤為重要。國內三套不同版本的高中化學教材對“化學平衡”的概念界定如表1 所示。

表1 高中化學教材中“化學平衡”的概念表述
通過比較發現三套教材對于化學平衡的定義并無太大差別,均提到了化學平衡的條件之一是正反應速率和逆反應速率相等。但教材中在講述化學反應速率時并沒有涉及到正、逆反應速率的概念,概念的缺失導致學生在學習此部分內容時會產生以下困惑:
1.錯誤正逆反應速率的含義
受到字面意思“正”和“逆”的影響,學生往往會認為正反應速率是指用反應物表示反應速率,逆反應速率是指用生成物表示的反應速率[6]。以可逆反應2SO2+O2?2SO3為例,學生可能會認為當反應達到化學平衡狀態時υ(SO2)=υ(O2)=υ(SO3),這顯然是不正確的。
2.對凈反應速率、正反應速率和逆反應速率之間的關系理解混亂
在可逆反應的學習時,教師往往會告訴學生“凈反應速率=正反應速率-逆反應速率”。由于在學習“化學反應速率”的概念時,學生已經知道用不同的物質表示同一化學反應在同一時間段內的反應速率其數值大小是不一定相同的。當學生看到這里的凈反應速率、正反應速率和逆反應速率,聯想到化學反應速率的概念,便會產生疑惑,這三種反應速率用不同物質表示時是不是不同? 如果是,這里指的是哪種物質的反應速率呢?
3.學習“化學平衡”時產生迷思概念
“化學平衡”是高中教學的重點和難點,研究表明,在學習化學平衡時學生會產生許多迷思概念[7],其中有很多都是因為對正反應速率和逆反應速率的錯誤理解造成的。例如,有學生會認為化學平衡狀態的標志是“A 的正反應速率等于B 的逆反應速率[8]”或“達到化學平衡時,體系內各物質的反應速率相等[9]”。
毋庸置疑,學生在學習時產生以上困惑增加了學生學習的負擔,導致教學活動面臨“教師教的吃力,學生學的困難”的局面。通過文獻調研發現,很多研究者指出了這方面存在的問題,但鮮有人給出清晰明確的解決方案[10]。
不難發現,產生上述困惑的根本原是中學化學教材中缺乏對正反應速率和逆反應速率概念的清晰解釋。為了幫助學生更清晰、深入的理解正、逆反應速率的內涵,明確可逆反應中三種化學反應速率之間的關系,消除學習化學平衡概念時產生的迷思概念,本文將基于學生的認知水平,在可逆反應的基礎上,借鑒教材中關于化學反應速率的概念,嘗試定義了正反應速率和逆反應速率,推導在某一反應體系中用不同物質表示正反應速率和逆反應速率的公式,對凈反應速率、正反應速率和逆反應速率之間的關系做詳細說明,并重新表述了化學平衡的定義。
二、概念界定
1.化學反應速率
在學習正反應速率和逆反應速率之前,應當首先知道何為“化學反應速率”。中學教材對“化學反應速率的定義”如表2 所示:

表2 高中化學教材中“化學反應速率”的概念表述
查閱相關大學教材后發現,關于“化學反應速率概念”的表述與中學教材基本一致,如表3 所示:

表3 大學化學教材中“化學反應速率”的概念表述
由表2 和表3 可知,無論是中學化學教材還是大學化學教材,“化學反應速率”概念的表述均沒有涉及到可逆反應,而且很多教材中都指出可用“反應物濃度的降低或生成物濃度的增加”來表示化學反應速率,從這一點可以看出,對“化學反應速率”的定義是將化學反應默認為不可逆反應。
以人教版化學教材選修4“化學反應原理”為例,介紹化學反應速率的表示方法:
化學反應速率用單位時間內反應物或生成物的濃度變化來表示,通常是用單位時間內反應物濃度的減少或生成物濃度的增加來表示,即:
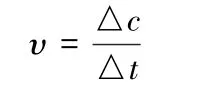
式中υ表示反應速率。c 表示各反應物或生成物濃度,△c表示其濃度變化(取其絕對值),t 表示時間,△t表示時間變化。
對任意一個反應,用符號來代替具體的化學物質,反應的化學方程式表示為:
mA+nB=pC+qD
反應體系中各物質的濃度分別表示為:c(A),c(B),c(C),c(D),則某一物質的反應速率表示為:
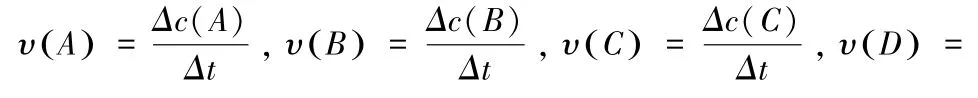
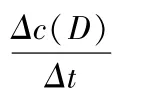
化學反應速率的大小可用化學反應中任意一種物質表示,其關系為:
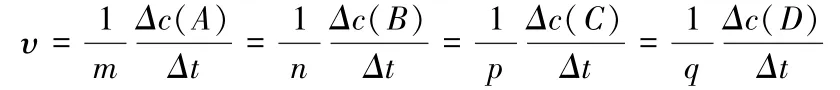
式中υ表示此反應的化學反應速率,單位為(濃度·時間—1)。
由此可見,用不同物質表示同一反應的化學反應速率時,由于各物質在化學方程式中的化學計量數不同,因此表示出的化學反應速率大小會有差異。
2.正反應速率和逆反應速率
中學化學中可將化學反應分為兩類,分別是可逆反應和不可逆反應。在正、反兩個方向上都能進行的反應稱為可逆反應,把從左向右的過程稱作正(向)反應,把從右向左的反應稱作逆(向)反應。另一類化學反應其反應物能完全變為生成物,即反應能進行到底,把這一類反應稱為不可逆反應。
我們查閱了大量文獻,并沒有找到有關于正反應速率和逆反應速率的明確定義,在華彤文主編的《普通化學原理(第4 版)》中,有這樣的描述;“化學反應有可逆性,當正向反應開始進行之后,隨之即有逆反應發生,所以實驗上測定的反應速率實際上是正向速率和逆向速率之差,即凈反應速率[13]”。這里的凈反應速率就是可逆反應的化學反應速率,由此可知,只有在可逆反應中,才會出現正反應速率和逆反應速率的概念。可逆反應中涉及的正反應速率和逆反應速率,是拋開凈反應速率,單從其中的一個方向來討論微觀狀態下化學反應的速率。根據化學反應速率的定義,正反應速率就是正向反應中某一物質的化學反應速率,逆反應速率就是逆向反應中某一物質的化學反應速率。而由于正向反應和逆向反應的共同作用而體現出的宏觀反應速率應稱為此可逆反應的“凈反應速率”,很多文獻中將其簡單稱為“化學反應速率”是不嚴謹的。
正反應速率、逆反應速率和化學反應速率之間的關系應該是并列的,化學反應速率是指不可逆反應中的某一物質單向反應速率,正反應速率和逆反應速率是指可逆反應中某一物質的某一個方向的反應速率。正反應速率及逆反應速率的定義和化學反應速率定義應該是類似的,不同之處在于定義正反應速率及逆反應速率時需要強調反應的可逆性和方向性。
參照化學反應速率的定義,我們如下定義正反應速率和逆反應速率:對于可逆反應,當體系為氣態或溶液時,正反應速率為單位時間內由于正反應造成的反應物或生成物的濃度(常用物質的量的濃度)變化量;逆反應速率為單位時間內由于逆反應造成的反應物或生成物的濃度(常用物質的量的濃度)變化量。
與化學反應速率類似,用不同物質來表示正反應速率或逆反應速率的大小時,其數值大小由于化學計量數的差異可能會有所不同,因此對于同一個化學反應,比較正反應速率和逆反應速率的大小時,應著重強調二者均是以同一種物質為基準。
三、關系梳理
1.可逆反應中的化學反應速率
在可逆反應中,同時存在三種化學反應速率,分別是凈反應速率、正反應速率和逆反應速率,在梳理正反應速率和逆反應速率的概念時,已經提及對于一個可逆反應,其“凈反應速率=正反應速率-逆反應速率”,這種表述方式放在大學教材中是沒有問題的,因為在大學教材中,這三種速率的大小都能用唯一的速率方程表示,因此其數值是固定的。但中學階段并沒有涉及到速率方程,只是學習了用不同物質表示反應速率的方法,而用這種方法表示反應速率,由于化學方程式中計量數的差異會造成反應速率大小的數值不同。因此,在表述三者之間的關系時,要有一個前提,即是用同一種物質表示的反應速率。
筆者認為用以下方式表述三者之間的關系較為合適:在可逆反應中,用同一種物質表示反應速率時,凈反應速率=正反應速率-逆反應速率。這里的凈反應速率、正反應速率和逆反應速率,均是用同一種物質表示的。
2.化學平衡的判斷依據
由正反應速率和逆反應速率的定義可知,在可逆反應中某一物質既有正反應速率,又有逆反應速率。判斷化學平衡的依據之一是“正反應速率與逆反應速率相等”,這里所指的正反應速率和逆反應速率均是指同一物質的反應速率,只是一個是正反應造成的此物質的濃度變化量,一個是逆反應造成的此物質的濃度變化量,教師在教授化學平衡的概念時應著重強調這一點,若是用不同物質分別表示正反應速率和逆反應速率,由于化學計量數的差異,二者相等時是不一定能達到化學平衡狀態的。
四、教學建議
1.中學教材中應明確表述正反應速率和逆反應速率的概念
正反應速率和逆反應速率是高中化學教學中的重要內容,其概念的缺失必定會給教師的教學和學生的學習帶來負面影響。學生往往只是簡單記住在可逆反應中有正反應速率和逆反應速率這兩個名詞,而不去思考其各代表什么含義。當教材中明確表述正反應速率和逆反應速率后,學生自然不會誤以為正反應速率就是用反應物表示的反應速率,逆反應速率就是用生成物表示的反應速率了。
2.知道各反應速率間等式成立的先決條件
教師在教授可逆反應的有關內容時,都會告訴學生“凈反應速率=正反應速率-逆反應速率”,但受到“化學反應速率”概念的影響,學生會知道用不同物質表示化學反應速率時大小是不一定相等的,那么這里的凈反應速率、正反應速率和逆反應速率都是指哪種物質的反應速率呢? 教師在課堂教學中應主動將這個問題拋出,引發學生的思考,與學生交流討論后得出結論:用同一種物質表示以上三種化學反應速率,等式才可以成立。
3.正確表述化學平衡的定義
化學平衡的學習向來是高中化學學習的一個重點和難點,如果對化學平衡的定義理解有誤,不僅會產生很多迷思概念,而且對先前有關化學反應速率知識的鞏固還是對后續各類溶解平衡知識的理解都是不利的。因此應著重強調概念中所說的正反應速率和逆反應速率都是用同一種物質表示的。化學平衡的定義應表述為:對于可逆反應,在一定條件下,當用同一種物質表示的正、逆兩個方向的反應速率相等時,反應體系中所有參加反應的物質的量或濃度可以保持恒定的狀態,稱為化學平衡狀態。如是定義化學平衡,也就解決了學生會產生“化學平衡狀態的標志是A 的正反應速率等于B 的逆反應速率”等迷思概念的問題。
正反應速率和逆反應速率的缺失在高中教學中帶來了諸多問題,本文基于化學反應速率的概念,在可逆反應的基礎上,嘗試定義了正反應速率和逆反應速率,建議中學階段的化學教學中,應明確表述正反應速率和逆反應速率的概念,梳理在可逆反應中三種反應速率構成等式成立的先決條件,并正確表述化學平衡的定義。

