晚期糖基化終產(chǎn)物在老年心房顫動患者血清中的表達及意義
李 瑩,紀玉強,蔡 琴,李晨輝
(西安市第一醫(yī)院心內科,陜西 西安 710002)
晚糖基化終產(chǎn)物(Advanced glycation end products, AGEs)是蛋白質、脂質、核酸在非酶糖基化反應下,自發(fā)地與葡萄糖及其他還原糖反應產(chǎn)生穩(wěn)定的具有活性的一類聚合物。AGEs有多種受體,其中晚期糖基化終產(chǎn)物受體(Receptor for advanced glycation endproducts, RAGE)是AGEs最具特征性、且是目前研究最廣泛、最深入的AGEs受體。AGEs與RAGE結合后誘導產(chǎn)生多種損傷因子如白介素-1a(Interleukin- 1a, IL-1a)、核轉錄因子NF-κB、白介素-6(Interleukin-6,IL-6)、腫瘤壞死因子-a(Tumor necrosis factor-α, TNF-α)等,誘導炎性反應和氧化應激,產(chǎn)生致病效應[1]。體內AGEs有多種不同的形式,目前已知的有羧甲基賴氨酸(Carboxymethyllsine,CML)、羧乙基賴氨酸、交聯(lián)素等。羧甲基賴氨酸是目前研究最多且易于檢測的一種晚期糖基化終產(chǎn)物。有研究發(fā)現(xiàn),AGEs與RAGE結合后,增加心肌細胞的凋亡進而損傷心肌細胞[2]。心房顫動在老年人群中是非常常見的一種心律失常,且在老年人群中患病率明顯增高。心房顫動可引起腦栓塞、心力衰竭等并發(fā)癥嚴重威脅老年人生活質量。AGEs隨著年齡的增長會慢慢增多。有研究發(fā)現(xiàn),心房顫動患者血清AGEs水平升高[3-4]。而有關老年心房顫動與晚期糖基化終產(chǎn)物的研究較少,本研究旨在通過檢測老年心房顫動患者血清CML水平及TNF-α、超氧化物歧化酶(Superoxide dismutase,SOD)水平變化,探討其相關臨床意義。
1 資料與方法
1.1 一般資料 選擇2017年6月至2018年1月在我院心血管內科住院的老年持續(xù)性心房顫動患者50例(年齡≥65歲),其中男26例,女24例,年齡69~89歲,平均(79.91±5.55)歲。對照組為同期住院的年齡≥65歲非心房顫動患者30例,其中男12例,女18例。年齡66~89歲,平均(79.80±4.775)歲。持續(xù)性心房顫動診斷按照 2016 年《歐洲心房顫動管理及治療指南》中關于持續(xù)性房顫的相關診斷標準。排除標準:糖尿病、其他嚴重心律失常、惡性腫瘤、合并感染病史、慢性炎癥疾病、嚴重肝腎功能不全、自身免疫性疾病、甲狀腺功能異常者。兩組患者在性別、吸煙、飲酒、冠心病史、高血壓病史、體重指數(shù)(Body mass index,BMI)方面比較,差異無統(tǒng)計學意義(P>0.05),具有可比性。
1.2 研究方法 所有研究對象均需采集詳細病史,行體格檢查及進行血液生化檢驗查血常規(guī)、電解質、肝腎功、血脂、血糖、心肌酶、高敏肌鈣蛋白T、甲狀腺功能、血漿超敏C反應蛋白(High-sensitivity C-reactive protein,hs-CRP)、氨基末端腦鈉肽前體(N-terminal pro-brain natriuretic peptide,NT-proBNP)等,并行心臟超聲檢查。研究對象晨時空腹12 h,從肘前靜脈抽取肘靜脈血。分裝放入2 ml的離心管中靜置待血液凝固后,再轉移到離心機中以3500 r/min離心15 min。取上血清液置于-80 ℃冰箱中冷凍保存待用。用 ELISA 法檢測血清 CML、SOD、TNF-αCML、試劑盒為上海酶聯(lián)生物科技有限公司產(chǎn)品,SOD試劑盒和TNF-α試劑盒均為武漢伊萊瑞特生物科技股份有限公司產(chǎn)品,具體操作方法參照 ELISA試劑盒說明檢測)。

2 結 果
2.1 兩組患者血清CML、TNF-α、SOD濃度比較 老年心房顫動組血清CML、TNF-α濃度均高于對照組,兩組比較差異有統(tǒng)計學意義(P<0.05),老年心房顫動組血清SOD濃度低于對照組,兩組比較差異有統(tǒng)計學意義(P<0.05)。見表1。
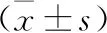
表1 兩組患者血清CML、TNF-α、SOD濃度比較
2.2 兩組患者心功能檢測指標比較 老年心房顫動組左心房內徑、左心室射血分數(shù)(LVEF)較對照組明顯升高,差異有統(tǒng)計學意義(P<0.05)。見表2。
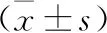
表2 兩組患者心功能檢測指標比較
2.3 老年心房顫動組血清CML水平與左心房內徑及LVEF相關性分析 CML與左心房內徑之間未通過顯著性檢驗,兩者之間無明顯相關性。CML與LVEF之間未通過顯著性檢驗,兩者之間無明顯相關性。見表3。

表3 老年心房顫動組血清CML水平與左心房內徑 及LVEF相關性分析
3 討 論
心房顫動是臨床上較為常見的一種心律失常。心房顫動隨著年齡的增長患病率增加,65歲以上人群其患病率約5%,80歲以上人群,房顫的患病率可達10%[5]我國已經(jīng)進入深度老齡化社會,老年心房顫動患者逐年增多。眾所周知,心房顫動可引起嚴重的并發(fā)癥,如腦栓塞、心力衰竭和其他惡性心律失常等,使住院率、致殘率和病死率增加,使患者的生活質量明顯下降。尤其在老年人群中更為嚴重,嚴重威脅老年人健康及加重社會負擔。所以心房顫動一直為心臟學領域的研究熱點和難點。如何防治老年心房顫動成為我們有待攻克的一項重要課題。
研究表明,房顫發(fā)生和持續(xù)的核心環(huán)節(jié)是心房電重構和結構重構,電重構和結構重構相互影響,共同構成房顫的電生理-解剖學基礎。越來越多的證據(jù)表明氧化應激可能導致心房重塑和心電重構,這在房顫的發(fā)生機制中有重要作用[6]。且近年眾多研究發(fā)現(xiàn)炎癥反應及氧化應激對于房顫的產(chǎn)生和維持起著重要的作用[7]。TNF-α、腦鈉肽等炎性因子參與了心房顫動的發(fā)病機制。亦有研究發(fā)現(xiàn),高水平的炎性因子可能參與了心臟結構重構,以維持房顫發(fā)生[8-9]。AGEs與其受體RAGE結合后,可激活多種細胞信號轉導途徑如激活p21和p38MAPK等轉導徑路,誘導產(chǎn)生多種損傷因子如核轉錄因子NF-κB、IL-1a、IL-6、TNF-α等,誘導炎性反應和氧化應激,產(chǎn)生致病效應[1]。那么,AGEs是否也可導致心房重塑和心電重構誘導房顫的發(fā)生呢?以及AGEs是否在心房顫動的發(fā)作及維持中扮演重要的作用呢?有關實驗研究顯示,AGEs可與其受體RAGE作用誘導心肌成纖維細胞的老化,能刺激心肌成纖維細胞增殖[10]。AGEs主要是通過與細胞表面的RAGE相結合,激活胞內信號通路進而引發(fā)心肌老化[10]。而心肌老化主要表現(xiàn)為心肌纖維化[11]。且有研究發(fā)現(xiàn),心房顫動患者血清AGEs水平升高[3-4]。而且有研究顯示血清AGEs水平與左心房直徑呈正相關[12]。
AGEs隨著年齡的增長會慢慢增多[1]。機體組織中過多的AGEs與受體結合后可改變蛋白質、脂類、核酸的結構,改變其功能,造成細胞、組織的損傷。有實驗證實,伴隨老年個體內AGEs物質增多,氧化應激產(chǎn)物也隨之增多,且應激激素和炎性反應物質亦增多[13]。而內源性的抗氧化應激系統(tǒng)在維持正常心肌細胞的功能中有重要作用[14-15]。有研究顯示,AGEs能降低SOD的活性,促進氧化應激,損傷細胞及組織。氧化應激狀態(tài)下AGEs合成增多,而AGEs與受體RAGE結合后又進一步促進炎癥反應和氧化應激過程,這樣形成了一個惡性循環(huán)過程,加重了對細胞和組織損傷。
基于以上理論及相關研究結果,均為我們研究AGEs與老年心房顫動提供了重要依據(jù)及線索。我們考慮是否老年心房顫動患者體內存在高AGEs水平,且高AGEs通過誘導炎性反應和氧化應激,促使房顫的發(fā)生。本實驗通過檢測老年心房顫動患者血清CML水平,發(fā)現(xiàn)老年心房顫動患者血清CML水平較對照組明顯升高,且兩組間具有統(tǒng)計學差異。且檢測老年心房顫動組炎性指標TNF-α水平亦均較對照組升高,且兩組間具有統(tǒng)計學差異。SOD是維持體內氧化系統(tǒng)平衡的抗氧化酶,SOD高低可間接反映機體清除氧自由基的能力[17]。為了探明AGEs與心房顫動與細胞內氧化應激有關,本實驗通過檢測SOD 水平,以反應細胞氧化應激水平。結果顯示對照組中SOD水平明顯低于對照組,且兩組間有統(tǒng)計學差異,提示老年心房顫動組氧化應激水平較對照強,可能與AGEs增多,通過AGEs-RAGE-氧化應激導致心肌細胞損傷有關。通過超聲檢查,老年房顫組左心房內徑較對照組增大,且LVEF較對照組減低,兩組結果均有統(tǒng)計學差異。
綜上所述,分析AGEs可能通過炎癥及氧化應激引起心房電重構和結構重構,參與房顫的發(fā)生及維持,具體機制與離子通道有待進一步研究及分析。本實驗發(fā)現(xiàn)左心房直徑隨著血清CML水平升高而升高,但兩者之間相關性不明顯,分析可能房顫患者左心房直徑增大受多種因素及相關疾病影響有關,有待我們進一步研究及分析。

