變化觀念與平衡思想在高中化學教學中的滲透
摘 要:變化觀念與平衡思想是高中化學學科核心素養(yǎng)的重要構成內(nèi)容。在教學過程中,教師加強對這一素養(yǎng)的培養(yǎng),不僅能使學生更好地理解與掌握所學知識,還能為其靈活運用所學知識分析化學反應提供良好的指引。在教學活動中,教師應做好充分的準備,讓學生通過自主學習,掌握化學變化觀念與平衡思想的知識;有針對性地設計教學內(nèi)容,指導學生高效掌握所學知識,從而培養(yǎng)學生的變化觀念與平衡思想。
關鍵詞:變化觀念;平衡思想;高中化學
中圖分類號:G427? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?文獻標識碼:A? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文章編號:2095-9192(2021)33-0072-02
引 言
《普通高中化學課程標準(2017年版)》中關于變化觀念與平衡思想的內(nèi)容共涵蓋四個層面。為將其更好地滲透在教學過程中,教師應聯(lián)系對應的化學知識,通過對理論與例題的講解,加強認識,加深理解,從而實現(xiàn)教學目標,促進學生學科核心素養(yǎng)不斷發(fā)展。
一、注重反應規(guī)律剖析
“能認識物質(zhì)是運動和變化的,知道化學變化需要一定的條件,并遵循一定規(guī)律”是變化觀念與平衡思想中的一項內(nèi)容。通過對這一內(nèi)容的解讀,教師應在教學中將理論與實際聯(lián)系起來,為學生講解發(fā)生在生活中的氧化還原反應,使其把握氧化還原反應的本質(zhì)及條件[1]。同時,為進一步加深學生對氧化還原反應規(guī)律的理解,教師可以與學生一起分析如下問題。
在酸性溶液中,Co2O3可被還原成Co2+,其中I2、FeCl3、Cl2、Co2O3的氧化性依次增強。則在水溶液中,以下反應無法進行的是(? ? )。
A.2I-+2Fe3+=I2+2Fe2+
B.FeI2+Cl2=I2+FeCl2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
D.6FeI2+3Cl2=4FeI3+2FeCl3
氧化性是物質(zhì)得電子的能力。物質(zhì)間要想發(fā)生氧化還原反應,需遵循氧化還原反應規(guī)律,即一種物質(zhì)能夠從另一種物質(zhì)中獲得電子,或者較另一種物質(zhì)吸引電子的能力更強。A項中,氧化性強弱關系為2Fe3+>I2,還原性強弱關系為I->Fe2+,能夠發(fā)生。Cl2氧化性強于Fe2+、I-,但如果Cl2較少,則其首先和還原性更強的I-發(fā)生反應,故B項反應能夠發(fā)生。Co2O3可將Cl-氧化成Cl2,C項正確。D項中,因還原性I->Fe2+,因此,Cl2先氧化I-再氧化Fe2+,反應無法發(fā)生。
二、深化反應能量認識
高中化學教學中,為使學生掌握化學反應中的能量轉(zhuǎn)化規(guī)律,教師應注重運用多媒體技術,使學生更好地把握化學反應能量變化的本質(zhì),如下題。
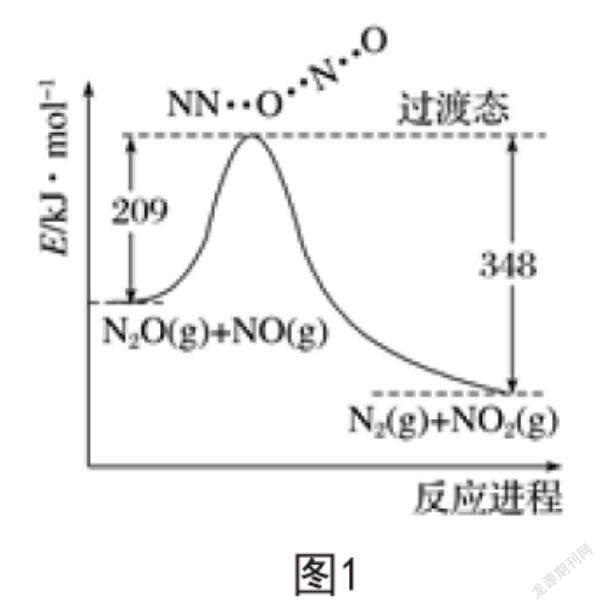
NO和N2O發(fā)生反應能夠生成NO2和N2,反應過程中的能量變化如圖1所示,則以下推斷不正確的是(? ? )。
A.每生成1mol的N2,轉(zhuǎn)移電子4mol
B.反應物能量之和較生成物能量之和大
C.NO(g)+N2O(g)=N2(g)+NO2(g);?H=-139kJ·mol-1
D.斷鍵吸收能量之和比成鍵釋放能量之和小
化學反應不僅有新物質(zhì)生成,而且在反應過程中有能量變化。解題過程中,學生需要看懂能量變化圖,理解縱橫軸表示的含義。A項,根據(jù)題意可知,發(fā)生的反應為NO+N2O=N2+NO2,生成1mol N2轉(zhuǎn)移2mol電子,錯誤。B項,由圖1可知反應物能量之和大于生成物能量之和,反應放熱,正確。C項,由圖1可知,209kJ·mol-1-348kJ·mol-1=-139kJ·mol-1,正確;由反應放熱的本質(zhì)可知,D項表述正確。綜上所述,只有A項錯誤。
三、講解反應調(diào)控規(guī)律
變化觀念和平衡思想要求學生“認識化學變化有一定限度,是可以調(diào)控的”。為使學生理解這一層面的內(nèi)容,教師在教學中應結(jié)合具體教學內(nèi)容在課堂上為學生做相關的演示實驗,增強課堂趣味性的同時,深化學生對化學反應的認識:很多化學反應是可逆的,而且達到一定的限度后,一些物質(zhì)的參數(shù)將不會發(fā)生變化,即達到了化學平衡。為考查學生對化學反應調(diào)控規(guī)律的理解程度,教師可要求學生結(jié)合自己的理解分析如下問題。
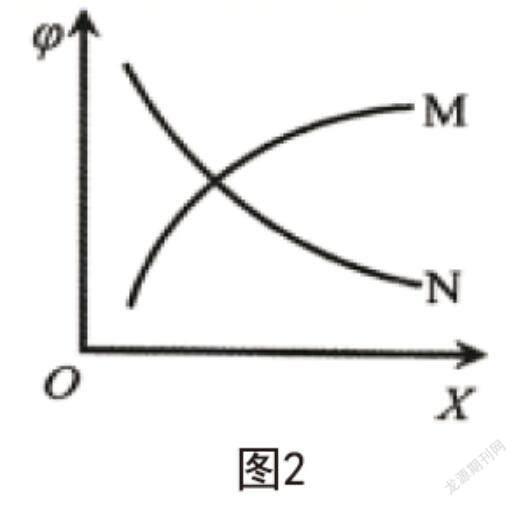
使用如下反應可制備H2:CH4(g)+H2O(g)?CO(g)+3H2(g);?H>0。每次僅改變一種條件,且用X表示,測得CH4平衡時的轉(zhuǎn)化率和X之間的關系如圖2所示,則(? ? ?)。
A.若X為溫度,的變化為曲線N
B.若X為壓強,的變化為曲線M
C.若X為n(H2O),則的變化曲線為N
D. X為投料n(CH4)與n(H2O)的比值時,的變化為曲線N
化學反應達到平衡后,相關物質(zhì)的參數(shù)不再發(fā)生變化。但通過改變條件可對平衡進行調(diào)控,使其正向或逆向移動。由題干創(chuàng)設的情境可知,給出的化學反應為吸熱反應,隨著X溫度的增加,平衡正向移動,值增加,對應曲線M;此化學反應為氣體分子數(shù)增多的反應,增大壓強X,反應逆向移動,的變化曲線為N;增加H2O的物質(zhì)的量,平衡正向移動,會增加,對應曲線M;X為n(CH4)/n(H2O)時,相當于增加了CH4的量,平衡雖然正向移動,但的值是減小的,對應曲線N。綜上所述,只有D項正確。
四、多角度分析化學反應
“能夠多角度動態(tài)地分析化學反應,運用化學反應原理解決實際問題”是變化觀念與平衡思想最后一個層面的內(nèi)容,強調(diào)了提高學生分析與解決問題的能力。在教學過程中,教師要鼓勵學生做好訓練總結(jié),掌握動態(tài)地分析化學反應的相關細節(jié),尤其要結(jié)合不同化學反應的特點,靈活地運用勒夏特列原理進行分析。教師可以在課堂上組織學生圍繞以下習題開展訓練活動。
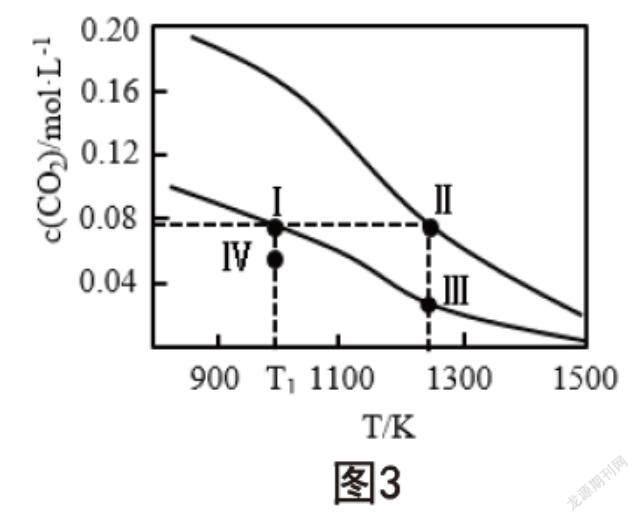
向兩容積均為1L的恒容密閉容器中加入足量相同的碳粉,之后分別加入0.1mol和0.2mol的CO2,在不同溫度條件下發(fā)生反應:CO2(g)+C(s)?2CO(g),平衡時,c(CO2)隨溫度的變化如圖3所示,則以下判斷正確的是(? ? ?)。
A.反應的?H<0
B.體系的總壓強:p(Ⅰ)>p(Ⅲ)
C.平衡常數(shù):K(Ⅰ) D.T1溫度時,Ⅳ點所處的狀態(tài)中v(正)>v(逆) 兩條曲線均隨著溫度的增加呈下降趨勢,表明反應達到平衡時,c(CO2)含量降低,轉(zhuǎn)化率增加,由勒夏特列原理可知反應為吸熱反應;Ⅰ點和Ⅲ點在同一曲線上,從Ⅰ點到Ⅲ點平衡正向移動,為氣體分子數(shù)增多的反應,因此,體系的總壓強滿足p(Ⅰ) 結(jié)? 語 綜上所述,教師應認真剖析化學核心素養(yǎng)與教學內(nèi)容之間的聯(lián)系,做好授課準備,靈活運用多種教學方法,注重培養(yǎng)學生的變化觀念與平衡思想,做好對化學反應規(guī)律、能量、化學反應限度、化學平衡知識的講解,并配合相關習題的訓練,使學生形成變化觀念與平衡思想。 [參考文獻] [1]韓琳慧.基于變化觀念與平衡思想的“化學反應限度”教學設計[J].求知導刊,2021(11):67-68. 作者簡介:曾賽欽(1979.11-),女,福建莆田人,本科學歷,中學一級教師。

