基于史料和實驗情境的證據推理與模型認知探究課
李繼良 于守麗 徐梅星
摘要:證據推理與模型認知是化學課程發展學生核心素養的重要內容,也是深刻認識原子結構模型的重要方式。素養本位的課堂教學旨在教授科學家思維而不是科學家結論。選取代表性史料情境和真實的陰極射線實驗、紅光實驗、光譜實驗情境,在學生收集證據、建構模型、應用模型、發展模型的過程中消除學生的迷思概念并體驗證據+推理獲得觀點的科學思維方法;在理解質量數、核素及同位素等概念的基礎上,促進學生模型認知能力的提升、感受學科研究價值,全面發展學生學科核心素養。
關鍵詞:原子結構模型;證據推理;模型認知;光譜實驗
文章編號:1008-0546(2021)10-0032-05中圖分類號:G632.41文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2021.10.008
*本文系北京市2018年規劃專項研究課題(CDFB18369)“促進學生核心素養發展的教科研知識管理模式探究”研究成果。
雖然原子結構的核式模型和電子分層排布在高一年級學生眼中是耳熟能詳的事情,但是讓學生畫出其心目中模型的時候,我們看到學生對什么是模型和原子核包含什么、原子殼層以及原子核大小等存在許多認知誤區。為充分發展學生的化學核心素養,我們應該“結合有關數據和實驗事實認識原子結構”[1],高中化學教學探討中一般做法是融入化學史或者介紹原子結構模型發展[2],基于史料和真實實驗情境構建不同證據背景下原子結構模型的多學科融合的研究匱乏。根據人教版化學必修“物質結構元素周期律”專題的整體編排,設計了滲透證據推理與模型認知素養的專題起始課:從微小原子到宏觀宇宙——探索原子結構;意在“利用化學實驗史實引導學生了解化學概念、化學原理的形成和發展,認識實驗在化學科學發展中的重要作用”[3]。
一、證據推理與模型認知教學設計思想
證據推理既可看成證據獲得與邏輯推理的并列,也可以作為偏正結構的詞匯來理解;為強調證據獲得與邏輯推理的重要性,本文傾向前者。“推理”是指思維的基本形式之一,“由一個或幾個已知的判斷推出新判斷的過程,有直接推理、間接推理等”[4],盧瑟福行星原子結構模型不能解釋原子線狀光譜就間接證明波爾的電子分層排布模型就是間接推理。人類對原子結構的認識都是基于當時實驗條件獲得必要的證據,然后科學家基于證據進行邏輯推理后得到相應觀點;推理包括定性推理(如湯姆孫推理原子中有帶正電的微粒)和定量推理(如薛定諤二階偏微分方程研究電子運動方式),把觀點用類比、抽象的方法圖示化表征就形成了不同時期的原子結構模型。
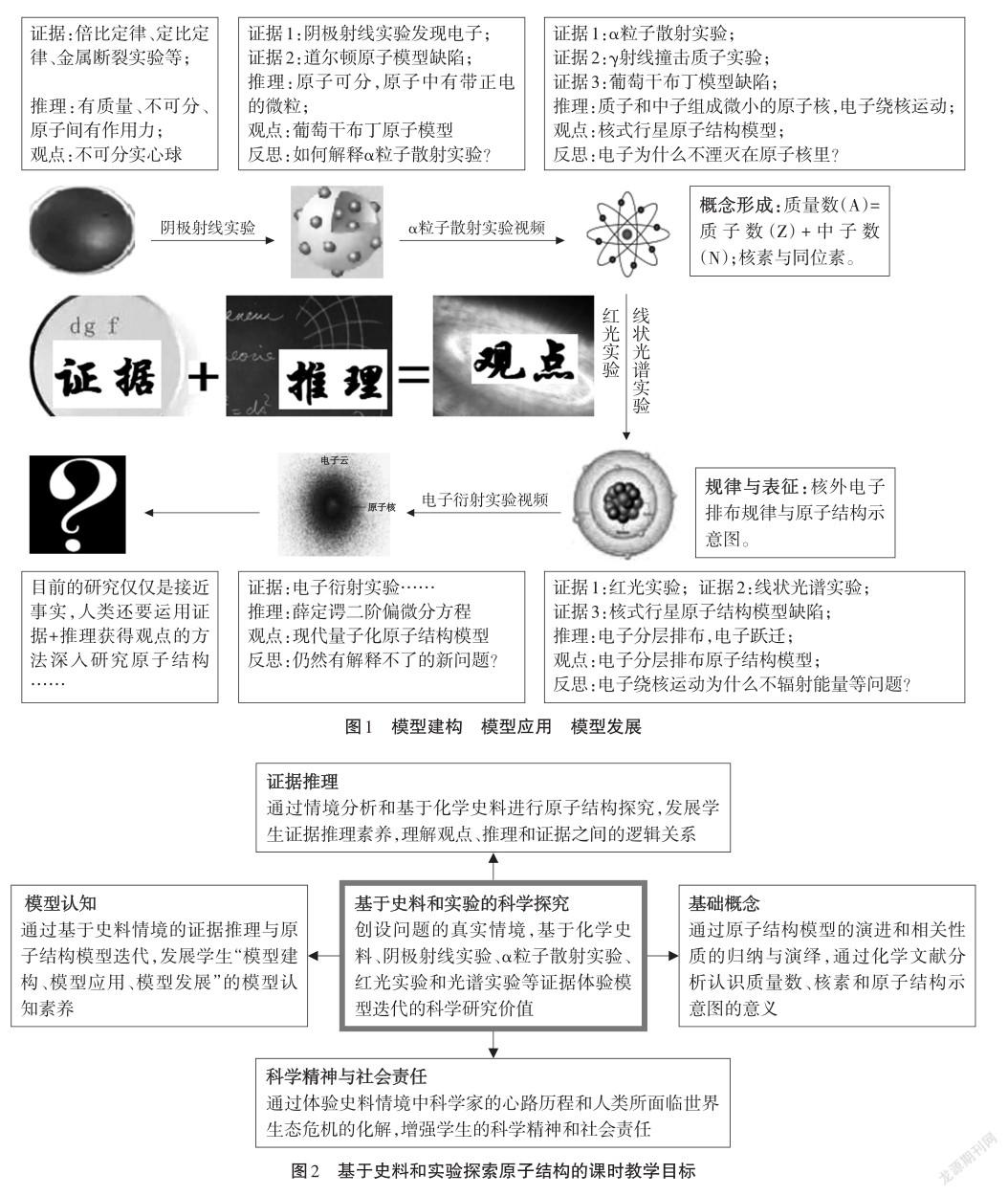
“建模”,泛指人類描述和解釋自然現象的一切概念化過程,是對真實世界的經驗與發展對經驗的解釋之間的中心環節,使人們的經驗從混沌無序向邏輯有序發展[5]。國內外專家在模型建構和分類上觀點各異,其中科學教學中的四種類比映射,即微縮模型、鐫刻模型、句法模型和涌現模型[6]較有影響;原子結構模型應屬于鐫刻模型。本文根據不同時期科學家的研究史料和實驗情境的再現,引導學生將證據和推理生成合理的原子結構模型,利用自己構建的模型解釋新問題,在新問題面前評估和修正原有模型;在建模、用模、修模的螺旋式發展過程中體驗人類認識自然界的基本方法,具體內容如圖1。
二、教學目標
見圖2。
三、教學分析及主要實驗儀器
大部分學生初步了解原子結構的核式模型,知道質子、中子和電子,了解簡單元素的原子結構示意圖;因為疫情和選考因素,對原子結構模型發展歷史知之甚淺,對原子核外電子排布掌握的不夠準確,不懂質量數和核素的意義,對原子核組成和電子分布情況還存在迷思概念。經過初中科學和化學課程的學習,大部分學生初步理解證據推理的方法和價值;但是對于“證據、推理和觀點”的邏輯關系還比較陌生;對于模型認知缺乏理性認知和感性體驗。學生能知道普通化學物質的簡單性質(如鐵、鹽酸)及其在生活中的應用價值,但是對于結構決定性質認識不夠深刻,對于原子結構的學科和社會價值認識不深刻。為了提高研究情境的代入感,把學生分成六個研究小組。每組都有六只寫有先哲、道爾頓、湯姆孫、盧瑟福和薛定諤名字的胸牌,上課每生隨機戴上一只胸牌,方便課堂上分角色展開項目探究活動。
實驗儀器主要是:陰極射線管與光譜管組(湖北鄂州市教學儀器廠)、單筒直讀式分光鏡(江蘇靖江市圣飛光儀設備有限公司)、電子感應圈(北京日壇星云科技發展有限公司)。
四、教學過程
1.情境創設:提出驅動性問題
【情境引入】福島核電站核污染冷卻水存量在不斷增加,其中含有放射性銫-134和銫-137,若污染水源容易導致白血病等癌癥。放射性銫為什么容易引起白血病呢?另外有報刊說:要抑制銫在人體內沉積,可以多攝入鉀[7],這又是為什么呢?帶著這些問題我們一起探索一下原子的內部結構。
2.模型構建:從證據、推理到觀點
【材料1】早期原子結構資料[8]
公元前500年,中國墨翟:端,無間也。
公元前500年,古印度庚納德:物質由最小的質點組成。
公元前400年,古希臘德謨克利特和留基伯:“原子”是構成物質的最小粒子,不可再分。
【教師】概括當時的原子結構模型并評價其科學性,各小組的先哲主持討論并代表小組發言。
【學生】有推理無證據,屬于直覺。
【材料2】道爾頓原子結構研究資料
(1)1789年,拉瓦錫用精確實驗證明質量守恒定律。
(2)1799年,普羅斯特根據實驗證明:構成各種化合物的各種元素都有一個確定的質量比,即定比定律。道爾頓推測:當2種元素所組成的化合物有2種以上時,在這些化合物中,如果一種元素的量是一定的,那么與它化合的另一種元素的量總是成倍數地變化的(如CO和CO2),即倍比定律。20年后倍比定律被瑞典化學家貝采尼烏斯用實驗證明[9]。
(3)金屬斷裂實驗,金屬絲直徑均為1/10英寸,恰好斷裂的重量是:鉛29.25磅;錫49.25磅;銅299.25磅……[10]。
(4)1803年,道爾頓通過實驗測算不同元素的相對重量,并指出:最輕的元素就是氫,把氫的原子重量相對地定為1是較為合理的。
【教師】為了微觀解釋上述事實,1803年道爾頓基于上述實驗及結論提出實心球體原子結構模型,他運用了證據+推理→觀點的思維模型。
【板書】證據:相對質量、定比定律、倍比定律、斷裂實驗;推理:不可再分、實心球體、原子間作用力。
【投影】道爾頓模型概述:①原子是不可再分的實心球體;②同種元素原子各種性質和質量都相同;③在化學反應中,原子既不消失也不產生,原子的種類和數目是守恒的,不同物質中原子按照簡單整數比結合;④原子間通過鉤子組成單質或化合物。
【教師】原子真的不可分嗎?如果原子可分,湯姆孫預測在正負電極加上高電壓,某一極應該向對方發射微粒,讓這些微粒穿過電場,大家預測這些粒子會怎樣?各小組道爾頓主持陰極射線探究實驗。
【學生】帶著自己的預測觀察陰極射線實驗,確認陰極射線發出的粒子帶負電。
3.認知迭代:模型應用與模型發展
【材料3】湯姆孫原子結構研究資料[11]
1859年,普呂克爾發現陰極射線在電場和磁場發生偏轉,將風車放在陰極射線旁,風車會旋轉。
1899年,湯姆孫測定各種物質產生的陰極射線,證明了陰極射線是帶負電的粒子,并測定一個粒子的質量是一個氫原子質量的1/1836,隨即命名為電子,而且是原子結構的一部分。
【教師】請結合材料3和陰極射線實驗,創設原子結構模型解釋上述事實?各組湯姆孫主持并展示。
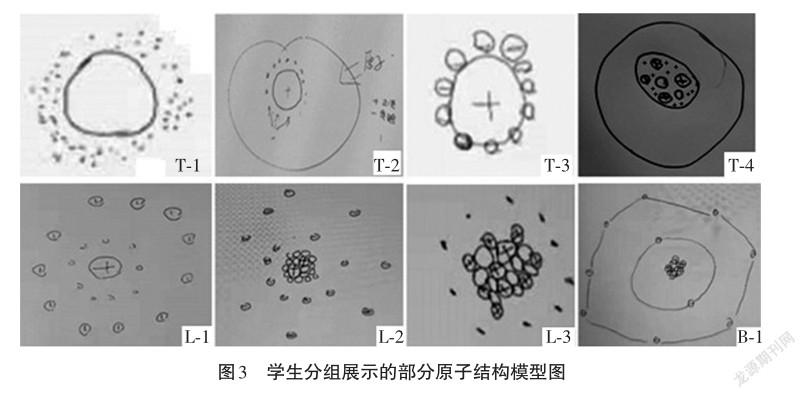
【學生】小組討論并展示,如圖3中T-1、T-2、T-3、
T-4。
【教師】有的同學畫出模型中只有帶負電的微粒,卻沒有帶正電的微粒,這可能嗎?……
【板書】證據:陰極射線實驗(直接)、道爾頓模型解釋不了(間接);推理:原子可分,正電微粒分布在原子中。
【投影】湯姆孫原子結構模型:原子由密封在帶均勻正電荷的球體和在其中分散的大量帶負電的電子構成的。
【教師】盧瑟福試圖用一個微小而堅硬微粒進入原子內部一探究竟,于是他選擇了質量較大、體積較小帶正電的α粒子轟擊體積較大的金箔。根據湯姆孫葡萄干布丁原子結構模型預測盧瑟福α粒子轟擊金箔的實驗現象?
【學生】α粒子應該全部穿過。
【教師】請觀看α粒子散射實驗視頻。
【材料4】盧瑟福原子結構研究資料
1909年,盧瑟福和助手做了α粒子轟擊金箔散射實驗,現象是:①大多數α粒子不偏轉;②少數α粒子大角度偏轉;③極少數(八千分之一)α粒子被反彈。
1914年,盧瑟福用陰極射線轟擊氫,發現了質子。
1919年,盧瑟福用粒子轟擊氮核,猜想原子核內存在不帶電的中子。
1935年查德威克根據對原子核轟擊實驗,發現從原子核里發出的γ射線可以把質子從原子中撞出來,確認γ射線中的微粒是中子,中子不帶電,質量與質子相近[12]。
【教師】請結合實驗視頻和材料4創設原子結構模型解釋上述事實?各組盧瑟福主持并展示。
【學生】小組討論并展示,如圖3中L-1、L-2、L-3、 L-4。
【教師】絕大部分α粒子穿過金箔說明原子內部很空,有的同學畫出的原子核非常大,大家想想符合實驗事實嗎?還有同學將質子、中子、電子全塞到原子核里面有依據嗎?……
【板書】證據:α粒子散射實驗、γ射線撞擊質子(直接)、湯姆孫模型不能解釋散射實驗(間接);推理:質子和中子組成微小的原子核,電子繞核圓周運動。
【投影】盧瑟福原子結構模型:原子核集中了幾乎原子的總質量和全部正電荷,原子核很小,電子繞核高速運動。
【資料5】原子中微粒質量
見表1。
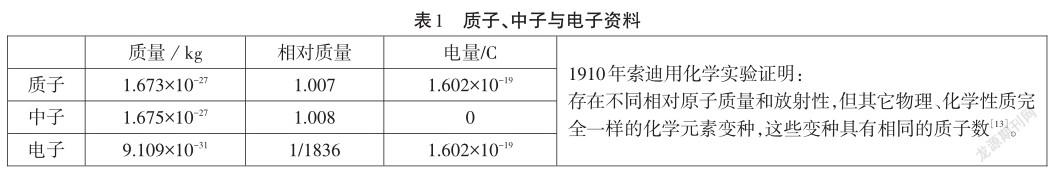
【教師】根據資料5不難推出,決定原子質量的微粒是質子和中子,因此質子數加中子數稱為質量數。有中子才能有強大的核力將多個質子共存于原子核中。過多的中子會發出γ射線,這就是134Cs和137Cs有放射性的原因。
【板書】質量數=質子數+中子數。134Cs和137Cs互為同位素。
【教師】將氯氣通入過氧化氫濃溶液與氫氧化鈉固體組成的混合物,我們看到水溶液里有紅光閃爍,請用盧瑟福原子結構模型解釋紅光實驗原因?請大家用單筒直讀式分光鏡觀察窗外,看到的是連續光譜吧,各種能量的光有序排列在你的眼前,現在關燈,繼續用單筒直讀式分光鏡觀察純凈氫氣、汞蒸氣和氬氣的光譜,大家看到了什么?
【學生】僅有一兩條線狀光帶。
【教師】對,就是線狀光譜,大家思考:電子繞核旋轉應該逐漸耗能而發射連續光譜。為什么電子沒有湮滅在原子核里,而且還發射線狀光譜?請大家依據材料6分析,創設新的原子結構模型解釋光譜問題,各組波爾主持并發言。
【材料6】波爾原子結構研究資料[14]
1900年,普朗克依據實驗提出:振動的電子輻射光的能量是不連續的,一份一份的。
1905年,愛因斯坦針對特定頻率的光照射金屬飛出電子(光電效應),提出光子運動具有波(電磁波)粒(彈性粒子)二象性。
【學生】畫出電子分層排布的核式原子結構模型,如圖3中B-1。
【教師】很好,大家都想到了電子分層排布,紅光實驗中就是新生成的氧氣中有外層電子跳躍到內層變成穩定的氧氣時釋放出的能量恰好以紅色可見光的形式發出來。
【板書】證據:原子的線狀光譜(直接)、電子沒有進入原子核湮滅(間接);推理:電子在不同能量層間跳躍時發出不同能量的光。
【投影】波爾原子結構簡化模型:能量輻射不是連續的,而是電子在不同電子層間轉換時才發射或吸收的;電子在不同電子層繞核圓周運動;電子在兩個電子層之間轉換(電子躍遷)時發射的輻射被記錄后就是線狀光譜。
4.歸納總結:核外電子排布規律
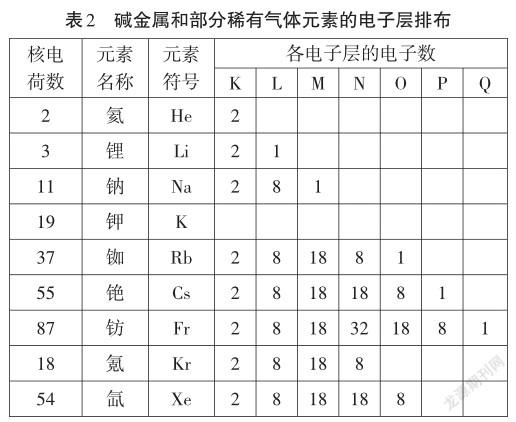
【教師】表2是堿金屬和部分稀有氣體元素的電子層排布,從中你能發現什么規律?
【學生活動】各組薛定諤組織討論并展示。
【投影】歸納總結:(1)電子總是優先排布在能量較低離核較近的電子層;
(2)每個電子層最多容納2n2個電子;
(3)最外層不超過8個電子,K層作最外層不超過2個電子;
(4)次外層不超過18個電子;
(5)倒數第三層不超過32個電子。
【教師】請同學們寫出鉀元素的原子結構示意圖,并與投影中銫原子的原子結構示意圖比較有什么異同?
【學生】鉀與銫最外層電子數都是1,這種結構上的相似性決定其化學性質很相似;以致于我們身體易把銫當成鉀攝入,如果身體所需鉀元素基本飽和,就不用再吸收鉀了,也就抑制了銫的攝入。
5.展望:人類對原子模型的探索仍然在路上
【教師】波爾原子結構模型也有處理不了的問題,后來薛定諤用數學的方法來描述電子等微粒的運動狀態,提出了現代量子化原子結構模型。戴維森和革末利用電子衍射實驗證明了電子運動的波動性,證明了量子化模型的科學性,但是真正原子結構是什么樣子,研究還在持續。
【教師】2020年諾貝爾物理學獎的一半給了羅杰·彭羅斯,他創立了扭量理論,進而計算出了黑洞存在。另一半給了萊因哈德·根澤爾和安德里亞·格茲,他們利用射電望遠鏡發現銀河系中存黑洞。所以從微小原子到宏觀宇宙,科學觀點的獲得既要有合理的邏輯推理,又要有嚴謹的科學實驗證據。這就是人類研究自然的基本論證方法。
五、反思與討論
素養本位的課堂教學旨在教授科學家思維而不是科學家結論。本課將史料和實驗作證據推理的載體,重點是在湯姆孫、盧瑟福和波爾三個探究階段充分展開探究、合作與生成活動;通過模型構建、模型應用和模型修正有助于學生對學科本質的理解,學生更能夠深刻理解原子結構研究需要實驗法、模型法、類比法、猜想法等多種思想方法。呈現湯姆孫和盧瑟福的研究過程,使學生加深對原子組成的理解,介紹波爾的研究可使學生對原子結構示意圖理解升級,尤其是學生親身進行光譜實驗探究,有助于學生對原子結構理論發展的理解,懂得科學理論是在不斷改進中前進的,最終形成能夠相對完美解釋自然世界的理論。
利用化學史料與真實實驗重現進行論證式教學,有助于學生的核心概念轉變。原子結構是抽象的、不可見的,勢必在學習過程中產生迷思概念,經過證據收集、推理論證修正原有原子結構模型,在體驗科學研究過程中能糾正偏差認知,正確理解科學模型的內涵,從而滲透證據推理與模型認知化學核心素養。
參考文獻
[1][3]中華人民共和國教育部.普通高中化學課程標準(2017年版2020年修訂)[S].北京:人民教育出版社,2020:18,72
[2][14]馬青.基于化學史的原子結構教學實踐研究[D].銀川:寧夏大學,2019:7,21
[4]蔣永貴,吳俊明.新課程背景下的數字化實驗室及其在中學理科教學中的應用[J].中國電化教育,2006(11):45-48
[5]林建芬等.化學“四重表征”教學模式的理論建構與實踐研究——從15年數字化手持技術實驗研究的回顧談起[J].化學教育,2015,36(7):1-6
[6]彭豪.基于POE策略的高中化學“四重表征”概念教學研究[J].化學教學,2011(10):24-27
[7]吉田隆嘉[日]曹逸冰譯.走進奇妙的元素周期表[M].海口:南海出版公司,2017:25-27
[8]宗棕,劉兵.盧瑟福原子結構理論中“核”隱喻的提出——一項科學文本的修辭分析[J].科學技術哲學研究,2012,29(3):13-17
[9][13]林承志.化學之路——新編化學發展簡史[M].北京:科學出版社,2011:100-101,215
[10]道爾頓李家玉等譯.化學哲學新體系[M].武漢:武漢出版社,1992:120
[11]宋德生.從陰極射線的爭議到電子的發現[J].物理,1987(5):311-316
[12]汪紀苗.“原子結構模型的演變和原子的構成”第一課時教學設計[J].化學教學,2010(12):32-35

