矽肺模型大鼠肺組織及血清中瓜氨酸化組蛋白H3等的表達及其意義
周靜月 蘇陽2 張小凡 張銘 趙鵬3 邢廣群
(青島大學附屬醫院,山東 青島 266555 1 腎內科; 2 心內科; 3 檢驗科)
矽肺病是由于肺部吸入大量游離的SiO2顆粒所引起,以肺部炎癥、肺纖維化和肺功能障礙為特征[1]。進入肺內SiO2顆粒無法排出,引起肺部持續炎癥反應,導致免疫平衡紊亂,因此矽肺患者常常伴有肺部腫瘤、肺結核和自身免疫性疾病等并發癥[2]。轉化生長因子-β1(TGF-β1)是目前最有效的促纖維化細胞因子,主要由肺泡巨噬細胞、肺泡上皮細胞分泌,刺激成纖維細胞增殖和激活,促進肌成纖維細胞形成,是參與肺纖維化發展的關鍵因子[3]。白細胞介素-6(IL-6)是由活化的T細胞和成纖維細胞產生的多功能細胞因子,可能參與致炎和致纖維化等過程[4]。BRINKMANN等[5]于2004年首次提出,中性粒細胞受病原體激活可釋放網狀物質來殺滅病原菌,并將這種網狀物質命名為中性粒細胞胞外誘捕網(NETs)。NETs是以DNA為骨架的纖維網狀結構,除包裹著髓過氧化物酶(MPO)以及中性粒細胞彈性蛋白酶以外,還含有瓜氨酸化組蛋白H3(CitH3)、組織蛋白酶G、防御素、殺菌/通透性增強性蛋白,其中CitH3是NETs的標志物。MPO是含血紅素輔基的過氧化物酶,存在于髓系細胞(主要是中性粒細胞和單核細胞)的嗜苯胺藍顆粒中,是髓系細胞發揮固有免疫功能的重要標志物[6]。研究顯示MPO參與了矽肺肺組織的炎癥反應,過量的MPO產生的氧化劑可誘導肺組織發生氧化性損傷[7]。本研究擬采用氣管內注入SiO2顆粒的方法建立矽肺纖維化實驗模型,探討CitH3、MPO、IL-6和TGF-β1在矽肺發生中的作用及其機制,以期為矽肺患者的治療提供新的理論和實驗依據。
1 材料與方法
1.1 實驗動物
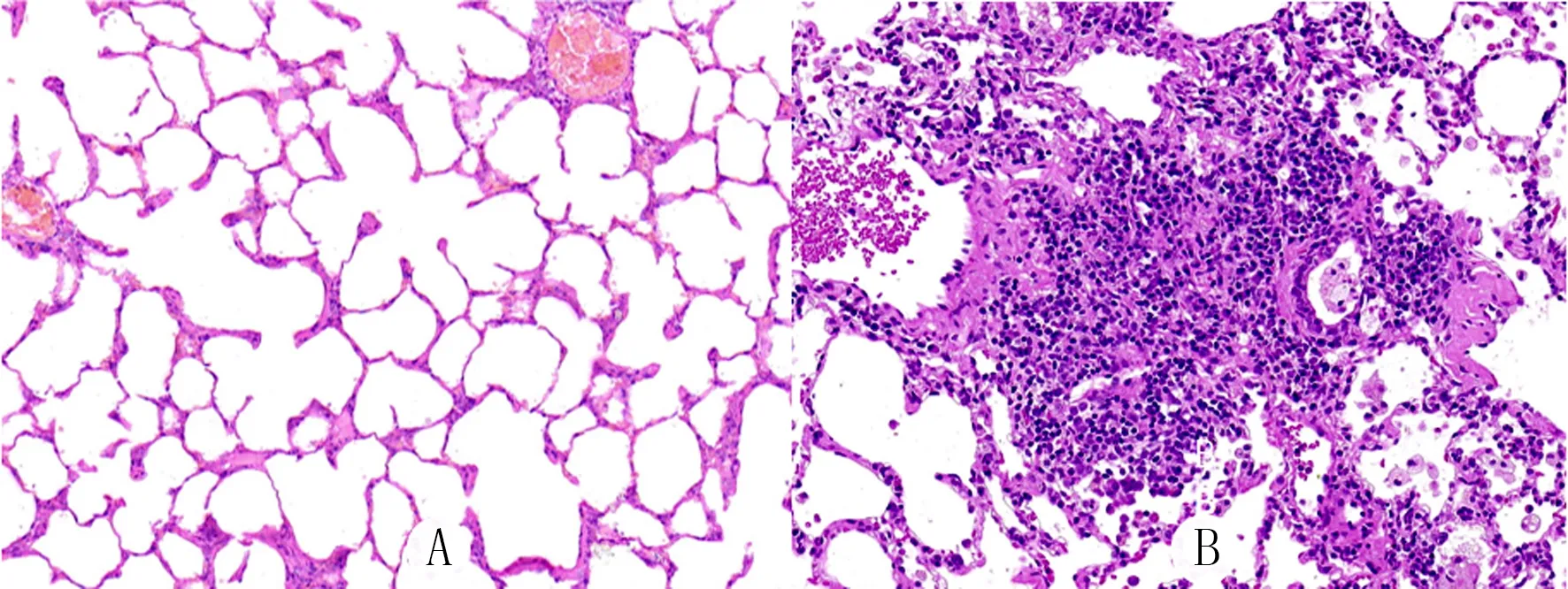
SPF級健康雄性Wistar-Kyoto大鼠30只,6~8周齡,體質量(200±20)g,購自北京維通利華實驗動物技術有限公司,隨機分為矽肺組和對照組,每組15只大鼠,飼養于青島大學附屬醫院動物實驗中心。大鼠的處理規程獲得青島大學動物保護和使用委員會認證,動物護理和實驗操作程序符合美國國立衛生研究院制定的《實驗動物管理與使用指南》倫理標準及動物倫理委員會指導方針。
1.2 主要試劑
SiO2顆粒(S817558,上海麥恪林生化科技有限公司),CitH3抗體(Ab219406,英國Abcam公司),MPO單克隆小鼠抗體(Ab90810,英國Abcam公司),Alex Fluor?488標記山羊抗兔抗體(GB25303,武漢賽維爾生物科技有限公司),Cy3標記山羊抗小鼠IgG(GB210301,武漢賽維爾生物科技有限公司);EDTA(pH 8.0)抗原修復液、大鼠TGF-β1 ELISA試劑盒、DAPI染液、IL-6 ELISA試劑盒(武漢華美生物工程有限公司);將SiO2顆粒和生理鹽水混合配置成濃度為50 g/L的SiO2混懸液,經高壓滅菌后加入青霉素2 000 U備用。
1.3 方法
1.3.1大鼠矽肺模型的建立及兩組的處理 參照程燚等[8]的方法制備大鼠矽肺模型。大鼠麻醉固定后,消毒頸部皮膚,沿頸部正中線切開5~7 mm,暴露氣管。矽肺組大鼠氣管內一次性注入預配好的SiO2混懸液1 mL,對照組大鼠氣管內一次性注入等體積的高壓蒸汽滅菌的生理鹽水1 mL,縫合傷口,待大鼠蘇醒后置于動物房常規飼養。兩組大鼠均于第28天時麻醉后采集腹主動脈血,以3 000 r/min離心10 min收集血清;然后處死大鼠剝離出肺臟,用生理鹽水清洗以后,觀察肺臟形態同時稱肺臟濕質量,計算肺臟器系數,肺臟器系數=肺組織濕質量(mg)/體質量(g)。
1.3.2肺組織病理組織學觀察 將大鼠的肺組織以40 g/L的多聚甲醛固定,石蠟包埋后,制作5 μm厚切片,行HE染色,由青島大學附屬醫院高年資病理醫師于光學顯微鏡下觀察大鼠肺組織病理情況。
1.3.3ELISA法檢測大鼠血清中TGF-β1、IL-6以及CitH3水平 采用ELISA試劑盒按照雙抗夾心法檢測大鼠血清中TGF-β1、IL-6以及CitH3的水平,并于酶標儀上在波長450 nm處測量各孔的吸光度值,根據標準品的濃度以及對應的吸光度值計算出TGF-β1、IL-6及CitH3的水平。
1.3.4免疫熒光染色法檢測大鼠肺組織中CitH3和MPO的表達 肺組織切片脫蠟至水后,置于抗原修復緩沖液中,微波爐內行抗原修復,自然冷卻后置于PBS中,然后于脫色搖床上晃動洗滌3次,每次5 min。稍甩干后置于濕盒中,加入自發熒光淬滅劑中5 min,流水沖洗10 min,再滴加山羊血清封閉組織中非特異性抗原60 min。然后輕輕甩掉封閉液,在切片上滴入稀釋好的CitH3(1∶50)以及MPO(1∶50),切片平放于濕盒內4 ℃孵育過夜。然后將切片置于PBS中,然后在脫色搖床上晃動洗滌3次,每次5 min。稍甩干后滴加Alex Fluor?488標記山羊抗兔抗體(1∶400)以及Cy3標記的山羊抗小鼠IgG(1∶300)覆蓋組織,避光室溫孵育50 min,染色完成以后在搖床上晃動洗滌3次,每次5 min。待切片稍干后,滴加DAPI染液,避光孵育10 min。切片于PBS中洗滌3次,每次5 min。干燥后,用抗熒光淬滅封片劑封片。置于熒光顯微鏡下觀察切片并采集圖像。
1.4 統計學方法
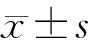
2 結 果
2.1 兩組大鼠肺臟器系數比較
飼養期間兩組大鼠均無意外死亡。大體觀察可見,對照組大鼠肺組織呈粉紅色,柔軟有彈性;矽肺組大鼠肺組織表面呈灰白色,質地堅硬且彈性差,切面有磨砂感。對照組和矽肺組大鼠肺組織濕質量分別為(3.07±0.64)、(4.01±0.40)g,肺臟器系數分別為3.88±1.44、6.37±2.81,與對照組相比,矽肺組肺組織濕質量以及肺臟器系數均顯著高于對照組(t=-4.10、-3.06,P<0.05)。
2.2 兩組大鼠肺組織病理學檢查結果比較
HE染色切片顯示,對照組大鼠肺組織結構清晰,無炎性細胞浸潤(圖1A);矽肺組大鼠肺組織可見各種炎癥細胞浸潤和增生,肺泡間隔增厚,正常肺泡結構明顯減少(圖1B)。
A:對照組大鼠肺組織,B:矽肺組大鼠肺組織,HE染色,200倍
2.3 兩組大鼠血清中TGF-β1、IL-6及CitH3表達水平比較
矽肺組大鼠血清中CitH3、TGF-β1及IL-6水平與對照組比較明顯升高(t=-29.85~-3.22,P<0.05)。見表1。
表1 兩組大鼠血清中CitH3、IL-6和TGF-β1表達水平比較
2.4 兩組大鼠肺組織中CitH3和MPO比較
熒光顯微鏡下觀察顯示,矽肺組肺組織中紅色熒光免疫反應陽性產物MPO和綠色熒光免疫反應陽性產物CitH3較對照組明顯增加(圖2)。
3 討 論
矽肺通常是由于長期吸入大量游離性的SiO2顆粒所引起,以肺部廣泛的結節性纖維化為主要特征。目前,矽肺的發病機制尚未明確,因此探討其發病機制及尋找有效的治療藥物非常重要。RADA[9]研究發現,SiO2顆粒可刺激外周血中性粒細胞產生大量的NETs,且與SiO2顆粒的濃度具有劑量相關性,提示NETs在SiO2顆粒所致矽肺發生中發揮著重要作用。當機體長期暴露于SiO2顆粒環境中時,SiO2顆粒易經氣道沉積于肺組織中,激活肺泡巨噬細胞的吞噬功能,產生大量的炎癥因子與氧化應激產物[10-11]。大量因子的持續增加進一步導致神經細胞和成纖維細胞的持續招募,繼而產生過量的膠原和纖維連接蛋白,促進肺組織纖維化[12]。矽肺患者與矽肺動物模型肺泡灌洗液中均發現有大量的中性粒細胞,當降低肺泡灌洗液中的中性粒細胞水平后,矽肺損傷程度隨之減輕,提示NETs可能參與了SiO2顆粒誘導的小鼠矽肺模型肺部炎癥損傷與纖維
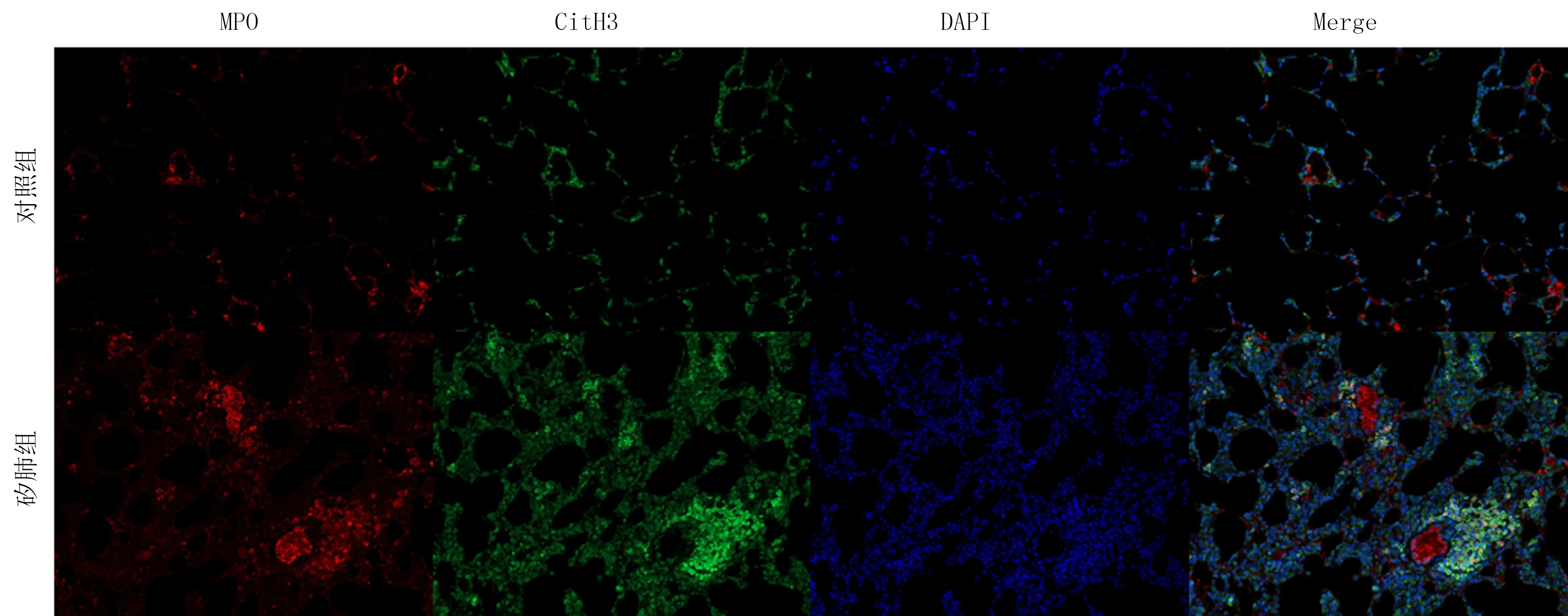
CitH3染色呈綠色,MPO染色呈紅色,DAPI染色呈藍色,免疫熒光染色,200倍
化的過程[13-14]。
中性粒細胞在受到細胞因子、病原微生物或一些化合物的刺激時,會形成以染色質DNA為骨架、包裹著顆粒蛋白(如MPO和中性粒細胞彈性蛋白酶)的NETs網狀結構,這種網狀結構具有抵抗病原菌入侵的作用,但NETs過度產生時可致組織細胞損傷和強烈的炎癥反應[15]。本研究以氣管內注入SiO2混懸液的方法建立大鼠矽肺模型,免疫熒光染色法檢測顯示,大鼠肺組織中CitH3和MPO表達水平均顯著升高,說明CitH3和MPO可能參與了大鼠矽肺纖維化的過程。本研究結果顯示,矽肺組大鼠的部分肺組織發生實變,HE染色切片顯示肺組織內有淋巴細胞和巨噬細胞浸潤,肺泡腔內充滿炎性滲出物,出現明顯的肺纖維化,與先前的研究結果一致[16]。同時ELISA方法檢測顯示矽肺組大鼠血清中CitH3、TGF-β1及IL-6水平較對照組明顯升高。IL-6是一種多效應的細胞因子,主要由巨噬細胞和T細胞分泌,參與機體的炎癥反應、免疫應答、創口修復[17]。同時IL-6還具有促進膠原蛋白聚集和肺成纖維細胞增殖的作用[18]。TGF-β1是組織纖維化的重要調節因子,主要通過激活其下游的Smad信號通路,引發促纖維化基因過表達,致瘢痕組織形成。已研究證實,TGF-β1/Smad通路失調是組織纖維化的重要致病機制[19]。有研究發現矽肺病患者支氣管肺泡灌洗液中NETs含量越高,患者病情越重,肺功能損害越重[20]。研究發現NETs促進纖維化發生的機制可能與促進纖維母細胞分化以及加速細胞外基質合成有關[21]。以上研究均表明CitH3、MPO、TGF-β1及IL-6可能參與大鼠肺組織纖維化的過程。
綜上所述,SiO2顆粒可能通過激活中性粒細胞釋放CitH3和MPO以及促進TGF-β1、IL-6等相關因子的表達來加重矽肺大鼠肺組織炎癥與纖維化的發生。CitH3和MPO、TGF-β1和IL-6水平的升高可能是致肺組織炎癥和纖維化的重要因素。

