鼠傷寒沙門菌烈性噬菌體的分離鑒定與生物學特性
何依蓉,張奕杰,楊 偉,陳曉聰,張家翔,陳培富
(云南農業大學動物醫學院, 昆明 650201)
沙門菌(Salmonellaspp.)是食物污染中常見的致病菌。全球每年因沙門菌引起的傷寒及胃腸炎病例約有13億例[1-2]。其中,鼠傷寒沙門菌具有廣泛的致病性,分離率居高不下,耐藥性也日趨突出,是具有重要公共衛生意義的人獸共患病原菌[2]。在當前我國實施禁止飼料預防性添加抗生素的政策形勢下,積極發展噬菌體制劑用于耐藥性鼠傷寒沙門菌引起的感染治療或對環境、食品的污染控制,具有重要的現實意義和應用價值。噬菌體廣泛分布于自然環境。據估計,噬菌體的豐度為106~108·mL-1,這為人類提供了一個豐富的天然抗菌資源庫[3-4]。其中,烈性噬菌體作為一種能夠高效裂解細菌的病毒,具有高度的宿主特異性,只裂解特定種及型的宿主菌,因此它們不會破壞環境中的其他微生物[5],也不會破壞腸道正常菌群結構,有望替代抗生素用于防治細菌性感染[6]。美國食品和藥物管理局批準了一種由噬菌體混合而成的食品添加劑,能夠有效殺滅食物中的多型李斯特桿菌[7]。本試驗擬以前期自行分離自散裝鮮牛奶樣品的一株鼠傷寒沙門菌為宿主菌,分離相應的烈性噬菌體,并對其生物學特性進行研究,以及評價其在動物體內防治疾病的效力。
1 材料與方法
1.1 材料
武定雞3只,分籠飼養;BALB/c小鼠100只(雌雄各半),均為健康動物。細菌培養基購自環凱生物有限公司。宿主菌ND104由本實驗室分離自散裝牛奶并保存。細菌DNA提取試劑盒和膠回收試劑盒購自生工生物工程有限公司。腸炎沙門菌參考菌株ATCC13076購自中國菌種保藏中心,其他受試菌株由本實驗室分離并保存。
1.2 噬菌體的富集
3只試驗雞連續7 d每日灌服鼠傷寒沙門菌懸液1 mL (1.04×109CFU)。隨后參照Mclaughlin等[8]報道的方法富集噬菌體,即7 d后取1.0 g混合糞樣加入5 mL LB液體培養基,充分混勻,自然沉降10 min,取上清用滅菌濾紙過濾。濾液經12 000 r·min-1離心10 min,以0.22 μm孔徑的滅菌濾膜再次過濾,取2 mL收集的液體與10 mL處于對數生長期(OD600 nm= 0.6)的鼠傷寒沙門菌懸液混勻。37 ℃,170 r·min-1搖床振蕩培養過夜,12 000 r·min-1離心10 min,取上清液重復3次富集培養操作,最后用0.22 μm微孔濾膜過濾以除去殘留的細菌細胞,以獲取含噬菌體的原液,分裝,4 ℃ 保存備用。
1.3 噬菌體的分離與純化
將20 μL噬菌體原液與500 μL對數生長期鼠傷寒沙門菌懸液混勻,加入5 mL冷卻至50 ℃的含7 g·L-1瓊脂的LB培養基,倒至預先凝固的LB平板上制成雙層平板,37 ℃倒置培養過夜。挑取單個噬菌斑,接種于菌液,37 ℃、170 r·min-1振蕩培養12 h,取樣制成雙層平板進行純化,反復純化2~3次。
1.4 噬菌體生物學特性分析
1.4.1 噬菌體效價測定 以LB培養液對純化噬菌體液進行10倍連續稀釋,各取10 μL稀釋液與10 μL宿主菌懸液混合,靜置3 min,迅速制成雙層平板,37 ℃倒置培養過夜,取噬菌斑數在30~300的平板計數,計算噬菌體效價。噬菌體效價(PFU·mL-1)= 噬菌斑數×稀釋倍數×100[9]。
1.4.2 噬菌體核酸類型鑒定及其宿主譜分析 參照《分子克隆實驗指南》提取噬菌體基因組[10],于-20 ℃條件下保存備用。分別加入RNase A和DNase Ⅰ進行處理核酸樣品,37 ℃溫育30 min;分別使用限制性內切酶SacⅠ、EcoR Ⅴ、EcoR Ⅰ對噬菌體基因組進行酶切,隨后點樣5 μL于10 g·L-1瓊脂糖凝膠做電泳分析。根據酶切圖譜,估算病毒基因組大小。將噬菌體溶液滴加于單層細菌培養物表面,培養12 h,觀察噬菌體對各受試菌株的裂解情況,確定其宿主譜。
1.4.3 噬菌體最佳感染比(MOI) 將噬菌體與鼠傷寒沙門菌混勻成1∶100、1∶10、1∶1、10∶1、100∶1的不同比例,37 ℃孵育3 min,8 000 r·min-1離心5 min,棄上清,用5 mL LB液體培養基輕輕吹打重懸菌體,37 ℃ 170 r·min-1振蕩培養2 h,12 000 r·min-1離心2 min,用0.22 μm微孔濾膜過濾,取上清,按“1.3”方法灌制雙層平板測定噬菌體滴度,最佳感染比為產生最高噬菌體滴度的比例[11-12]。試驗重復3次,每次設兩個平行(下同)。
1.4.4 噬菌體一步生長曲線 將噬菌體與鼠傷寒沙門菌按最適MOI值混勻,37 ℃孵育5 min,4 000 r·min-1離心5 min,立即棄上清,以液體LB培養基輕洗沉淀,然后,加入液體LB培養基置于恒溫水浴振蕩器,37 ℃、180 r·min-1培養2 h,以開始培養記作0 min,于不同時間點取樣測定噬菌體效價,試驗重復3次。以感染時間為橫坐標,噬菌體效價的對數為縱坐標,取效價平均值繪制一步生長曲線圖,并計算噬菌體裂解量,裂解量=裂解末期噬菌體滴度/初期宿主菌濃度[13]。
1.4.5 噬菌體熱穩定性和酸堿穩定性 取5 mL新鮮噬菌體溶液(1×107PFU·mL-1)分別于20、30、40、50、60、70、80 ℃水浴鍋孵育1 h,迅速冷卻樣品,取樣制雙層平板測定噬菌體效價,每組重復3次[14]。 將緩沖蛋白胨水(BPW)pH分別調整為1、2、4、6、7、8、10和12,與噬菌體(1×107PFU·mL-1)按9∶1體積比分別混合,37 ℃孵育1 h,雙層平板法測定噬菌體效價,每組重復3次[15]。
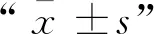
2 結 果
2.1 噬菌體的分離純化及其效價
采用雙層平板法分離純化出1株鼠傷寒沙門菌烈性噬菌體,命名為KM104。該噬菌體在雙層瓊脂平板上形成清晰圓形空斑,噬菌斑直徑在1 mm左右(圖1)。

圖1 噬菌體KM104形成的噬菌斑Fig.1 The plaques produced by phage KM104
2.2 噬菌體核酸類型及宿主譜
KM104噬菌體核酸經DNase Ⅰ處理后完全降解,而不被RNase A降解,表明核酸類型為DNA。基因組能被限制性內切酶EcoRⅠ消化為多個片段,根據酶切片段大小估算基因組大小約為28 kb。
噬菌體KM104能有效裂解YS7、ND104 2株鼠傷寒沙門菌;也能裂解YN2、YS4、YS2、YS6 4株沙門菌,但效果不理想。詳情見表1。
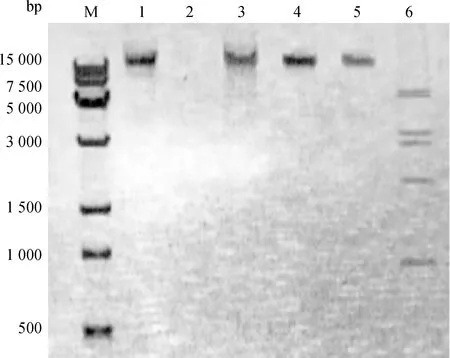
M. 15 kb相對分子質量標準; 1. KM104基因組; 2. DNase 處理基因組; 3. RNase A處理基因組; 4. Sac Ⅰ酶切基因組; 5. EcoR Ⅴ酶切基因組; 6. EcoR Ⅰ酶切基因組 M. 15 kb molecular marker; 1. Genome of phage KM104; 2. DNase Ⅰ treated genome; 3. RNase A-treated genome; 4. Sac Ⅰ digested genome; 5. EcoR Ⅴ digested genome; 6. EcoR Ⅰ digested genome圖2 噬菌體KM104核酸類型及酶切電泳分析Fig.2 The electrophoresis analysis of nucleic acid type of phage KM104 and enzyme digestion
2.3 噬菌體最佳感染比(MOI)
噬菌體KM104的MOI為1∶10時,產生子代噬菌體的效價最高,達4.6×108PFU·mL-1,故1∶10 是KM104擴增時的最適MOI值(表2)。
2.4 噬菌體一步生長曲線
在最佳感染比(MOI=0.1)條件下測定噬菌體的一步生長曲線(圖3),顯示噬菌體KM104與宿主菌作用6 min后效價顯著升高,表明KM104潛伏期為6 min,而后效價平穩持續上升,一直持續到70 min。 噬菌體裂解量為41(1.31×108/3.2×106)。
2.5 噬菌體熱穩定性和酸堿穩定性
噬菌體KM104經20~60 ℃水浴處理1 h后效價基本不發生改變,但經70 ℃處理1 h后效價下降約70%,80 ℃處理 1 h后完全失活(圖4)。
在pH 2.0~8.0時,噬菌體KM104效價與初始效價無顯著變化,維持良好的裂解活性,但當pH達到10以上,噬菌體活性快速下降,pH達12時噬菌體活性完全消失,表明噬菌體KM104耐酸性強,不耐強堿性環境(圖5)。

表1 KM104宿主譜
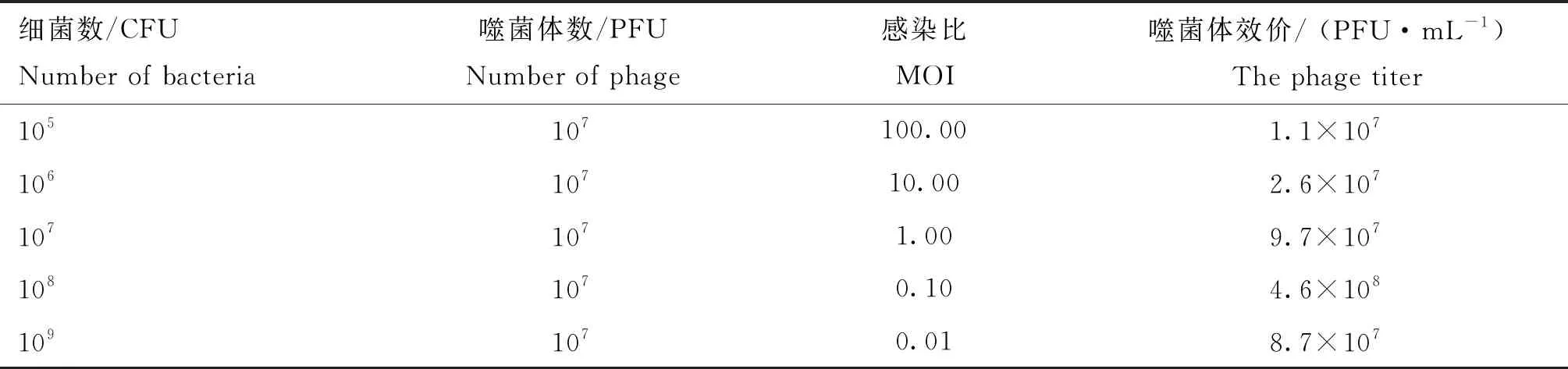
表2 噬菌體KM104最佳感染比測定
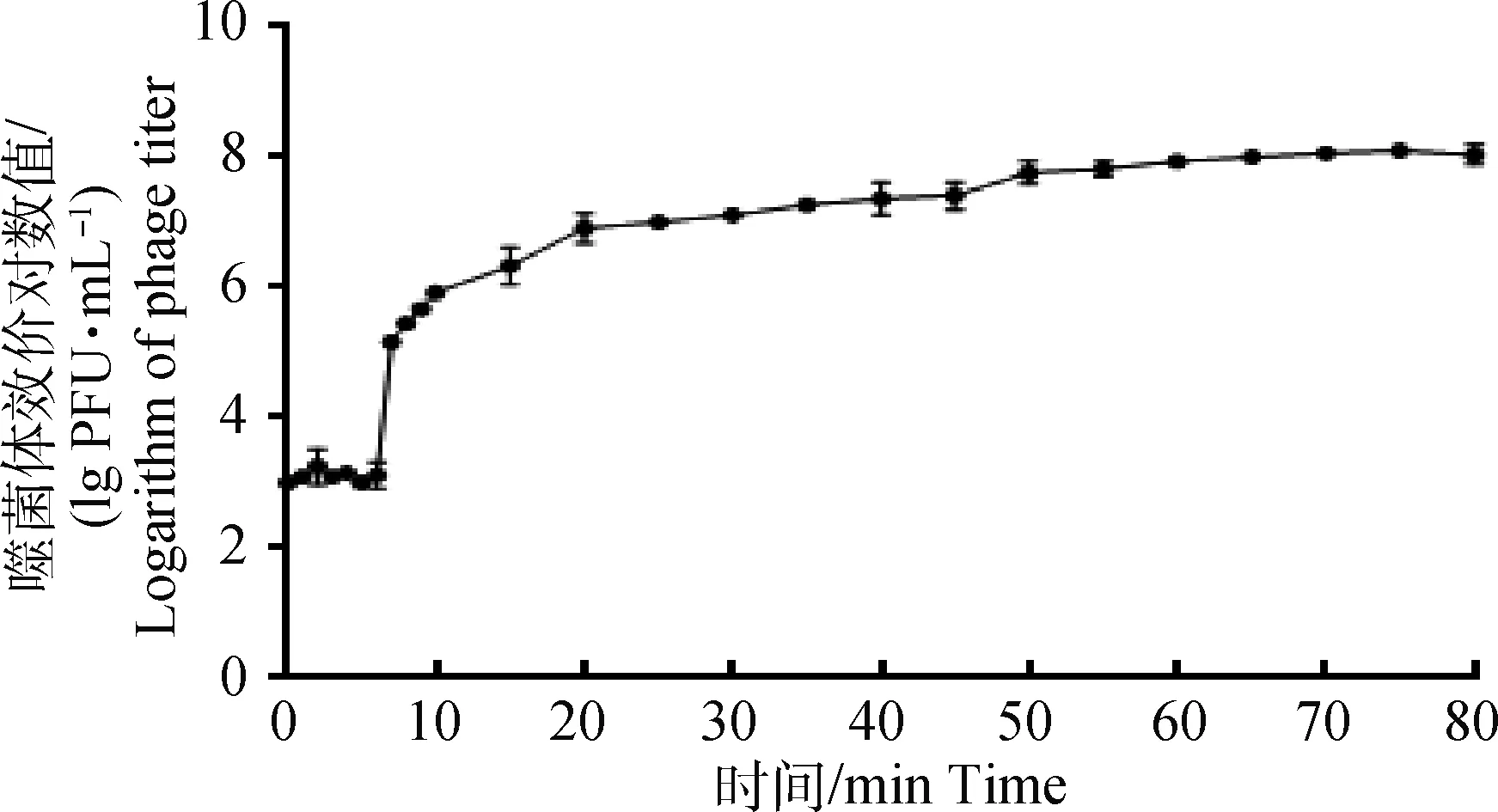
圖3 噬菌體KM104一步生長曲線Fig.3 The one-step growth curve of phage KM104
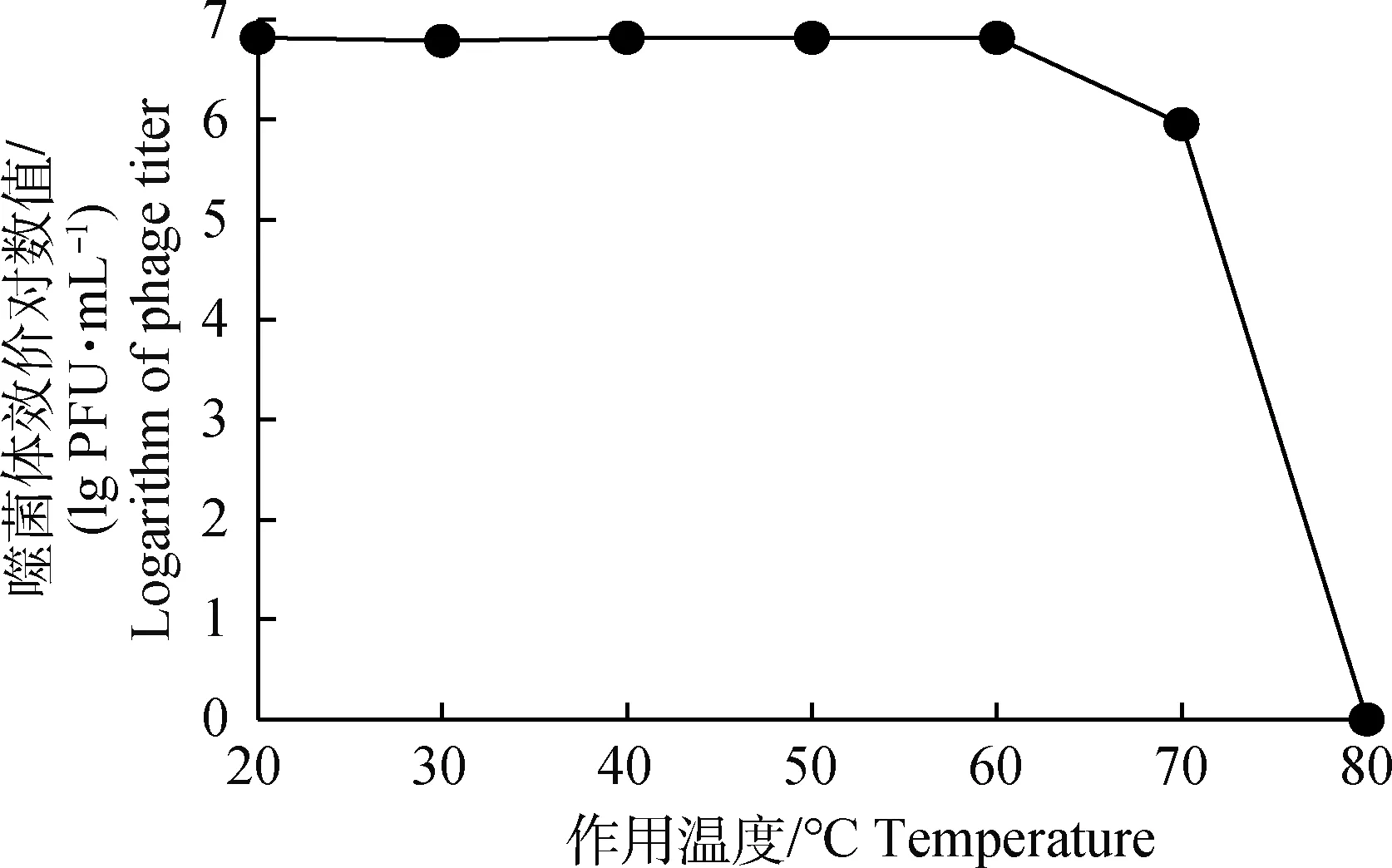
圖4 噬菌體KM104熱穩定性Fig.4 The thermal stability of phage KM104
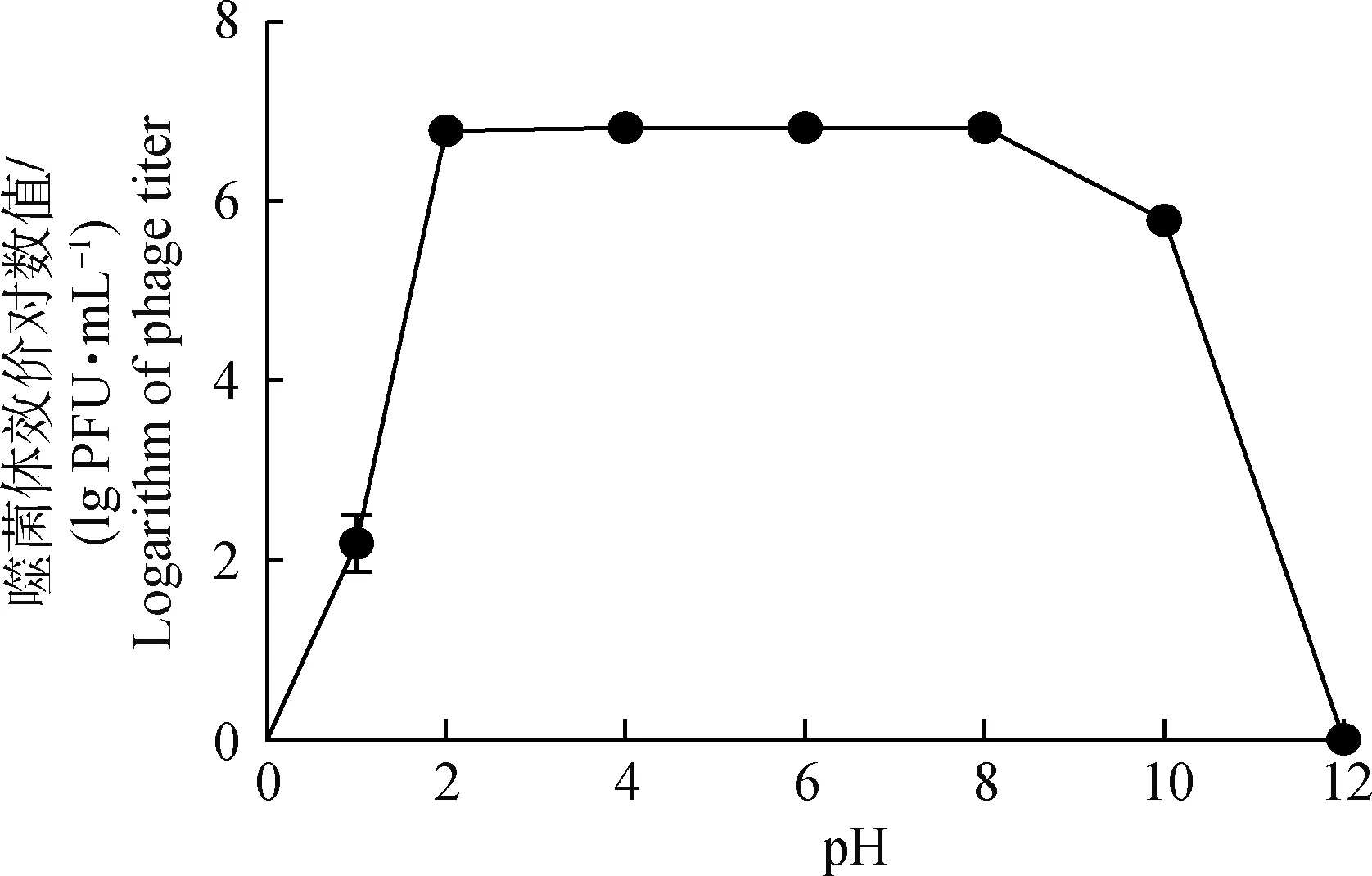
圖5 噬菌體KM104 pH穩定性Fig.5 The pH stability of phage KM104
2.6 噬菌體體內裂解能力
感染未治療組小鼠24 h開始出現死亡,剖檢發現鼠肝、脾腫大充血,腸系膜靜脈充血,部分腸道壞死;感染治療組小鼠72 h內未見死亡,剖檢僅見脾輕微充血,腸腔內有少量黃色漿液性內容物;未感染治療組小鼠72 h內未見死亡,剖檢僅見腸腔內容物增多(圖6)。
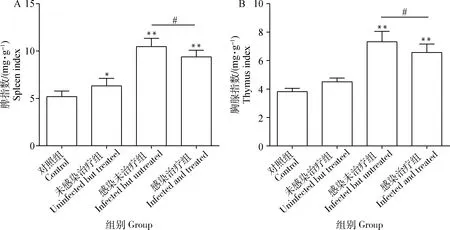
感染未治療組及感染治療組小鼠脾指數和胸腺指數與對照組差異極顯著(P<0.01);未感染治療組小鼠脾指數和胸腺指數略高于對照組,但差異不顯著(P>0.05)(圖7)。
小鼠十二指腸切片經HE染色后鏡檢發現,感染未治療組小鼠十二指腸黏膜下層毛細血管擴張充血及出血,腸腺細胞質深染,腸絨毛結構不完整,絨毛上皮嚴重脫落,固有層有炎性細胞(淋巴細胞和巨噬細胞為主)浸潤;感染后治療組小鼠十二指腸小腸絨毛僅有少量脫落,絨毛上皮有少量的杯狀細胞,少量充血和炎性細胞。未感染治療組與對照組,十二指腸形態完整,結構清晰,細胞質染色均勻(圖8)。與對照組相比,感染未治療組十二指腸絨毛高度和腺窩深度降低,差異極顯著(P<0.01),而噬菌體治療可顯著改善沙門菌誘導的這種降低(圖9)。
3 討 論
本試驗前期嘗試在污水溝、池塘、雞場堆糞坑等多處采樣分離噬菌體,均未獲得成功,究其原因可能與噬菌體密度小和宿主譜狹窄有關。之后通過給雞提供人為添加宿主菌株的飲水以誘導相應噬菌體在體內增殖,成功從試驗雞糞便中分離得到1株鼠傷寒沙門菌烈性噬菌體。該株噬菌體(KM104)能夠裂解鼠傷寒沙門菌,但對甲型副傷寒沙門菌裂解作用明顯較弱,未見其裂解腸炎沙門菌,表明該株噬菌體有較強的宿主特異性。若應用于動物生產,針對其宿主譜較窄的不足,可與其他噬菌體合用,或對控制噬菌體裂菌譜的基因片段進行基因工程改造以增加其裂菌譜[16]。

1. 感染未治療組; 2. 感染后治療組; 3. 未感染治療組; 4. 對照組。A. 肝; B. 脾; C. 胃及腸道 1. The infected but untreated group; 2. The infected and treated group; 3. The uninfected but treated group; 4. The control group; A. Liver; B. Spleen; C. Stomach and intestine圖6 不同處理組小鼠病理變化(部分樣品)Fig.6 The gross lesion in groups of mice with different treatment (partial samples)
#.0.01 A. 對照組; B. 未感染治療組; C. 感染未治療組; D. 感染治療組 A. Control group; B. Uninfected but treated group; C. Infected but untreated group; D. Infected and treated group圖8 不同處理組十二指腸HE染色(400×)Fig.8 HE staining of the duodenum in groups with different treatment (400×) 噬菌體KM104在pH為2~8效價保持穩定,即使在pH為1的強酸性條件下仍能保留一定活性,鑒于動物胃酸通常保持pH≥2.2,這將利于該噬菌體的口服應用,其耐酸堿能力強于SP17、T139、SLMP1等噬菌體[17-19];噬菌體KM104的熱穩定性也明顯優于Pst87170、PS11等噬菌體[20-21]。 在測定噬菌體生長曲線時,按最適MOI混勻噬菌體與菌液后需37 ℃孵育10~15 min[22-24],使噬菌體吸附于宿主菌,離心后洗滌菌體沉淀,再繼續進行培養,按培養時間測定噬菌體效價。但本試驗嘗試分別孵育10、15 min后測定噬菌體效價,均已錯過噬菌體潛伏期的測定時間,后將孵育時間縮短為5 min,成功測出噬菌體潛伏期,約為6 min。表明KM104吸附期及潛伏期較短,能在短時間內開始釋放子代噬菌體。 本試驗采取腹腔注射,使用噬菌體KM104治療鼠傷寒沙門菌感染的小鼠,結果顯示,感染治療組小鼠存活率較感染未治療組提高75%,優于趙影等[25]報道的沙門菌噬菌體治療效果;小鼠病理剖檢及十二指腸組織切片染色觀察可發現,使用噬菌體治療能減少感染鼠傷寒沙門菌引起的十二指腸損傷,且高效價的KM104對小鼠無明顯毒性,表明噬菌體KM104對鼠傷寒沙門菌感染具有良好治療效果。 通過給雞飼喂含鼠傷寒沙門菌的飲水,隨后從其糞便中分離到1株鼠傷寒沙門菌噬菌體(KM104),該噬菌體潛伏期短,增殖迅速,熱穩定性及酸堿耐受性良好,并在小鼠表現出較好的治療效果,顯示其具有應用于生物防治的前景。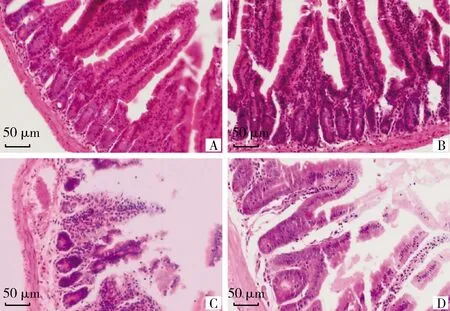
4 結 論

