復發性阿弗他口腔炎組織中基因異常表達分析
穆艷超,陳新
(安陽市婦幼保健院 a.檢驗科;b.口腔科,河南 安陽 455000)
復發性阿弗他口腔炎(recurrent aphthous stomatitis,RAS)是常見的口腔黏膜疾病,具有周期復發的特點。RAS多發于舌、腭、唇、頰等處,主要表現為圓形、橢圓形、孤立的淺表性潰瘍,可出現顯著的灼燒感,飲食和說話可致疼痛加劇,不適感可影響患者飲食、言語,降低患者生活幸福感[1]。該病是國內外研究的熱點,但因其發病機制尚不明確,治療手段主要以抑制炎癥加重、緩解疼痛、促進潰爛愈合、延長疾病發作間歇期為目的,尚缺乏有效的治療手段[2]。研究顯示,有超過1/3的RAS患者具有顯著的遺傳易患性,人類白細胞抗原A2表型與RAS發生具有顯著相關性,血凝素基因缺陷患者的RAS發病率高達56%,葉酸代謝通路基因表達異常的人群RAS患病率顯著高于正常人群,細胞因子基因高表達的人群中RAS的發病率高于低表達人群[3-5]。本研究通過生物信息學分析篩選候選基因,并驗證JAK2、STAT3、IL-6、SOCS3、CXCR4在RAS組織中異常表達情況。
1 資料與方法
1.1 一般資料選取2019年9月至2020年10月安陽市婦幼保健院口腔科收治的25例RAS患者,取其病灶組織作為觀察組。納入標準:(1)病史1 a以上,1 a發作2次以上;(2)無其他口腔疾病,就診前3 d內未服用抗生素、止痛藥、免疫抑制劑等藥物;(3)年齡15~35歲。選取同期25例拔牙者智齒附著組織為對照組。對照組:男12例,女13例;年齡21~35歲,平均(26.9±2.0)歲。觀察組:男12例,女13例;年齡16~35歲,平均(25.7±2.3)歲。兩組性別、年齡比較,差異無統計學意義(P>0.05)。本研究經安陽市婦幼保健院醫學倫理委員會批準。納入研究者均簽署知情同意書。
1.2 高通量測序數據的處理高通量測序數據從National Center for Biotechnology Information(NCBI)Gene Expression Omnibus(GEO)數據庫(http://www.ncbi.nlm.nih.gov/geo/)獲取,測序系列號為GSE37265。該數據集中共包含14例RAS患者,分別采集患者的潰瘍組織、正常組織,提取總RNA,按照Affymetrix標準操作規程對RNA進行片段化、端部修復、連接和聚合酶鏈式反應(polymerase chain reaction,PCR)擴增建庫,使用Affymetrix Human Genome U133 Plus 2.0 Array對文庫進行測序。
1.3 差異表達基因(differentially expressed genes,DEGs)的篩選建立篩選條件:-log10P>-log100.05;|log2Fold Change|>1。log2Fold Change>1為高表達基因,log2Fold Change<-1為低表達基因。
1.4 基因富集的分析利用DAVID在線軟件分析DEGs富集情況。DAVID被用于信號通路Kyoto Encyclopedia of Genes and Genomes(KEGG)的分析。通過DAVID軟件計算各富集組的P值。
1.5 實時熒光定量聚合酶鏈式反應(real-time quantitative polymerase chain reaction,qPCR)取對照組和觀察組新鮮組織20 mg放入無RNA酶的離心管中,加入4 ℃預冷生理鹽水5 mL,以4 000 r·min-1轉速離心1 min,棄上清。使用4 ℃預冷磷酸鹽緩沖液洗滌,以4 000 r·min-1轉速離心1 min,棄上清。使用核酸提取儀提取總RNA。RNA水平經NanoDrop 2000檢測,OD260/OD280大于1.90可用于后續試驗。用TOYOBO試劑盒進行反轉錄,PCR管中加1 μL Random Primer,加3.0 μg提取的mRNA,用RNase Free H2O補齊至20 μL,反轉錄產物于-80 ℃保存。使用Roche combas z480進行熒光定量PCR,擴增引物由上海生工公司合成。反應體積為25 μL,ACTB為內參基因,每個基因做3個復孔,反應程序:95 ℃ 10 min,95℃ 15 s,64 ℃ 15 s,72 ℃ 30 s,40個循環;37 ℃ 1 min。使用2-ΔΔCt法進行擴增數據分析。
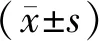
2 結果
2.1 高通量測序數據中不同組織的DEGs對原始數據進行歸一化處理,并對對照組和觀察組的基因表達進行t檢驗分析,共計1 645個DEGs滿足篩選條件(-log10P>-log100.05且|log2Fold Change|>1),其中高表達1 082個,低表達563個。見圖1。

圖1 符合篩選條件的基因倍數與P值負對數分布圖
2.2 DEGs功能分布情況使用DAVID軟件分析DEGs富集最多的5個信號通路為細胞因子-細胞因子受體相互作用通路、PI3K-Akt信號通路、趨化因子信號通路、癌癥通路、單純皰疹病毒感染通路。見表1。

表1 GSE37265中DEGs富集的信號通路情況
2.3 候選基因的篩選情況DEGs導入STRING數據庫進行分析。在蛋白間相互作用(protein-protein interaction,PPI)關系網中,39個基因編碼PPI置信度大于0.995,見表2。39個基因被篩選為候選基因,用于進一步驗證。

表2 GSE37265 DEGs編碼蛋白PPI分析
2.4 qPCR驗證候選基因結果經驗證,觀察組JAK2mRNA相對表達量低于對照組,STAT3mRNA、IL-6mRNA、SOCS3mRNA、CXCR4mRNA相對表達量均高于對照組(P<0.05)。見表3。
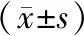
表3 qPCR驗證候選基因mRNA表達情況
3 討論
RAS的發病機制尚未完全明確。研究表明,RAS發病與免疫、遺傳和環境等多種因素有關[6]。維生素B12、葉酸、鋅缺乏以及吸煙、精神壓力、激素和月經周期變化等都可誘發RAS[7]。其發病無顯著季節性,具有自限性、復發性和周期性等特點,炎癥病灶的潰瘍面積不大,病灶中心位置可見表面覆蓋假膜的凹陷[8]。
以往研究表明,RAS患者外周血中細胞免疫指標CD4、CD4/8、CD16+56水平低于對照組,血清免疫指標IgM、CH50、IL-6水平高于對照組,提示RAS患者疾病期細胞免疫功能降低,體液免疫功能發生紊亂[9]。本研究報道JAK2、STAT3、IL-6、SOCS3、CXCR4等多個基因在病灶組織中表達異常,這與以往其他類型炎癥性疾病中發現的DEGs一致[10]。本研究報道的異常表達基因可參與細胞因子-細胞因子受體相互作用通路、PI3K-Akt信號通路、趨化因子信號等多個信號轉導通路,與機體免疫功能的調控密切相關。RAS表現為復發性炎癥性潰爛,參與炎癥過程的細胞因子表達異常或信號通路調節紊亂都不利于RAS的控制。以往研究發現,JAK2和STAT3廣泛表達于多種細胞與組織中,是JAK/STAT信號通路中的關鍵調控因子,與多種疾病發生發展密切相關[11]。本研究證實JAK2mRNA、STAT3mRNA相對表達量與對照組有顯著差異,JAK2和STAT3編碼蛋白表達量變化及其磷酸化程度將對RAS炎癥過程產生重要影響,根據JAK2和STAT3編碼蛋白活化情況調控其表達,糾正信號通路轉導狀態將有利于RAS的控制。SOCS3可通過占據受體磷酸化酪氨酸位點,競爭性阻斷STAT3對受體的招募;SOCS3可與JAK家族蛋白結合,特異性抑制JAK激酶活性,且SOCS3及其蛋白家族其他成員可介導JAK家族蛋白泛素化降解,從而抑制JAK2/STAT3信號通路轉導,導致細胞與組織正常免疫穩態被打破,產生一系列炎癥相關疾病[12]。IL-6是由白細胞產生的細胞因子,在免疫細胞中成熟活化,通過血液運輸至靶細胞發揮調節作用。CXCR4參與JAK2和STAT3磷酸化過程。藥物調節IL-6/JAK2/STAT3信號通路有助于緩解炎癥,促進受損黏膜的修復,減輕組織中炎癥細胞浸潤[13]。研究表明,黃芪建中湯具有抑制潰瘍的作用,可能通過激活JAK2/STAT3通路,調節免疫屏障功能[14]。針對該病的分子靶點藥物尚未開發應用,檢測病灶組織中的分子指標或血清標志物有助于判斷疾病預后。目前,對于RAS的治療仍以抑制炎癥進展、緩解疼痛、降低復發率、延長疾病發作間歇期為目的。基礎醫學的進步將有助于RAS的治療和精準防控,進一步闡明RAS疾病進展的機制是精準治療的前提。炎癥性疾病涉及的信號通路復雜,涉及的分子較多,從發病機制入手糾正RAS病程中分子網絡狀態將有助于實現根治目標。以往研究提示,糾正細胞或者組織分子網絡應綜合評估采取措施的安全性[15],深入挖掘對于RAS進展影響大的致病因子是未來研究的方向。
檢測RAS相關基因有望為解釋疾病發生發展機制提供數據支撐。本研究由于樣本量較小并且未建立動物模型,基因表達差異的調控機制尚未得到深入解釋,更大樣本量和動物模型的建立將有助于基因轉錄調控機制的研究。

