多肉植物抖抖玉露組培快繁技術研究
周陸平,孔雪迪,陳建中,田傳玉,梁桂平,楊 帆
(湖州師范學院 生命科學學院,浙江 湖州 313000)
玉露(Haworthiacooperi)為百合科十二卷屬多年生肉質草本植物[1].玉露植株玲瓏小巧,葉片呈蓮座狀緊湊排列,葉色晶瑩剔透,具有極高的養殖和觀賞價值,深受廣大園藝工作者和消費者的喜愛,具有良好的市場前景和極大的經濟效益[1-2].玉露植株的傳統繁殖方式多為分株繁殖,繁殖系數低、速度慢,不能滿足日益增長的市場需求.因此,建立高效的玉露組培快繁體系具有重要的現實意義,也可為十二卷屬植物的種質資源保存提供理論基礎.雖然近年來已有一些玉露組培快繁方面的研究報道[2-8],但少見有文獻報道抖抖玉露的組織培養和快速繁殖.已有研究[3]表明不同品種玉露的離體快繁方法差異較大.本文采用植物組織培養方法對抖抖玉露的快速繁殖進行研究,為建立抖抖玉露組培苗工廠化生產體系提供技術支撐,從而更好地滿足市場對名貴多肉植物優良商品苗的需求.
1 實驗材料與方法
1.1 實驗材料
抖抖玉露無菌苗由湖州師范學院植物組織培養實驗室提供.
1.2 實驗方法
1.2.1 抖抖玉露無菌苗的增殖培養
將大小一致的抖抖玉露無菌芽接入如下增殖培養基中,P1: MS+6-BA 0.5 mg/L+NAA 0.1 mg/L;P2: B5+6-BA 0.2 mg/L+NAA 0.1 mg/L;P3: B5+6-BA 0.5 mg/L+NAA 0.1 mg/L;P4: B5+6-BA 1.0 mg/L+NAA 0.1 mg/L;P5: B5+6-BA 1.0 mg/L+NAA 0.2 mg/L;P6: B5+6-BA 2.0 mg/L+NAA 0.2 mg/L.接種后置于培養室培養,培養室溫度為25 ℃,光照強度為2 500 lx,光暗周期比為12 h∶12 h.
1.2.2 抖抖玉露無菌芽的生根培養
將大小一致的抖抖玉露無菌芽接入如下生根培養基中,R1: 1/2MS+IBA 0.1 mg/L+NAA 0.1 mg/L;R2: 1/2MS+NAA 0.1 mg/L;R3: 1/2MS+NAA 0.2 mg/L;R4: 1/2MS+NAA 0.5 mg/L;R5: 1/2MS+IBA 0.2 mg/L;R6: 1/2B5+NAA 0.2 mg/L.接種后置于培養室培養,培養條件同抖抖玉露無菌苗的增殖培養.
增殖培養和生根培養的培養基所用的瓊脂均為5 g/L、蔗糖為20 g/L、pH5.5.每項處理配制10瓶培養基,每瓶接種4個抖抖玉露無菌芽,重復3次.接種培養60 d后對抖抖玉露的芽鮮重、芽高、增殖系數,以及不定根的長度、鮮重和數量分別進行統計、測量.
1.3 數據分析
應用Excel 2007軟件進行數據處理,利用SPSS 19.0軟件對數據進行單因素方差分析.
2 結果與討論
2.1 培養基配方對抖抖玉露芽鮮重的影響
如圖1所示,以B5為基本培養基,NAA濃度為0.1 mg/L時,隨著細胞分裂素6-BA濃度的增加(P2~P4培養基處理),抖抖玉露芽鮮重逐漸減小,經1.0 mg/L 6-BA處理(P4)的芽鮮重顯著低于經0.2 mg/L 6-BA處理(P2)的芽鮮重(P<0.05).當6-BA濃度為1.0 mg/L時,提高生長素類物質(NAA)的濃度,即由P4處理的0.1 mg/L NAA提高到P5處理的0.2 mg/L后,芽鮮重顯著增加.當NAA濃度為0.2 mg/L時,6-BA濃度由P5處理的1.0 mg/L提高到P6處理的2.0 mg/L,對芽鮮重無顯著影響.不同的基本培養基MS(P1處理)和B5(P3處理)也未引起芽鮮重顯著差異.
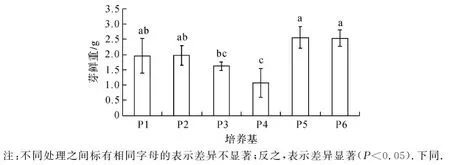
注:不同處理之間標有相同字母的表示差異不顯著;反之,表示差異顯著(P<0.05).下同.圖1 培養基組成分對抖抖玉露芽鮮重的影響Fig.1 Effect of medium composition on fresh weight of Haworthia cooperi shoots
2.2 培養基配方對抖抖玉露芽高的影響
由圖2可知,隨著細胞分裂素類物質6-BA濃度的增加(P2~P4處理),抖抖玉露的芽高呈下降趨勢,但無顯著差異;經0.2 mg/L NAA處理(P5)的芽高顯著高于經0.1 mg/L NAA處理(P4)的芽高;當NAA濃度為0.2 mg/L時,經2.0 mg/L 6-BA處理(P6)的芽高與經1.0 mg/L 6-BA處理(P5)的芽高沒有顯著差異.基本培養基MS(P1)與經B5(P3)處理的芽高無顯著差異.
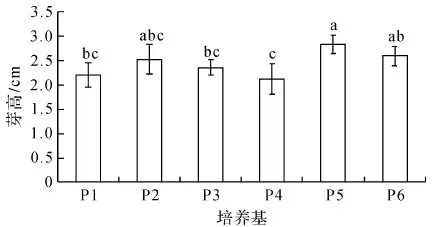
圖2 培養基組成分對抖抖玉露芽高的影響Fig.2 Effect of medium composition on plantlet height of Haworthia cooperi shoots
2.3 培養基配方對抖抖玉露試管苗增殖的影響
圖3表明,經1.0 mg/L 6-BA處理(P4)的增殖系數顯著高于經0.2~0.5 mg/L 6-BA處理(P2和P3)的增殖系數;提高NAA濃度,即從P4處理的0.1 mg/L增加到P5處理的0.2 mg/L,組培苗的增殖系數顯著降低;當NAA濃度為0.2 mg/L時,經2.0 mg/L 6-BA處理(P6)和經1.0 mg/L 6-BA處理(P5)的增殖系數無顯著差異.經基本培養基MS處理(P1)的增殖系數顯著高于經基本培養基B5處理(P3)的增殖系數.
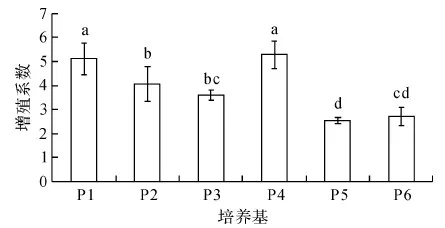
圖3 培養基組成分對抖抖玉露試管苗增殖系數的影響Fig.3 Effect of medium composition on proliferation coefficient of Haworthia cooperi shoots
綜合分析圖1至圖3發現,在一定濃度范圍內提高增殖培養基中細胞分裂素類物質6-BA的濃度,抖抖玉露組培苗的增殖系數得到提高,但組培苗的鮮重和高度下降;提高生長素類物質NAA濃度,有利于組培苗的生長,其鮮重和高度也顯著增加,但其增殖系數顯著降低.這些研究結果與其它的玉露品種[2-8]和植物種類[5,9-10]的組織培養研究結果基本一致.基本培養基MS比B5更有利于抖抖玉露組培苗的增殖,但兩種基本培養基對組培苗的生長(鮮重和高度)無顯著差異.
2.4 培養基配方對抖抖玉露試管苗生根的影響
由圖4A可知,以基本培養基為1/2 MS時,經0.2 mg/L NAA處理(R3)的根鮮重顯著低于經0.1 mg/L NAA處理(R2)和經0.5 mg/L NAA處理(R4)的根鮮重;經0.2 mg/L IBA處理(R5)的根鮮重與經0.2 mg/L NAA處理(R3)的根鮮重無顯著差異;經0.1 mg/L IBA +0.1 mg/L NAA處理(R1)的根鮮重顯著高于經0.2 mg/L NAA處理(R3)和經0.2 mg/L IBA處理(R5)的根鮮重.基本培養基1/2B5(R6)和1/2 MS(R3)對根鮮重的影響無顯著差異.R5培養基中試管苗的生根率最高,R4培養基中試管苗的生根率最低.
如圖4B所示,隨著NAA濃度的增加(R2~R4處理),不定根根長逐漸減小,經0.2 mg/L NAA處理(R3)和經0.5 mg/L NAA處理(R4)的根長均顯著低于0.1 mg/L NAA處理(R2)的根長;經0.2 mg/L IBA處理(R5)與經0.2 mg/L NAA處理(R3)相比,其根長無顯著差異;經0.1 mg/L IBA +0.1 mg/L NAA處理(R1)與經0.2 mg/L NAA處理(R3)和經0.2 mg/L IBA處理(R5)的根長也無顯著差異.經1/2B5基本培養基(R6)與1/2MS(R3)處理相比,其根長無顯著差異.R5培養基中試管苗產生的不定根數最多,R6培養基中試管苗產生的不定根數最少.
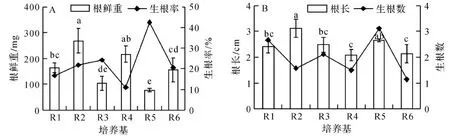
圖4 培養基組成分對抖抖玉露試管苗生根的影響Fig.4 Effect of medium composition on rooting of Haworthia cooperi shoots
高越等[2]研究表明,適宜毛玉露試管苗的生根培養基為1/2MS+NAA 0.5 mg/L.高天舒[6]研究認為,培養基MS+IAA 0.2 mg/L適宜黑肌玉露的生根培養.郭生虎等[4]研究表明,冰燈玉露和黑肌玉露組培苗的最佳生根培養基為1/2MS+IBA 0.5 mg/L+NAA 0.1 mg/L+AC 0.5 g/L.以1/2MS+IBA 0.2 mg/L+AC 3 g/L為玉露組培苗生根培養基時,大窗玉露的生根率為95.56%,黑肌玉露的生根率為94.45%,宮燈玉露的生根率為81.27%,姬玉露的生根率為90%,冰燈玉露的生根率為85.56%[3].這些研究結果表明,不同玉露品種組培苗的最適生根培養基不同.本研究結果表明,抖抖玉露組培苗的最佳生根培養基為1/2MS+IBA 0.2 mg/L.
3 結 論
本文利用離體培養方法研究了不同的基本培養基和植物生長調節物質對多肉植物抖抖玉露組培苗生長、增殖和生根的影響,為建立高效的抖抖玉露組培快繁體系奠定了基礎.研究結果表明,抖抖玉露組培苗的增殖培養基以MS+6-BA 0.5 mg/L+NAA 0.1 mg/L最為適宜,增殖系數為5.1;生根培養基以1/2MS+IBA 0.2 mg/L為最佳,平均生根數為3.1.

