兩種胃癌細胞株與小鼠原代脾臟淋巴細胞共培養對Th17細胞分化的影響
劉暢,陳陽,葉佳,朱梅萍
1.上海中醫藥大學附屬曙光醫院消化科,上海 201203;2.上海中醫藥大學附屬岳陽中西醫結合醫院急診內科,上海 200437
T 淋巴細胞作為免疫反應的中心環節,在胃癌的發生發展中扮演了重要角色,胃癌發生發展過程中廣泛存在輔助性T 細胞(helper T cell,Th)亞群免疫紊亂現象。Th17細胞是胃癌組織中最豐富的CD4+T細胞亞群[1]。自2008 年起,有關胃癌患者腫瘤組織及外周血中Th17 細胞數量增多及RORγt 及IL-17 表達增加的報道相繼涌現[2-3]。但是,胃癌環境下CD4+T細胞分化還罕有報道。本研究通過將人胃癌SGC-7901細胞株及人胃癌BGC-823 細胞株與小鼠原代脾臟淋巴細胞共培養,以細胞內細胞因子染色FCM 測定Th17 細胞,觀察上述胃癌環境對Th17細胞分化的影響。
1 材料與方法
1.1 實驗動物 小鼠來自上海斯萊克實驗動物有限責任公司,實驗動物生產許可證號:SCXK(滬)2007-00058。飼養于上海鈺森生物實驗公司,飼養條件為SPF級。
1.2 實驗材料 人胃癌SGC-7901細胞株及人胃癌BGC-823 細胞株均來自來自上海鈺森生物實驗公司;CD3 ε 抗 體 來 自Miltenyi 公 司;IL-17A 抗 體、Cytofix/Cytoperm W/Golgi Stop KitCD4-PE 抗體、CD62L-FITC 抗體均來自BD 公司;胎牛血清及1640培養基來自Gibco公司。
1.3 實驗方法
1.3.1 小鼠原代脾臟淋巴細胞分離、分析及鑒定 (1)準備含2%青鏈霉素的磷酸鹽緩沖液(PBS),4℃預冷。(2)在潔凈環境中取下小鼠脾臟組織,放入預冷的含2%青鏈霉素的PBS中。(3)在預冷的含2%青鏈霉素的PBS中剝離去除其他多余組織,并漂洗3遍。(4)把脾臟組織放入一個干凈的6 cm 盤中,用20 mL注射器的活塞膠體部分輕柔碾壓脾臟組織,待組織全部碾碎后加入3 mL PBS 重懸細胞,過篩。(5)將收集的脾單細胞懸液緩慢加入預先加有等量小鼠淋巴細胞分離液的離心管中,2 000 r/min離心15 min。(6)小心吸取單個核細胞,移入另一離心管中,加入CD4 及CD62L 抗體孵育后,進行流式分選。(7)分選后的細胞,PBS洗滌兩次,在流式細胞分析儀上進行檢測,測定分選后細胞的純度。
1.3.2 細胞分組 試驗分為SGC-7901 共培養組、BGC-823共培養組和對照組,分別進行以下操作:(1)24 孔細胞培養板提前1 d 用CD3ε單抗進行包被,4℃孵育過夜。(2)分選后的CD4+CD62L+naiveT 細胞用加有10%熱滅活胎牛血清的1640 培養基,調整細胞濃度為1×107/mL。(3) SGC-7901 共培養組及BGC-823 共培養組分別將提前種板的SGC-7901 或BGC-823 細胞去上清,用無菌PBS 洗滌兩遍后,加入1×107個naiveT 細胞,共培養6 h。對照組將1×107個naiveT細胞加入空板并培養6 h。
1.4 Th17 細胞流式檢測 (1)共培養后,將各組細胞懸液離心,用無菌PBS 洗滌兩遍,并轉移至新的培養皿中,并加入新鮮培養基,繼續培養12 h;倒置顯微鏡觀察細胞生長狀態。(2)取上述細胞懸液置于48孔培養板內,每孔1 mL,并加丙二醇甲醚醋酸酯(PMA)(50 μg/L)、離子霉素(1 μmol/L)和蛋白轉運抑制劑莫能菌素(2 μmol/L)以阻止細胞因子向細胞外分泌,在37℃孵箱中培育5 h。(3)流式檢測各組Th17 細胞的比例,以CD4直方圖設門區分Th17細胞,最終以散點圖IL-17染色陽性表示Th17細胞。
1.5 統計學方法 采用SPSS21.0統計學軟件對各組數據進行分析,計量數據以均數±標準差(x-±s)表示,采用獨立樣本t檢驗,以P<0.05為差異具有統計學意義。
2 結果
2.1 小鼠原代脾臟淋巴細胞分離后鑒定 經檢測,分選后CD4+CD62L 雙陽性細胞比例達到98%以上,可以用于下游實驗,見圖1和圖2。
2.2 三組細胞共培養后Th17細胞流式檢測 以CD4直方圖設門區分Th17細胞,SGC-7901共培養組、BGC-823共培養組、對照組的CD4+IL-17A+細胞數量分別為(3.97±0.27)%、(5.17±0.14)%、(1.96±0.29)%,與對照組相比,小鼠淋巴細胞與人胃癌SGC-7901 細胞株及人胃癌BGC-823 細胞株共培養后,Th17 細胞數量均顯著增多(t=-8.52、-17.141);與SGC-7901共培養組相比,BGC-823 共培養組Th17 細胞數量均顯著增多,差異均具有統計學意義(t=-6.496,P<0.05)。
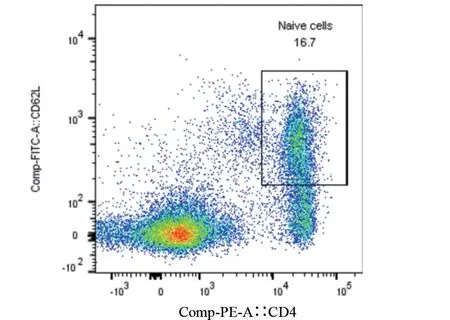
圖1 CD4+CD62L雙陽性細胞(分選前)
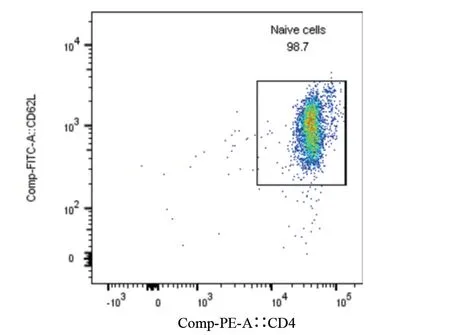
圖2 CD4+CD62L雙陽性細胞(分選后)
3 討論
胃癌是世界范圍內第四常見的腫瘤,是腫瘤相關死亡的第二大原因[1]。腫瘤的發生發展與免疫細胞的調節密切相關。T 淋巴細胞是免疫的中心環節,根據在免疫應答中功能的不同可分為Th細胞、調節性T細胞(regulatory T cell,Treg)和 細 胞 毒 性 相 比T 細 胞(cytotoxic T cell,Tc)。其中,Th 細胞由CD4+T 細胞分化,是輔助T、B 細胞應答的功能亞群。正常情況下,Th 細胞亞群Th1、Th2、Th17、Th9 等處于平衡狀態,當受到抗原、細胞因子、抗原提呈細胞等刺激時,CD4+T細胞可向不同Th 細胞轉化,不同Th 細胞間亦可相互轉化。
Th17細胞是胃癌組織中最豐富的CD4+T細胞亞群[2]。自2008 年起,有關胃癌患者腫瘤組織及外周血中Th17 細胞數量增多及RORγt 及IL-17 表達增加的報道相繼涌現[3-4]。在胃癌環境中,STAT3信號通路的激活介導了CD4+T細胞向Th17細胞分化[5]。
IL-17為Th17細胞最主要的效應因子,在胃癌中,IL-17 主要起促瘤作用,研究發現,在表達高水平的IL-17 mRNA 的胃癌患者腫瘤組織中,血管內皮細胞和浸潤性嗜中性粒細胞的數量比在表達低水平的IL-17 mRNA 的腫瘤組織中顯著增多,且腫瘤組織中IL-17 mRNA 的表達水平與腫瘤的深度、淋巴管侵潤和淋巴結受累有關[6]。此外,IL-17 基因多態性、microRNA結合位點單核苷酸多態性均與胃癌密切相關[7-8]。IL-17 的促瘤機制主要包括:(1)上調血管內皮生長因子、前列腺素1、前列腺素2、巨噬細胞炎癥蛋白-2 等促血管生成因子水平,激發血管內皮細胞遷移,促進血管生成以促進腫瘤增殖[6,9]。(2)擴大炎癥反應,引起組織增生,誘發炎癥-腫瘤效應,加劇腫瘤發展,同時減弱趨化因子依賴性的抗腫瘤反應[10]。(3)直接促進腫瘤細胞增殖及抗腫瘤細胞凋亡[10]。(4)促進淋巴管形成,參與腫瘤轉移[6]。(5)通過AKT 信號通路,進一步激活STAT3,誘導沉默性胃癌干細胞轉化為侵襲性胃癌干細胞[11]。因此,IL-17水平與胃癌患者預后密切相關,臨床研究同樣證實高血清IL-17 濃度胃癌患者五年生存率遠低于低血清濃度患者[2,12]。
綜上所述,胃癌環境存在CD4+T 細胞向Th17 細胞分化增多的現象,過度分化的Th17細胞又加重了胃癌的發生發展。有研究發現,IL-17 阻斷劑有望在胃癌治療中發揮作用[13-15],因此阻斷Th17 細胞分化有望成為治療胃癌的新思路。大量文獻報道了胃癌患者腫瘤組織及外周血中Th17細胞數量增多的現象,本研究首次證實與兩種胃癌細胞株共培養后,CD4+T細胞向Th17細胞分化均增多,而與SGC-7901共培養組相比,BGC-823共培養組Th17細胞數量顯著增多,這在細胞學角度上對胃癌環境中Th17 細胞的過度分化進行了驗證,后續研究可在此基礎上繼續開展,探索以Th17細胞為靶點的抗腫瘤手段。

