高三化學大單元教學設計策略

摘 要:結合電化學和有機化學的單元教學設計,對大單元教學設計的必要性、實施策略、反思等做了一些探究交流.
關鍵詞:“電化學”;“有機”;單元復習;教學設計;高中化學
中圖分類號:G632????? 文獻標識碼:A????? 文章編號:1008-0333(2021)36-0094-02
一、高三化學教學大單元教學設計的必要性
高三化學教學時間緊張,如果還是把知識點簡單的“回炒”根本復習不完,學生也不太愿意再認真聽一遍“舊課”.所以將相關知識點整合起來用大單元的形式復習,不僅節約教學時間,對學生來說還很“新”,能極大地提高了學生的課堂效率.
二、大單元復習設計的策略
1.電化學單元設計的策略
原電池原理與電解原理均是構建于氧化還原反應與電解質溶液的前提下,通過氧化還原反應確保化學能與電能的相互轉換,是高考命題的重點.復習這部分內容時,可從以下幾個方面入手.
(一)構建知識網絡(如圖1所示)
(二)聯系反應原理
能夠自發產生的氧化還原反應從理論進行分析均能夠制成原電池,電解屬于一種非自發的氧化還原反應;把這種反應劃分成還原反應與氧化反應,獲得的就是原電池里正負極的電極反應,原電池的負極與電解池的陽極均產生氧化反應;離子氧化性或者還原性直接關系到電解時溶液里離子的放電次序;而電子守恒定律是展開電化學相關運算的重要基礎.
(三)對比易混知識
正確認知概念是學好化學知識的前提條件,本章涉及大量極可能混淆的概念,應該比較復習.除了“三池”(原電池、電解池與電鍍池)、化學腐蝕與電化學腐蝕、析氫腐蝕和吸氧腐蝕之外,包括大量能夠加以對比的知識點.比如,氫氧燃料電池在各種性質的電解質溶液中的電極反應式,電解池在惰性電極與非惰性電極下離子(或者電極)的放電規律,原電池與電解池中電極的評判與電極反應類別的對比等.借助比較,能夠明確其中的模糊概念,增強對于化學知識的認知.
(四)歸納方法規律
(1)原電池、電解池與電鍍池的評判規律.
①如果沒有外接電源,那么極可能為原電池.原電池兩極通常是兩種活潑性不同的金屬(或金屬與能導電的非金屬),較活潑的電極在電解質溶液中通常能自發地發生氧化還原反應.
②如果存在外接電源,兩極插進電解質溶液內,極可能為電解池或者電鍍池.如若陽極金屬和其中的金屬正離子一樣時,那么就是電鍍池.
③如果沒有外接電源的串聯電路,那么應當借助題給信息發現其中能夠自發形成氧化還原反應的裝置,也就是原電池.
(2)二次電池的判斷方法.
充電電池放電時等同于原電池,負極產生氧化反應,正極產生還原反應;充電時等同于電解池,放電時的正極轉化成陽極,和外部電源的正極連接,負極轉化成陰極,和外部電源的負極連接.
(3)金屬腐蝕的類型和快慢規律.
①電化學腐蝕是不純的金屬與電解質溶液接觸時出現原電池反應現象,活潑性較高的金屬失電子被氧化而造成的腐蝕情況,必定將形成電流.這種腐蝕包含吸氧腐蝕與析氫腐蝕兩類,前者在堿性、中性或弱酸性(酸性很弱)的環境中進行,后者在酸性較強的環境中發生.
②在相同電解質溶液里,金屬腐蝕速度順序就是電解原理造成的腐蝕>原電池原理造成的腐蝕>化學腐蝕>有防護手段的腐蝕;當電解質溶液的濃度越高,那么金屬腐蝕速度就會更為迅速.
③相同金屬在各種介質里的腐蝕速度順序就是強電解質溶液里的腐蝕>弱電解質溶液里的腐蝕>非電解質溶液里的腐蝕.
④針對活潑性存在差異的兩類金屬,如若差異越明顯,那么活潑性較高受到腐蝕的速度更快.
⑤純度越高金屬被腐蝕的速度更慢,純金屬基本不會被腐蝕.不純的金屬或者合金在潮濕條件下的腐蝕速度超過其在干燥、真空環境下被腐蝕的速度.
2.有機化學單元復習設計的策略
有機物種類繁多,有機反應千差萬別.與無機化學相比,有機化學的復習方法有較大的不同,要做好有機化學知識的復習,應抓住以下幾個方面.
(一)抓相近概念的對比
理解概念是掌握知識的前提,比較法是掌握相近概念的有效方法.回顧前面所學的有機知識,以下概念可用比較法進行復習.(1)“八式”:通式、化學式、分子式、電子式、結構式、結構簡式、最簡式、鍵線式;(2)“五同”:同素異形體、結構異構體、同系物、同位素、相同物質;(3)苯、苯的同系物、芳香烴和芳香化合物;(4)醇羥基、酚羥基和羧羥基;(5)水解和酯化;(6)加聚反應和縮聚反應、水解反應和皂化反應;(7)酯和脂、干餾和分餾、裂化和裂解等.
(二)抓有機物的官能團
官能團對有機物的性質起著決定性的作用,對其性質的學習,就是為了明確官能團的屬性,僅有把握住官能團,就掌握了學好有機物性質的金鑰匙.C=C鍵、C—C鍵、—X(鹵素原子)、—OH、—O—、—CO—、—CHO、
—COOH、—COO—都是官能團,這些官能團分別決定了烯烴、炔烴、鹵代烴、醇或酚、醚、酮、醛、羧酸、酯的化學性質.例如,油脂是高級脂肪酸甘油酯,而高級脂肪酸中有不飽和的,所以一些油脂兼有烯烴和酯的一些化學性質,可以發生加成反應和水解反應.再如,葡萄糖是一種多羥基醛,因為其分子中含有醛基,所以葡萄糖能與銀氨溶液發生銀鏡反應,能被新制的Cu(OH)2氧化,能與氫氣發生加成反應;又因為其分子中含有羥基,所以葡萄糖能與羧酸發生酯化反應.
理解官能的性質時,要注意有機物分子中基團和官能團之間的相互影響.例如,由于苯環和側鏈的相互影響,使苯的同系物與苯的一些化學性質不同.
(三)抓知識網絡的構建
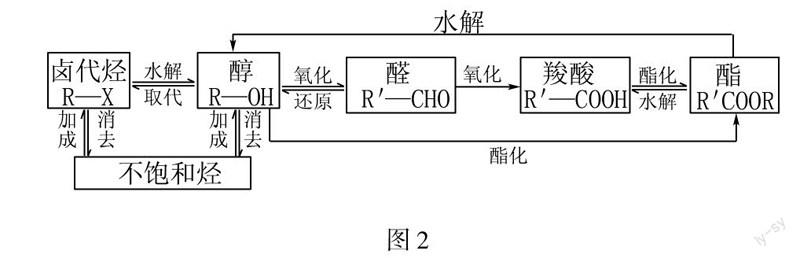
各類有機物之間的轉化關系如圖2所示.
在上述轉化關系里,應該十分重視兩點內容:首先,就是烯烴、鹵烴、醇之間的各種轉換關系,還是烴和烴的衍生物彼此轉化的重要基礎.其次,就是醇、醛、羧酸、酯之間的內在轉化關系,還是展開合理推導與整合的重點所在.
學生應能熟練寫出上述有關轉化反應的化學方程式,從而加深理解各物質之間的聯系.
(四)抓知識的歸納和總結
有機知識的規律性很強,復習時要有意識地歸納和總結重要的知識規律.下列幾種知識規律.下列幾種知識規律需要學生進行歸納和總結:(1)有機反應的條件規律,如光照、濃硫酸和加熱、NaOH的水溶液、NaOH的醇溶液、水浴加熱等各對應什么反應;(2)重要有機反應的類型和反應機理,要能從化學鍵的變化上判斷反應是如何發生的;(3)有機物的熔沸點、密度、水溶性等物理性質規律,這是進行有機實驗的依據;(4)同分異構體的判斷規律;(5)有機物的命名和燃燒規律;(6)能發生某些反應(如水解反應和銀鏡反應)的物質歸納等.
三、大單元教學設計的反思
通過大單元教學設計實現了內容標準和學業標準之間有效銜接和整合.不但提高了課堂效率,調動了高三學生學習化學的興趣和積極性,也提高了教師整合知識的能力和教學水平.對于中等高中學校而言,采取這種大單元教學設計的方法,務實的上好課,哪怕一學年只能設計五個單元,都能不但培養了學生的核心素養,也能提高學生的化學成績,在歷次化學模考中甚至高考中也都取得了理想的成績.
參考文獻:
[1]張季超.做好高中化學復習的方法[J].數理化解題研究,2019(34):80-81.
[責任編輯:季春陽]
收稿日期:2021-09-25
作者簡介:印志林(1982.6-),男,江蘇省常州人,本科,中學一級教師,從事高中化學教學研究.

