分次灌膠制備二維凝膠電泳大膠①
徐胡斌,朱 茵,劉安敏,趙起超,2,謝 恬,2,陳功星,2③
(1.杭州師范大學(xué)醫(yī)學(xué)部,浙江 杭州 311121;2.浙產(chǎn)中藥材資源開發(fā)與應(yīng)用浙江省工程實驗室,浙江 杭州 311121)
蛋白質(zhì)組學(xué)是分子生物學(xué)的重要內(nèi)容,二維凝膠電泳(2-DE)技術(shù)在蛋白質(zhì)組學(xué)研究中得到了廣泛的應(yīng)用,它能夠根據(jù)蛋白質(zhì)的等電點和分子量,將蛋白質(zhì)混合物中的不同蛋白分子分開,形成各自單獨的蛋白質(zhì)分子點,從而能夠?qū)Φ鞍踪|(zhì)表達(dá)模式進(jìn)行大規(guī)模分析,解讀他們在不同生物下的變化,二維凝膠電泳是分離蛋白的一種強(qiáng)大工具,常應(yīng)用于蛋白質(zhì)組學(xué)研究。盡管過去了幾十年,出現(xiàn)了更復(fù)雜和高性能的質(zhì)譜分析方法,但只有結(jié)合二維凝膠電泳才使得它在蛋白研究領(lǐng)域發(fā)揮更大作用[1]。最近出現(xiàn)的熱細(xì)胞轉(zhuǎn)移技術(shù)(cellular thermal shift assay,CETSA)與2-DE結(jié)合成為新的技術(shù)手段,用于藥物蛋白靶標(biāo)分析,在大腸癌細(xì)胞中找到了藥物的靶標(biāo)分子丙酮酸激酶M2型(PKM2),為新藥開發(fā)提供新方法[2]。二維凝膠電泳技術(shù)在等電聚焦后的第二維凝膠電泳常在大膠中進(jìn)行,但目前大膠制備時容易漏膠,導(dǎo)致制膠困難或膠板質(zhì)量不高,影響實驗結(jié)果[3-4]。但目前大膠制備時容易漏膠,筆者在實驗過程中摸索出一種簡便的分次灌膠制膠法,有良好的制膠質(zhì)量。
1 材料與方法
1.1 材料
人肺腺癌細(xì)胞株A549為本實驗室保存。細(xì)胞培養(yǎng)試劑RPMI1640、小牛血清購于杭州曜暉生物科技有限公司;制膠大玻璃板(25.5 cm×21 cm)、制膠立架、IPG干膠條(pH 3~10)及其相應(yīng)試劑、聚焦儀、電泳儀、掃描儀均為美國GE(Ettan IPGphor 3)產(chǎn)品;蛋白Marker、SDS-PAGE凝膠制備試劑盒,購于上海碧云天生物有限公司;考馬斯亮藍(lán)染色液及其脫色液為實驗室自配。
1.2 方法
1.2.1 細(xì)胞培養(yǎng)及樣本制備 A549細(xì)胞培養(yǎng)于含10%小牛血清的RPMI1640(含青霉素100 U/ml、鏈霉素100μg/ml)細(xì)胞培養(yǎng)液中,置于37℃、飽和濕度和5%CO2孵育箱中培養(yǎng);消化收集對數(shù)期生長細(xì)胞,參照美國GE(Ettan IPGphor3)使用說明,5×106個細(xì)胞混懸于10μl PBS中,然后,加入50μl細(xì)胞裂解液[9 M尿素、4%chaps、2%IPG緩沖液、40 mM的Tris-base(pH 8.8)、40 mM的DTT],冰浴,每隔2 min振蕩30 s,共10 min,然后,4℃、離心45 min,取上清20℃保存?zhèn)溆谩?/p>
1.2.2 聚丙烯酰胺大膠制板 在250 ml廣口瓶中配制57 ml濃度為10%分離膠混合液,安置好長、短玻璃板,其兩邊上、中、下重疊部位分別用3個寬50 mm的長尾辦公夾夾住,置于制膠立架上。單次與分次灌膠各制備10塊大凝膠,單次灌膠為1次性灌注膠液,分次灌膠為分3次灌注膠液,前兩次各3 ml,每次灌膠凝固后,再往下繼續(xù)操作,第1次灌膠后會出現(xiàn)少量漏出,膠凝固后,第2次灌膠,未見漏出,待凝固后,底部可能的縫隙已全部堵住,可以進(jìn)行最后1次灌膠。然后加0.1%的SDS液,將膠面壓平。膠凝固后,倒去上層壓膠液,用吸水紙吸干,大膠板配制完成。
1.2.3 聚焦電泳及染色掃描 從-20℃冰箱取出13 cm長的IPG干膠條,室溫平衡30 min,剝?nèi)ケWo(hù)膜,膠面朝下蓋住250μl水化液(8 M尿素、2%chaps、0.5%IPG緩沖液、15 mM的DTT,新鮮配制或者-20℃冰箱保存,不可反復(fù)凍融),室溫被動水化10 h。將IPG膠條膠面朝上轉(zhuǎn)移到聚焦儀的聚焦盤里,兩端覆蓋去離子水浸濕的電極濾紙,電極安裝到位,加礦物油確保膠條完全浸沒。安裝樣品杯,加入50μl提前制備好的樣品。電泳參數(shù):250 V 20 min;4 000 V 2 h,4 000 V 2.5 h等電聚焦。取5 ml平衡液[6 M尿素、2%的SDS、0.375 M的Tris-HCl(pH 8.8)、20%甘油]置于試管中,加入二硫蘇糖醇50 mg,0.25%溴酚藍(lán)25μl,取出聚焦后的膠條浸泡,水平搖床搖15 min;然后膠條置于5 ml平衡液中,加入碘乙酰胺125 mg,0.25%溴酚藍(lán)25μl,搖15 min。將IPG膠條用電泳緩沖液輕輕浸洗,去除緩沖液,然后放入上述制備大膠的上端,并放置蛋白Marker浸泡的濾紙條,用5%低熔點瓊脂糖封閉;安裝電泳裝置,加好電泳緩沖液,恒定功率1 W,電泳過夜。最后取出凝膠浸泡于考馬斯亮藍(lán)染色液(50%甲醇、10%乙酸、0.05%考馬斯亮藍(lán)G250)中,搖動過夜,脫色液(甲醇 ∶雙蒸水 ∶乙酸=45∶45∶10)漂洗。打開掃描儀軟件LabScan,掃描凝膠并保存結(jié)果。
1.3 統(tǒng)計學(xué)方法
數(shù)據(jù)采用Excel表統(tǒng)計分析,計數(shù)資料以%表示,采用χ2檢驗。P<0.05表示差異有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 兩種灌膠方法分析
分次灌膠制10塊板,1次漏膠,成功率為90%;單次灌膠制10塊板,8次漏膠,成功率為20%,兩者差異具有統(tǒng)計學(xué)意義(P<0.05)。見圖1。

圖1 大玻璃板制備聚丙烯酰胺凝膠板
2.2 聚丙烯酰胺凝膠電泳后染色掃描
大玻璃板聚丙烯酰胺凝膠雙向電泳,IGP膠條長為13 cm,pH 3~10。藍(lán)色點為A549細(xì)胞的蛋白質(zhì)分子電泳后的考馬斯亮藍(lán)染色圖譜,點型規(guī)范,分布自然;酸性蛋白質(zhì)分子點居多,在膠的左上方;分子量>43 KD的蛋白居多。見圖2。
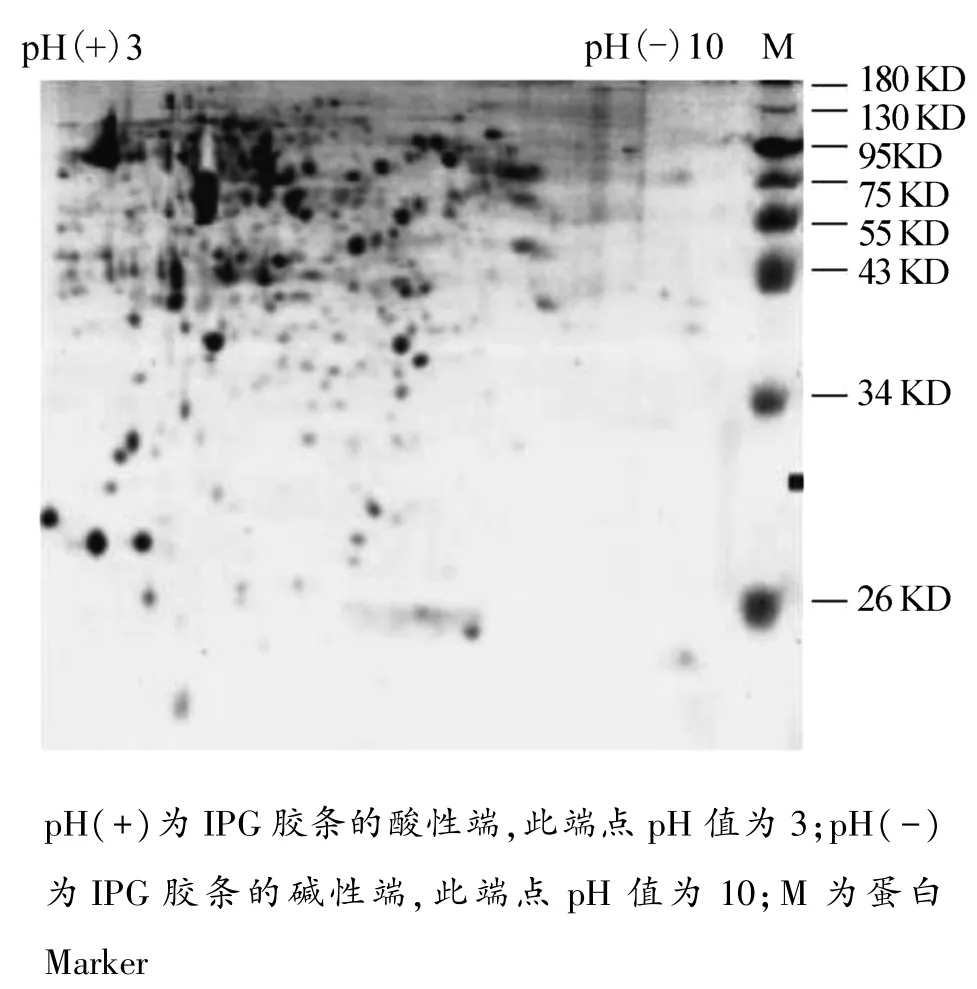
圖2 雙向凝膠電泳考馬斯亮藍(lán)染色圖譜
3 討論
生物分子學(xué)內(nèi)容廣泛,主要涉及核酸和蛋白質(zhì)兩大類,目前,核酸分子的研究相對較多,實際上核酸和蛋白質(zhì)兩大生命分子對生命的意義同樣重要,蛋白質(zhì)的未知領(lǐng)域更廣闊。二維凝膠電泳技術(shù)是蛋白研究的基本技術(shù),依據(jù)等電點和分子量兩個維度對蛋白質(zhì)分子進(jìn)行分離,重復(fù)性良好,理論上可以分離所有的蛋白分子。二維凝膠電泳技術(shù)與質(zhì)譜技術(shù)結(jié)合,在尿液中可篩查到前列腺癌的靶標(biāo)蛋白[5],在大腸癌組織細(xì)胞中可檢測到癌的生物標(biāo)記物[6]。但由于實驗過程復(fù)雜、費用昂貴、操作困難等原因,影響其應(yīng)用。二維凝膠電泳在蛋白質(zhì)組學(xué)分析上仍然是非常重要的技術(shù),尤其是與新近發(fā)明的細(xì)胞熱轉(zhuǎn)移技術(shù)結(jié)合形成的熱蛋白組技術(shù)(2DE-TPP),對于藥物作用的蛋白靶點研究尤為重要[7]。此技術(shù)也將會在中藥現(xiàn)代化工程中發(fā)揮重要作用,中草藥成分復(fù)雜,不易被提取,導(dǎo)致許多中藥主要成分確切作用的蛋白質(zhì)靶分子不為人知,也因此削弱了中草藥的應(yīng)用價值,二維凝膠電泳技術(shù)的應(yīng)用有可能在這方面有所突破。
二維凝膠電泳技術(shù)的建立和發(fā)展有數(shù)十年,有了很多改進(jìn),但聚丙烯酰胺凝膠分離系統(tǒng),尤其是大膠板,需要臨時配制,而本文使用的大膠板可以分析長度7、11、13、18、24 cm的IPG膠條。 雖然有專門的器具保障制膠的質(zhì)量,但其一次性制備膠板數(shù)量太大,或者專門的制膠器具出現(xiàn)損壞不能使用的情況下,本制膠法非常合適。本研究探討了分次灌膠制膠板的設(shè)想,原理是每次少量灌膠,讓其凝固,兩次后底部形成密封層,然后整個膠板灌注就不會出現(xiàn)漏膠現(xiàn)象。結(jié)果顯示,分次灌膠,大膠制作成功率90%;單次灌膠,大膠制作成功率只有20%。3次灌膠制作大膠法,操作簡單,配制過程中只要膠帶封住底口,垂直放置即可,不需要其他特殊的設(shè)施。采用此法制備的大膠進(jìn)行電泳,結(jié)果顯示,蛋白點分布均勻、形態(tài)好,達(dá)到文獻(xiàn)報道的二維凝膠電泳圖形質(zhì)量[8]。分次灌膠形成的密封層,化學(xué)組成與整個大膠一致,理論上不會對實驗結(jié)果產(chǎn)生影響。由于每次灌膠后需等待凝固,因此下一次灌膠液中多加點TEMED,劑量可根據(jù)氣溫和預(yù)期凝固的時間確定。

