三陰型乳腺癌中PRAME和PD-L1的表達及臨床意義
劉 輝,楊菁茹,李元朋,蔡鳳梅,任雨潔,侯夢晨,夏益敏,王卉芳
三陰型乳腺癌(triple-negative breast cancer, TNBC)是指雌激素受體(estrogen receptor, ER)、孕激素受體(progesterone receptor, PR)及人表皮生長因子受體-2(human epidermal growth factor receptor-2, HER-2)均陰性的乳腺癌,由于其對內分泌治療及靶向治療均不敏感,患者臨床治療預后差,迫切需要尋求新的有效治療措施。近年隨著黑色素瘤優先表達抗原(preferentially expressed antigen of melanoma, PRAME)及程序性死亡配體-1(programmed death ligand-1, PD-L1)[1-5]等免疫治療不斷發展,免疫檢查點抑制劑相關藥物已獲批用于黑色素瘤、非小細胞肺癌和腎細胞癌等實體性腫瘤的治療,也為TNBC患者的治療帶來希望。本文著重探討PRAME和PD-L1在TNBC中的表達,為TNBC患者的免疫治療提供參考。
1 材料與方法
1.1 材料收集2005年5月~2020年5月陜西省西安市第四醫院外科手術切除的乳腺癌標本260例,所有病例均未行放、化療或其他針對腫瘤的治療,其中TNBC 46例,非TNBC 214例;另收集50例正常乳腺組織作為對照。
1.2 免疫組化每例選取2個具有代表性的區域制作組織芯片,每個微孔直徑均為2 mm。
免疫組化染色采用EnVision法,一抗PRAME(兔單克隆抗體,克隆號EPR20330,稀釋比1 ∶1 000)和PD-L1(兔多克隆抗體,克隆號28-8,稀釋比1 ∶100)購自美國Abcam公司。ER、PR、HER-2和Ki-67等,均購自福州邁新公司。具體操作步驟嚴格按試劑盒說明書進行。標本均由兩位經驗豐富的病理醫師重新閱片,并依據WHO(2014)乳腺腫瘤分類標準進行分類分級。
1.3 結果判斷PRAME以細胞核著色為陽性;PD-L1以腫瘤部分或全部細胞膜著色,陽性細胞數≥ 1%判定為陽性,不計免疫細胞數量。
1.4 統計學分析采用SPSS 22.0軟件進行統計學分析。計數資料采用[n(%)]表示;組間總體分布趨勢比較,采用χ2檢驗及Fisher精確概率法;兩兩比較采用Bonferrion矯正法;以P<0.05為差異有統計學意義。
2 結果
2.1 臨床特點46例TNBC患者年齡36~78歲,平均49歲,腫瘤最大徑0.6~4.8 cm,平均2.6 cm,有淋巴結轉移者37例;214例非TNBC患者年齡為28~75歲,平均41歲,腫瘤最大徑0.8~5.8 cm,平均3.2 cm,有淋巴結轉移者32例。
2.2 不同乳腺組織中PRAME的表達TNBC細胞多呈巢狀排列(圖1),PRAME在TNBC組織中呈彌漫陽性(圖2);非TNBC細胞呈巢狀或條索狀排列,間質中可見淋巴細胞浸潤(圖3),PRAME在非TNBC組織中呈彌漫陽性(圖4)。PRAME在TNBC組和非TNBC組中的陽性率分別為38.8%和41.3%,差異無顯著性(P>0.05)。PRAME在乳腺癌組和非乳腺癌組中的陽性率分別為39.2%和0,差異有顯著性(P<0.01)。PRAME在TNBC組和非TNBC組中的陽性率與非乳腺癌組相比,差異均有顯著性(P<0.01)。PRAME在乳腺癌中的表達與腫瘤大小、淋巴結轉移無相關性,TNBC組及非TNBC組中PRAME的表達與腫瘤大小、淋巴結轉移均無相關性。
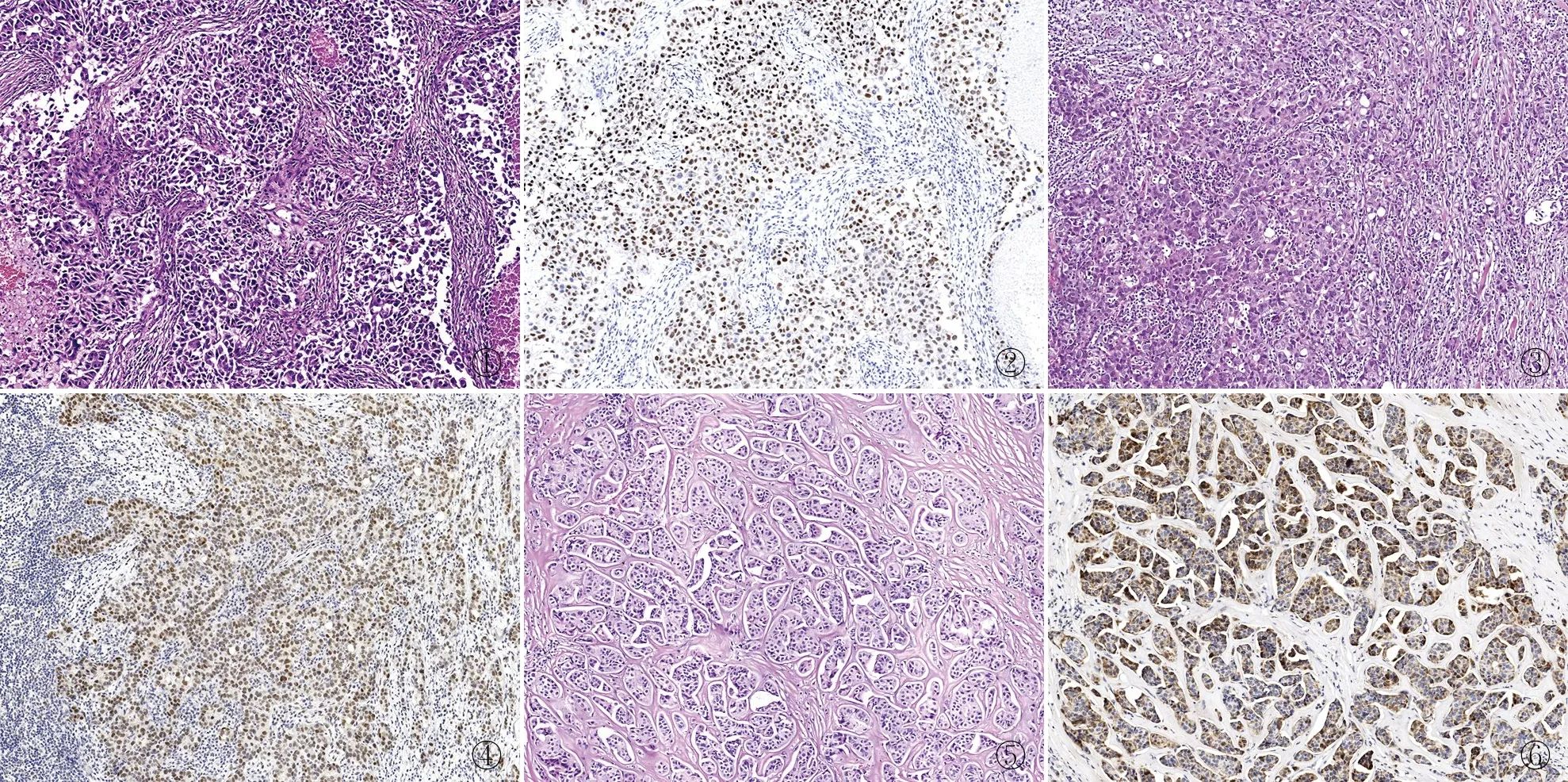
圖1 TNBC細胞呈巢狀排列伴壞死 圖2 TNBC中PRAME呈胞核彌漫陽性,EnVision法 圖3 非TNBC細胞呈巢狀及條索狀排列,間質中見淋巴細胞浸潤 圖4 非TNBC中PRAME呈胞核陽性,EnVision法 圖5 TNBC細胞呈小巢狀排列 圖6 TNBC細胞中PD-L1呈陽性,EnVision法
2.3 不同乳腺組織中PD-L1的表達TNBC細胞呈小巢狀排列(圖5), PD-L1在TNBC的腫瘤細胞中呈陽性(圖6),PD-L1在TNBC和非TNBC組中的陽性率分別為37.0%和25.0%,差異有顯著性(P<0.05)。PD-L1在乳腺癌組及非乳腺癌組中的陽性率分別為27.3%和0,差異有顯著性(P<0.01)。PD-L1在TNBC組和非TNBC組中的陽性率與非乳腺癌組相比,差異均有顯著性(P<0.01)。PD-L1在乳腺癌中的表達與淋巴結轉移呈正相關,與腫瘤大小無相關性,其中TNBC組和非TNBC組中PD-L1的表達與淋巴結轉移均呈正相關,與腫瘤大小均無相關性。
3 討論
TNBC患者復發及轉移率高,對內分泌及靶向治療均不敏感,患者預后差,急需尋求新的有效治療方案。隨著免疫治療相關靶點如PRAME和PD-L1等臨床研究的開展,相關藥物相繼用于黑色素瘤、非小細胞肺癌和腎細胞癌等實體性腫瘤的治療,并取得較為滿意的療效,也為TNBC患者的治療帶來希望。目前,PRAME和PD-L1在TNBC中的研究尚存在爭議,特別是不同克隆號的PD-L1試劑盒存在實驗平臺及判讀標準的不一致,導致實驗結果的差異性。本實驗分析PRAME及PD-L1在TNBC中的表達,為TNBC患者的免疫治療提供參考。
PRAME是腫瘤-睪丸抗原(cancer testis antigen, CTA)家族成員之一,最早由Ikeda從黑色素瘤細胞中分離而出,能夠被HLA-A24分子遞呈給細胞毒性T淋巴細胞(cytotoxic T lymphocytes, CTL)。PRAME在正常組織中的表達僅限于睪丸、卵巢和腎上腺等,其是具有免疫原性的腫瘤相關抗原,在大多數血液系統惡性腫瘤及實體瘤中異常高表達[6-11],在正常組織中表達的局限性及在腫瘤組織中的高表達,被認為是腫瘤免疫治療理想的靶標。目前,PRAME在TNBC中的表達報道較少,具體機制尚不清楚。Al-Khadairi 等[12]研究結果顯示,PRAME可以上調TNBC細胞中SNAI1/TCF4/TWIST1、FOXC2、IL1RN、MMP2、SOX10、WNT11、MMP3、PDGFRB和JAG1等基因及E-cadherin、N-cadherin、vimentin和ZEB1蛋白表達升高,從而促進TNBC細胞的侵襲和轉移; Epping等[13]觀察295例乳腺癌中PRAME的表達,發現其與乳腺癌遠處轉移及患者的不良預后呈正相關,可作為乳腺癌不良預后的指標。Doolan等[14]報道結果亦顯示在103例乳腺癌患者中,PRAME的表達與患者無瘤生存期低及不良預后呈正相關。Sun等[15]報道PRAME可以抑制乳腺癌細胞的增殖和轉移,下調PRAME的表達可以促進乳腺癌細胞增殖并抑制其凋亡;即使在不同分型乳腺癌組織中PRAME的表達差異性也存在爭議,Curigliano等[16]報道PRAME和NY-ESO-1的CTA家族在不同分子分型的乳腺癌的增殖中表達,發現NY-ESO-1在TNBC中高表達,而PRAME在HER-2陽性的乳腺癌中陽性率為16%,在TNBC中呈陰性。Tessari 等[17]報道CTA家族中PRAME、MAGE-A3和NY-ESO-1在不同分子分型乳腺癌組織中的表達,發現NY-ESO-1在TNBC組及非TNBC組間表達差異有顯著性,而PRAME和MAGE-A3在各組乳腺癌中表達差異無顯著性;PRAME在各組乳腺癌中的陽性率達85.7%~96.6%,在TNBC中的陽性率為85.7%,但未與正常乳腺組織進行對比分析。本實驗不僅分析了乳腺癌與正常乳腺組織中PRAME的表達差異,同時也分析了TNBC組與非TNBC組間PRAME表達的差異。本實驗結果顯示,PRAME在TNBC組和非TNBC組中的陽性率分別為38.8%和41.3%,均高于正常乳腺組織,可作為乳腺癌免疫治療的靶點,但兩組之間差異無顯著性,TNBC及非TNBC組中PRAME的表達與淋巴結轉移均無相關性。
PD-L1是B7家族的跨膜蛋白,廣泛表達于免疫細胞、上皮細胞及血管內皮細胞。PD-L1與PD-1結合后,下調淋巴細胞增殖及相關細胞因子產生,誘導免疫耐受,腫瘤細胞高表達PD-L1后利用該機制從而逃避免疫監視,利用抗PD-1/PD-L1抗體阻斷PD-1/PD-L1途徑可以達到抗腫瘤效果。隨著以PD-1/PD-L1為靶點的免疫治療在非小細胞肺癌及惡性黑色素瘤等腫瘤治療中的應用,其在乳腺癌特別是TNBC治療的研究廣泛開展。國外報道多集中于PD-L1在TNBC中的表達及其與預后的相關性,但由于檢測平臺、所用抗體及評判閾值的差異性,導致實驗結果不一致。Dill等[18]檢測245例原發性乳腺癌(其中32%為TNBC)及40例轉移性乳腺癌中PD-L1(克隆號SP142)的表達,結果顯示PD-L1在高級別乳腺癌及TNBC中陽性率更高;Rugo等[19]應用SP142、22C3和SP263三個不同克隆號的PD-L1抗體對614例TNBC進行檢測,結果顯示陽性率分別為46%、81%和75%;黃述斌等[20]報道PD-L1(克隆號SP142)在乳腺癌組織中的陽性率為35.3%,在TNBC中的陽性率為61.9%,明顯高于非TNBC組。目前,PD-L1表達與預后的相關性研究存在爭議。Muenst 等[21]發現乳腺癌中PD-L1的表達與患者年齡、腫瘤大小、分期分級及淋巴結轉移有相關性。Monneur等[22]也認為PD-L1表達與不良預后相關,特別是在TNBC及基底細胞亞型中陽性率更高。文獻報道[23-24]PD-L1表達是乳腺癌患者預后的積極因素。現階段PD-L1不同克隆號采用的不同檢測平臺及評判標準,導致結論可能存在差異。本實驗采用PD-L1(克隆號28-8)抗體,結果顯示其在TNBC及非TNBC中的陽性率分別為37%和25%,在乳腺癌及正常乳腺組織中的陽性率分別為27.3%和0,在乳腺癌中的表達與淋巴結轉移及病理分級呈正相關。盡管PD-L1的表達尚存爭議,但并不影響抗PD-L1藥物在乳腺癌特別是TNBC治療中的臨床研究。抗PD-L1藥物臨床研究集中在Atezolizumab、Avelumab和Durvalumab,研究顯示雖然抗PD-1/ PD-L1藥物對TNBC具有一定緩解作用,但其作用并不理想,應進行免疫治療聯合放、化療等治療方案,以期獲得更好的療效。文獻報道[25-29]顯示,聯合免疫治療、放化療比單獨應用免疫治療能夠獲得更高的腫瘤緩解率,死亡風險明顯降低。
綜上所述,以PRAME和PD-L1等靶點的免疫治療為TNBC的治療帶來新希望。目前,其作用機制尚不清楚。不同克隆號PD-L1采用的檢測平臺及結果評判標準存在差異,導致分析結果有差異,免疫治療聯合放療或化療能夠顯著提高患者的腫瘤緩解率。另外,還需積累更多病例進一步分析其最佳的聯合治療方案及降低患者不良反應。

