金黃色葡萄球菌毒力因子與兒童金黃色葡萄球菌軟組織感染、肺炎的相關性*
麻明彪,黃海林,許 彬,李小娟,李 玨,世淑蘭,王海平,杜廷義△
1.云南省昆明市兒童醫院檢驗科,云南昆明 650228;2.云南省兒童重大疾病研究重點實驗室,云南昆明 650228
兒童金黃色葡萄球菌(SA)軟組織感染與肺炎是臨床兒科的常見病和多發病。兒童SA軟組織感染常表現為皮下膿腫、臍炎、關節炎、蜂窩織炎或燙傷樣皮膚綜合征等,而SA肺炎可表現為持續性或反復發熱、氣促、咳嗽,甚至感染性休克,病情比一般細菌性肺炎重,進展快,早期診斷較難,易延誤治療,目前仍是兒童和嬰幼兒期病死率較高的一種疾病[1-2]。SA感染與其產生、分泌的外毒素密切相關,常見的外毒素主要包括殺白細胞毒素(PVL)、中毒性休克綜合征毒素1(TSST-1)、溶血素(HL)、腸毒素(SEs)和表皮剝脫毒素(ETs)等。以往兒童SA軟組織感染及肺炎的研究主要集中在探討患兒的臨床特征、毒素分子的作用機制和SA的耐藥性,而對SA毒素編碼基因在兒童軟組織感染及肺炎中的分布差異,以及病原體毒素基因的攜帶與疾病臨床表現之間的相關性研究甚少[3-4]。因此,本研究主要探討了兒童SA軟組織感染及肺炎中SA PVL基因(pvl)、中毒性休克綜合征毒素1基因(tst-1)和α溶血素基因(hl-α)的分布情況,以及毒素基因的攜帶與患兒臨床表現的相關性。
1 資料與方法
1.1一般資料 以2018年10月至2019年3月昆明市兒童醫院確診為SA軟組織感染和SA肺炎的住院患兒為研究對象。研究對象納入標準:(1)年齡≤18歲,性別不限;(2)臨床診斷和病原學檢測確診為軟組織SA感染或SA肺炎;(3)患兒臨床資料完整。
1.2方法
1.2.1臨床資料收集 收集納入研究患兒的臨床資料,主要包括性別、年齡、感染部位、臨床診斷、體溫、心率、血壓、呼吸頻率以及意識狀態。肺炎嚴重程度根據簡化英國胸科協會改良肺炎評分(CRB-65)進行評估、分組,0~2分為輕癥肺炎,≥3分為重癥肺炎。
1.2.2菌株收集及鑒定 采集軟組織感染分泌物、深部痰液、肺泡灌洗液或血液分離培養得到的SA菌株,剔除同一病例的重復菌株。所有菌株經菌落形態觀察、革蘭染色鏡檢以及法國生物梅里埃公司Vitek-2 Compact全自動微生物分析儀進行鑒定。
1.2.3菌株pvl、tst-1和hl-α的檢測 使用細菌基因組DNA提取試劑盒(TaKaRa公司)提取SA基因組DNA。根據GeneBank中公布的pvl、tst-1和hl-α的DNA序列,利用Oligo7.0軟件進行引物設計,由昆明碩擎生物技術有限公司進行引物合成,各基因引物序列見表1。使用TB GreenTMPremix Ex TaqTMⅡ試劑盒(TaKaRa公司)通過PCR分別檢測pvl、tst-1和hl-α,PCR擴增反應體系總體積為25 μL,其中TB Green Premix Ex Taq Ⅱ 12.5 μL,10 μmol/L的正向/反向引物各1 μL,細菌DNA模板2 μL,無RNA酶的雙蒸水8.5 μL。PCR擴增反應條件:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s共30個循環;72 ℃ 8 min。擴增結束后將產物進行1%瓊脂糖凝膠電泳分析。電泳條件:電壓110 V,電流240 mA,時間38 min。

表1 pvl、tst-1和hl-α的引物序列
2 結 果
2.1患兒一般情況 納入研究的75例患兒中,34例為SA軟組織感染,其中男11例、女23例,年齡11 d至9歲,中位年齡1.8歲,臨床表現為皮下膿腫(16例)、皮膚表皮感染(7例)、關節術后感染(7例)、燙傷樣皮膚綜合征(2例)、蜂窩織炎(1例)和臍炎(1例)。41例確診為SA肺炎,用于檢測標本:34例為痰液,4例為肺泡灌洗液,3例為血液。根據CRB-65,30例為輕癥肺炎,其中男17例、女13例,年齡7 d至4歲、中位年齡1個月;11例為重癥肺炎,其中男6例、女5例,年齡8 d至3歲、中位年齡1個月。
2.2pvl、tst-1和hl-α的檢測及檢出率 PCR檢測75株SA的pvl、tst-1和hl-α,擴增產物的瓊脂糖凝膠電泳分析顯示,pvl陽性(pvl+)SA在433 bp處有條帶,tst-1陽性(tst-1+)SA在578 bp處有條帶;hl-α陽性(hl-α+)SA在210 bp處有條帶。pvl在軟組織感染組中的檢出率最高[52.94%(18/34)],其次為重癥肺炎組[45.45%(5/11)],輕癥肺炎組檢出率最低[20%(6/30)],各組間比較差異有統計學意義(P<0.05);tst-1在重癥肺炎組中的檢出率最高[72.73%(8/11)],其次為軟組織感染組[29.41%(10/34)],在輕癥肺炎組中未檢測到,各組間比較差異有統計學意義(P<0.05);hl-α在3個組別中均有檢出,但檢出率比較差異無統計學意義(P>0.05)。見表2。

表2 pvl、tst-1和hl-α在不同組別中的檢出情況[n(%)]
2.3pvl+tst-1陰性(tst-1-)與pvl陰性(pvl-)tst-1-SA感染患兒生命體征參數的比較 pvl+tst-1-與pvl-tst-1-SA軟組織感染患兒比較,體溫、呼吸頻率、心率、血壓(包括舒張壓、收縮壓)差異均無統計學意義(P>0.05),見表3。pvl+tst-1-與pvl-tst-1-SA肺炎患兒比較,體溫、呼吸頻率和心率更高,而舒張壓更低,差異均有統計學意義(P<0.05),見表4。
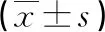
表3 pvl+tst-1-與pvl-tst-1-SA軟組織感染患兒生命體征參數的比較
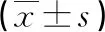
表4 pvl+tst-1-與pvl-tst-1-SA肺炎患兒生命體征參數的比較
2.4pvl-tst-1+與pvl-tst-1-SA感染患兒生命體征參數的比較 pvl-tst-1+與pvl-tst-1-SA軟組織感染患兒體溫、呼吸頻率、心率、血壓比較,差異均無統計學意義(P>0.05),見表5。pvl-tst-1+與pvl-tst-1-SA肺炎患兒比較,體溫和呼吸頻率更高,差異有統計學意義(P<0.05),心率和血壓差異無統計學意義(P>0.05),見表6。

表5 pvl-tst-1+與pvl-tst-1-SA軟組織感染患兒生命體征參數的比較或M(Q)]
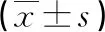
表6 pvl-tst-1+與pvl-tst-1-SA肺炎患兒生命體征參數的比較
3 討 論
SA是臨床上常見的條件致病菌之一,也是我國兒童和新生兒患者中檢出率最高的革蘭陽性菌,可導致人體局部或全身性的感染,如毛囊炎、皮下膿腫、肺炎以及中毒性休克綜合征等。其感染嚴重也可引起敗血癥而導致死亡[5]。SA引起的感染性疾病是其產生、分泌各種毒素、侵襲性酶與機體免疫相互作用的結果,且在不同感染類型中產生、分泌的毒素也有所差異[6]。本研究探討了兒童SA軟組織感染及肺炎中SA毒素編碼基因pvl、tst-1和hl-α的檢出情況。結果顯示:pvl在兒童SA軟組織感染組中檢出率最高,在SA輕、重癥肺炎組中也有檢出;tst-1在兒童SA重癥肺炎組中檢出率極高,其次為軟組織感染組,而在輕癥肺炎組中未檢測到;hl-α在SA中有很高攜帶率,但各組的檢出率無明顯差異。
對于SA軟組織感染,CRIBIER等[7]最早報道PVL可能與皮膚軟組織感染相關,而后LINA等[8]也證實了pvl在癤、蜂窩織炎、皮膚膿腫等軟組織感染中有較高的檢出率。一項回顧性研究更進一步明確了pvl與皮膚軟組織感染相關[9]。因此,結合本研究的結果,表明兒童SA軟組織感染主要由pvl+SA引起。此外,根據患兒的相關臨床特征進行分析:無論SA是否攜帶pvl或tst-1,SA軟組織感染患兒的相關生命指征,包括體溫、呼吸頻率、心率和血壓均無明顯差異,分析其原因可能是因患兒感染病灶局限,未累及機體重要臟器,或引起系統性感染,從而不常伴有發燒、呼吸急促、心率加快和低血壓等全身性反應的癥狀。但在SA肺炎患兒中,由pvl+SA引起肺炎患兒的體溫、呼吸頻率和心率均高于pvl-SA引起的肺炎,血壓也低于pvl-SA引起的肺炎。相關研究也表明,PVL在壞死性肺炎發生過程中起重要作用,且pvl表達水平與肺炎感染嚴重程度呈正相關[9-10]。pvl+SA肺炎病理表現為肺組織表面覆蓋大量SA,氣管和支氣管黏膜出血,肺實質內肺空泡形成、出血以及肺泡間隔壞死等,臨床癥狀常伴有呼吸急促、心率加快、低血壓等病情危重征兆,具有很高的病死率[11-14]。因此,pvl的攜帶可增強SA的致病力,使其引起肺炎的病情更嚴重。
在11例重癥肺炎患兒中,有8例患兒感染的SA攜帶有tst-1,檢出率高達72.73%,而在輕癥肺炎患兒中未檢測到tst-1。由此提示,tst-1可能與兒童重癥肺炎的發生密切相關。結合肺炎患兒臨床特征分析,在8例tst-1+重癥肺炎患兒中,多數患兒伴有發燒、呼吸急促、意識障礙,并且1例出現呼吸衰竭、1例出現肺出血等病情危重表現。相關研究表明,tst-1編碼合成的TSST-1屬于致熱原性超抗原家族,是引起中毒性休克綜合征最主要的致病因子[15]。TSST-1具有很強的超抗原活性,可直接與抗原提呈細胞表面的主要組織相容復合物Ⅱ類分子(MHCⅡ)的抗原結合槽外側結合,形成MHCⅡ-TSST-1復合物,然后直接激活T淋巴細胞抗原受體的特異性β鏈V區,促進T細胞活化、增殖并釋放大量炎性細胞因子引起強烈的免疫應答,最終導致機體炎癥失控和多器官損害[16-17]。此外,TSST-1還可直接損傷Kupffer細胞(又稱庫普弗細胞),抑制內毒素脫顆粒反應,導致內毒素在體內大量蓄積而引起內毒素血癥,發生內毒素休克[18]。雖然tst-1+SA肺炎患兒的心率和血壓與tst-1-SA肺炎患兒差異無統計學意義,但根據具體數據來看,大部分tst-1+SA肺炎患兒的心率還是快于tst-1-SA肺炎患兒,血壓也比其低,其原因可能是本研究中檢出tst-1+SA肺炎患兒例數較少,從而導致統計結果無明顯差異。因此,tst-1的檢測對兒童重癥SA肺炎的臨床診斷和病情預判有潛在價值,此外,對tst-1+SA肺炎患兒,臨床應提高警惕,并及時采取合理治療措施避免重癥肺炎的發生。
綜上所述,pvl主要見于兒童SA軟組織感染,且在兒童SA肺炎中可導致病情加重;tst-1與兒童SA重癥肺炎的發生密切相關,tst-1檢測對兒童SA重癥肺炎的診斷和病情預判有潛在價值,對tst-1+SA肺炎患兒應提高警惕,并及時采取合理治療措施避免重癥發生。hl-α在兒童SA軟組織感染及肺炎中均有較高檢出率,無明顯特異性。

