血清維生素D水平與2型糖尿病微血管并發癥關系的研究*
劉倩倩,魯作華,韓書光,趙曉靜,劉興暉
上海市浦東新區公利醫院檢驗科,上海 200135
2015年,全球據估計有4.15億糖尿病患者,到2040年預測數量將上升至6.42億[1]。糖尿病微血管病變的發生已非常普遍,其帶來的嚴重危害一直受到大家的廣泛關注。臨床上常見的糖尿病微血管病變有糖尿病腎病(DKD)、糖尿病視網膜病變(DR)和糖尿病周圍神經病變(DPN)。維生素D的缺乏在世界范圍內普遍存在,在各年齡段、不同性別人群中都很常見[2-3]。有研究表明,低維生素D水平與2型糖尿病(T2DM)患者的微血管病變風險增加有關[4-5]。糖尿病病程、脂代謝紊亂、氧化應激、糖基化終末產物、血管內皮功能紊亂等均可影響微血管并發癥的發生、發展,維生素D可能參與其中[6]。維生素D在肝經25-羥化酶的作用轉變為25-羥維生素D[25(OH)D],它是維生素D的主要循環代謝物,準確地反映了體內維生素D水平[2]。國內關于比較T2DM各并發癥中維生素D水平的研究僅停留在患1種并發癥的患者,而往往許多患者合并兩種甚至3種并發癥,本研究旨在觀察維生素D在合并多種不同類型T2DM微血管并發癥患者中水平的差異,探討其與血糖控制及胰島素抵抗的相關性,給臨床預防性治療提供參考。
1 資料與方法
1.1一般資料 選取上海市浦東新區公利醫院內分泌科2018年4月至2019年7月收治的T2DM患者共400例納入研究,男248例、女152例,年齡21~89歲,中位年齡62.5歲。其中,無并發癥的T2DM患者80例作為對照組,有并發癥者320例作為并發癥組。并發癥組中僅合并DPN(P)、合并DPN和DR(PR)、合并DPN和DKD(PK)以及合并DPN、DR、DKD 3種并發癥(PRK)患者各80例。由于僅合并DR、僅合并DKD以及合并DR和DKD的患者例數不足,故沒有納入研究。排除肝腎功能不全、腫瘤、血液透析、大血管病變、甲狀旁腺功能亢進患者。
1.2儀器與試劑 空腹血糖(FBG)、高密度脂蛋白膽固醇(HDL-C)、三酰甘油(TG)、肌酐[用于計算腎小球濾過率估算值(eGFR)]、胱抑素C(CysC)的檢測采用雅培CA16000型全自動生化分析儀;糖化血紅蛋白(HbA1c)的檢測采用TOSOH HLC-723G8型糖化血紅蛋白分析儀;25(OH)D的檢測采用羅氏Cobas e 601型全自動電發光免疫分析儀;空腹胰島素(Ins)的檢測采用全自動磁微粒化學發光分析儀A2000Plus。檢測試劑均為儀器配套試劑。
1.3方法 所有患者均清晨空腹采集靜脈血5 mL于BD促凝管中,2 h內以3 000 r/min離心15 min,分離血清,用于檢測25(OH)D、HDL-C、TG和Ins,檢測步驟遵循試劑說明書進行;同時采集靜脈血4 mL于BD肝素鋰抗凝管中,用于HbA1c的檢測。計算胰島素抵抗指數(HOMA-IR),計算公式:HOMA-IR=Ins×FBG/22.5。將并發癥組患者按空腹血清25(OH)D水平進行分組,以25(OH)D水平的四分位數為分界點分為4組:A組,<25.29 μmol/L;B組,25.29~<35.24 μmol/L;C組,35.24~47.08 μmol/L;D組,>47.08 μmol/L。
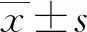
2 結 果
2.15組T2DM患者各指標的比較 各組間比較,25(OH)D、TG、CysC、年齡差異有統計學意義(P<0.05);HbA1c、FBG、HDL-C、HOMA-IR、性別差異無統計學意義(P>0.05),見表1。對照組、P組、PR組和PK組這4組間25(OH)D水平兩兩比較,差異無統計學意義(P>0.05);對照組、P組、PK組、PR組25(OH)D水平均高于PRK組,差異均有統計學意義(P<0.05)。PK組、PRK組CysC水平均高于對照組、P組和PR組,差異有統計學意義(P<0.05);PK組和PRK組間CysC水平比較,差異無統計學意義(P>0.05)。P組和PRK組TG水平比較,差異有統計學意義(P<0.05),其余各組間差異均無統計學意義(P>0.05)。對照組和P組的年齡均低于PK組、PR組和PRK組,差異均有統計學意義(P<0.05);對照組和P組間年齡比較,差異無統計學意義(P>0.05)。
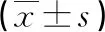
表1 5組T2DM患者各指標的比較
2.2按維生素D水平進行分組比較 4組間HbA1c、TG水平差異有統計學意義(P<0.05),4組間eGFR、FBG、HDL-C、CysC、HOMA-IR水平及年齡、性別差異無統計學意義(P>0.05),見表2。進一步兩兩比較,僅A組與D組間HbA1c和TG水平差異有統計學意義(P<0.05),其余各組間兩兩比較HbA1c和TG水平差異均無統計學意義(P>0.05)。
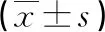
表2 25(OH)D水平分組中各檢測指標及年齡、性別構成的比較

組別nHDL-C(x±s,mmol/L)CysC(x±s,mg/L)HOMA-IR(x±s)年齡(x±s,歲)男/女(n/n)A組801.01±0.321.39±0.274.86±5.2764.65±10.5558/22B組801.06±0.281.39±0.325.07±2.9962.75±10.3632/48C組801.07±0.361.18±0.214.10±3.0162.55±11.8553/27D組801.08±0.291.21±0.363.79±3.0065.42±8.9053/27F/χ20.8791.4941.8531.3886.194P0.4520.2160.1370.2460.103
2.3Logistic多因素回歸分析 選取25(OH)D、TG、CysC和HbA1c這4項可能與T2DM并發癥發生相關的危險因素進行Logistic多因素回歸分析。按25(OH)D水平分組為A組和B組的T2DM患者合并3種并發癥的風險分別是D組的3.60和2.57倍,差異有統計學意義(P<0.05)。CysC是T2DM患者合并DPN與DKD以及合并DPN、DR、DKD 3種并發癥的危險因素(P<0.05)。見表3。

表3 T2DM患者合并糖尿病并發癥的危險因素分析

續表3 T2DM患者合并糖尿病并發癥的危險因素分析
3 討 論
根據世界衛生組織(WHO)統計,2005-2015年,由糖尿病造成的經濟負擔為5 577億美元,其中80%的花費用于并發癥治療[7],并發癥的提前預防和及時治療已迫在眉睫。低維生素D水平可能為T2DM的一個危險因素[8]。維生素D的生物學效應是由其受體介導的,維生素D受體(VDR)存在于大多數組織和器官中,與多種疾病有關,如免疫系統疾病、癌癥、心血管疾病和糖尿病等[3,9-11],因此其骨骼外效應也可能與糖尿病不同并發癥的發生、發展有關聯。本研究對維生素D在不同T2DM微血管并發癥中的水平差異進行了分析,證明了低水平維生素D是T2DM患者同時合并3種微血管并發癥的危險因素。
維生素D與糖尿病微血管并發癥的聯系,在人類和動物模型中被廣泛研究。在澳大利亞、新西蘭和芬蘭進行的針對9 795例50~75歲T2DM患者的大型研究表明,低血清25(OH)D水平與T2DM發生大血管和微血管疾病的風險增加有關[5]。WANG等[12]對DKD大鼠的動物研究表明,25(OH)D治療能有效地抑制高血糖誘導的系膜細胞增殖,并降低DKD大鼠的清蛋白排泄,從而抑制DKD的發展。JUNG等[13]的研究證實,維生素D缺乏[25(OH)D<10 ng/mL]與女性DKD的患病率顯著增加以及男性DPN的患病率增加有關。本研究中,對照組和P組的年齡均低于PR組、PK組和PRK組,年齡越大的T2DM患者合并多種微血管并發癥的風險越大。上海市新華醫院的一項研究將1 461例T2DM患者按年齡分組并分析了維生素D與DPN之間的關系,發現65歲以上患者的低血清維生素D水平與DPN有關,血清維生素D被認為是該人群DPN的預測因子[14]。不同微血管并發癥的獨立危險因素并不完全一致。
一項針對T2DM患者維生素D狀況與胰島素抵抗關系的研究顯示,維生素D缺乏[25(OH)D<20 ng/mL]組與未缺乏組比較,TG、HDL-C水平無明顯差異,低維生素D水平與胰島素抵抗無明顯關聯[9]。本研究將并發癥組患者根據25(OH)D四分位數水平進行劃分,發現各組間eGFR、HDL-C、CycC和HOMA-IR水平差異均無統計學意義(P>0.05)。有研究表明,胰島β細胞中存在維生素D受體,維生素D水平影響胰島素分泌功能和胰島素抵抗[15-17],而本研究并未發現維生素D水平與胰島素抵抗之間存在關聯。一項研究顯示,T2DM 3~4期慢性腎病患者25(OH)D與HbA1c水平呈負相關[18],血清維生素D水平的高低與T2DM微血管并發癥患者的血糖控制水平有相關性,因為維生素D可通過抑制促炎細胞因子的釋放和調節核因子-κB(NF-κB)的活性,減輕全身炎癥,改善糖耐量和維持葡萄糖穩態[19]。本研究的T2DM微血管并發癥患者中,僅發現HbA1c和TG水平在25(OH)D水平最低組(A組)與最高組(D組)間有明顯差異。
維生素D在DKD中的作用也被廣泛報道,體外動物實驗證明維生素D及其受體可通過激活NF-κB信號通路來調節血管緊張素原的表達和足細胞凋亡,從而抑制DKD的發展[20]。維生素D還可通過阻斷腎素血管緊張素系統(RAS)激活而起到對DKD的腎臟保護作用,防止腎纖維化形成和腎細胞凋亡等[11-21],還可有效抑制高血糖誘導的系膜細胞增殖[12],從而抑制DKD的發展。但是本研究并未發現維生素D的降低是DKD的危險因素,國內有研究認為血清25(OH)D水平降低與中老年糖尿病患者DKD患病率較高顯著相關,結果的不一致可能與研究對象的年齡分布有關[22]。通過Logistic回歸分析發現T2DM患者中25(OH)D水平較低者合并3種并發癥的風險較高。CysC是一種與GFR高度相關的內源性半胱氨酸蛋白酶抑制劑[24],本研究也表明,CysC是T2DM患者合并DPN和DKD及合并DPN、DR、DKD 3種并發癥的危險因素。
綜上所述,本研究發現低維生素D水平的T2DM微血管并發癥患者的血糖控制不理想。低水平維生素D是T2DM患者同時合并3種微血管并發癥的危險因素,臨床上可以提前干預治療,延緩微血管并發癥的進展。本研究也有一定的局限性,首先,由于僅合并DR或者僅合并DKD,以及合并DR和DKD的患者例數不足,因此未將這些類別的患者納入研究,導致分組的覆蓋面不完整。其次,未對患者治療方案進行分析,不同并發癥的治療不盡相同,可能對分析結果造成一定影響。在今后的研究中可以擴大分組覆蓋面,將各種影響因素充分體現出來,并考慮到季節以及其他相關因素的變化。

