基于網絡藥理學探討三物白散治療胃癌的分子機制及初步驗證
婁余 朱瑩 彭瑤 王燚霈 易書林


〔摘要〕 目的 運用網絡藥理學聯合分子對接探討三物白散治療胃癌的作用機制,通過體外細胞實驗對相關靶點作初步驗證。方法 利用TCMSP數據庫獲取三物白散的活性成分及潛在靶點;通過Genecards、OMIM、TTD數據庫,收集胃癌相關的作用靶點;將三物白散潛在靶點與胃癌靶點相匹配,獲得三物白散抗胃癌的作用靶點,使用STRING數據庫對作用靶點進行蛋白互作分析,構建PPI網絡,并進行拓撲分析篩選核心靶點;用R語言對作用靶點進行GO生物學過程和KEGG通路富集分析;采用Auto Dock Vina軟件對核心靶點與對應活性成分進行分子對接;運用qPCR驗證三物白散對胃癌細胞SGC-7901中Caspase-3、Caspase-7作用靶點的調控作用。結果 經篩選獲得三物白散活性成分17個,三物白散作用靶點84個,經拓撲分析得到12個核心作用靶點,包括TP53、AKT1、MAPK1、JUN、CASP3等。三物白散作用靶點涉及PI3K-AKT、p53、HIF-1、IL-17等多條信號通路,通過誘導細胞凋亡、抑制細胞增殖、調節缺氧及炎性微環境發揮抗腫瘤作用。分子對接結果表明,活性成分與核心靶點有良好的結合能力。體外實驗結果證實,三物白散可上調凋亡相關分子Caspase-3、Caspase-7的表達,這在一定程度上證實了網絡藥理學預測及指導實驗設計的可靠性。結論 本研究結果體現了三物白散多成分、多靶點、多通路的治療特點,系統地揭示了其抗胃癌的藥效物質、核心靶點和信號通路,為后續深入研究作用機制提供參考。
〔關鍵詞〕 胃癌;三物白散;網絡藥理學;作用靶點;分子對接;體外細胞實驗
〔中圖分類號〕R285.5? ? ? ? 〔文獻標志碼〕A? ? ? ?〔文章編號〕doi:10.3969/j.issn.1674-070X.2021.04.013
〔Abstract〕 Objective To investigate the mechanism of Sanwubai Powder in the treatment of gastric cancer based on network pharmacology combined with molecular docking, and to preliminarily verify the related targets by in vitro cell experiments. Methods TCMSP was used to screen and predict the compounds and targets in Sanwubai Powder. Targets related to gastric cancer were collected by GeneCards, OMIM and TTD databases. The potential targets of Sanwubai Powder were matched with the targets of gastric cancer to obtain the anti-gastric cancer targets of Sanwubai Powder, STRING was used to analyze the protein-protein interaction of targets, PPI network was structured and then the core targets were screened by using topology analysis. GO biological process analysis and KEGG pathway enrichment analysis were performed by R language. Auto Dock Vina software was used to dock the core targets with the active ingredients. qPCR was used to verify the regulatory effects of Sanwubai Powder on the targets of Caspase-3 and Caspase-7 in gastric cancer cells SGC-7901. Results 17 active components were screened, and 12 hub targets of 84 targets including TP53, AKT1, MAPK1, JUN and CASP3 were obtained of Sanwubai Powder. The targets of Sanwubai Powder involved PI3K-Akt, p53, HIF-1, IL-17 signal pathways, which played an anti-tumor role by inducing cell apoptosis, inhibiting cell proliferation, regulating hypoxia and inflammatory microenvironment. The results of molecular docking showed that active ingredients had good binding capacity with targets. The results of in vitro experiments confirm that, Sanwubai Powder could up-regulate the expression of apoptosis-related molecules Caspase-3 and Caspase-7, which to a certain extent confirmed the reliability of network pharmacological prediction and experimental design guidance. Conclusion The results of this study reflected the therapeutic characteristics of Sanwubai Powder with multiple components, multiple targets and multiple pathways, revealed the active components, key targets and important pathways of Sanwubai Powder in the treatment of gastric cancer, and provided research ideas and reference basis for further discussion on the mechanism of action.
〔Keywords〕 gastric cancer; Sanwubai Powder; network pharmacology; effect target; molecular docking; in vitro cell experiment
胃癌是最常見的惡性腫瘤之一,據全國腫瘤登記中心發布的數據顯示,我國胃癌的發生率及病死率位居各類腫瘤的第二位[1],已嚴重危害了人們的生命和健康。目前,胃癌的發病機制尚未完全明確,但不可否認的是,胃癌的發生發展是由癌基因和抑癌基因大量遺傳改變積累而成,導致多種信號通路失調,擾亂細胞周期和細胞增殖與死亡的平衡[2]。在治療上,早期胃癌缺乏特異性的癥狀與體征,導致其早期檢出率較低,多數患者在確診時已處于進展期,治療效果不佳,且無論是放化療,還是靶向治療,毒副作用都較大,嚴重降低了患者的生存質量,甚至可能因不能耐受而被迫終止治療。
中醫藥治療胃癌具有獨特優勢,其在減輕化療不良反應、增強療效、改善生存質量、延長生存期等方面發揮重要作用[3-4]。中醫學基于胃癌臨床癥狀,將其歸于“噎膈”“反胃”“積聚”等范疇,認為胃癌的發生發展是一個邪正斗爭、正邪力量不斷變化的過程,進展期胃癌表現為邪盛為主,兼顧正虛。在治療上,醫家張從正認為“醫之道,損有余乃所以補其不足”“不補之中有真補存焉”,突出強調了“祛邪以扶正”的治療原則[5]。三物白散是溫下攻邪的代表方,出自《傷寒論·辨太陽病脈證并治》:“寒實結胸,無熱證者,與三物白散”,方中巴豆溫通寒實、攻逐痰水;貝母消痰散結;桔梗宣暢氣機,輔以祛痰,共奏溫下逐瘀、消痰散結之功。前期研究[6]發現,三物白散治療胃癌具有確切的臨床療效,相關基礎實驗研究[7]證實了該復方能夠抑制胃癌細胞增殖,促進其凋亡,但其抗癌作用的分子機制尚未完全闡明。
中藥復方具有多成分、多靶點、多通路的整體性作用特點,其作用機制的研究較為復雜。網絡藥理學是發展于系統生物學和多向藥理學基礎上的,利用多種數據庫平臺及計算機軟件,構建藥物成分、作用靶點、疾病網絡關系,其整體性的研究策略與中醫學整體觀的理念不謀而合[8-9]。因此,本研究借助網絡藥理學系統地預測三物白散治療胃癌的活性成分、潛在靶點、信號通路,利用分子對接法初步模擬成分與靶點的結合,并結合體外實驗進行初步驗證,為后續深入研究提供參考依據。
1 資料
1.1? 主要材料及試劑
人胃癌細胞SGC-7901購自上海吉凱基因技術有限公司;SPF級雄性SD大鼠,體質量180~220 g,由湖南斯萊克景達實驗動物有限公司提供(動物合格證號:43004700030743),飼養于湖南中醫藥大學動物實驗中心[場地許可證號:SKY(湘)2013-0005]。
二甲基亞砜(北京索萊寶科技有限公司,批號:D8370);MTT試劑(北京索萊寶科技有限公司,批號:M8180);Giemsa染色液(北京索萊寶科技有限公司,批號:G1010);逆轉錄試劑盒(promega公司,批號:A3500);q-PCR mix(promega公司,批號:A6001)。三物白散混懸液由巴豆霜(含10%油)、浙貝母、桔梗以1∶3∶3組成,所需飲片購自湖南中醫藥大學第二附屬醫院中藥房。
1.2? 主要儀器
二氧化碳培養箱(德國 Eppendorf公司,型號:Galaxy 48 R);超凈工作臺(蘇州蘇凈儀器自控設備有限公司,型號:SW-CJ-1FD);倒置顯微鏡(德國ZEISS公司,型號:Axio Vert.A1);多功能酶標儀(美國BioTek公司,型號:Cytation3);臺式高速冷凍離心機(美國Thermo Scientific公司,型號:Fresco17);實時定量PCR儀(美國Bio-Rad公司,型號:CFX Connect)。
2 方法
2.1? 活性成分的篩選
利用TCMSP數據庫(http://lsp.nwu.edu.cn/tcmsp.php),檢索三物白散方中巴豆、浙貝母、桔梗3味藥物的化學成分,以口服生物利用度(OB)≥30%和化合物類藥性(DL)≥0.18為篩選標準[10],選出三物白散方中具有較高活性的成分。利用PubChem數據庫(https://pubchem.ncbi.nlm.nih.gov/),收集與校對活性成分的名稱,下載對應的活性成分信息,以3D結構保存為SDF格式,以備分子對接。
2.2? 作用靶點的篩選
2.2.1? 活性成分靶點預測? 利用TCMSP數據庫獲取三物白散活性成分的潛在作用靶點,利用UniProt數據庫(https://www.uniprot.org/),限定物種為“Homo sapiens”,對靶點進行規范化基因注釋。
2.2.2? 胃癌靶點篩選? 在GeneCards(https://www.genecards.org/)、OMIM(http://www.omim.org/)和TTD數據庫(http://db.idrblab.net/ttd/)三大數據庫中輸入檢索詞“gastric cancer”,收集胃癌相關的非重復靶基因。
2.2.3? 作用靶點篩選? 將胃癌相關靶點與藥物活性成分作用靶點進行匹配,最終獲得三物白散治療胃癌的作用靶點,用作后續分析。
2.3? “藥物成分-作用靶點”網絡構建
應用Cytoscape 3.8.0軟件將藥物活性成分與疾病作用靶點進行關聯,構建藥物活性成分與作用靶點的關系網絡圖,其中“節點(node)”代表活性成分、作用靶點,“邊(edge)”代表節點之間的相互關系,進而分析出主要的藥物活性成分。
2.4? 蛋白相互作用(PPI)和網絡拓撲分析
2.4.1? PPI網絡? 利用STRING數據庫(https://string-db.org)分析作用靶點,選擇Multiple Protein,限定物種為“Homo sapiens”,設定combined score>0.7,將獲得的信息導入Cytoscape 3.8.0軟件構建靶蛋白互作網絡,并對網絡圖進行拓撲分析,進一步篩選獲得核心靶點,網絡拓撲分析過程見方法“2.4.2”項。
2.4.2? 網絡拓撲分析? 將方法“2.4.1”項構建的PPI網絡分析結果導入Cytoscape 3.8.0軟件,根據3個主要參數度(DC)、度介中心度(BC)和接近中心度(CC)大于中位數進行網絡拓撲分析,篩選核心靶點。
2.5? 作用靶點GO和KEGG富集分析
應用R軟件對疾病與藥物共同作用靶點進行GO富集分析,將富集結果以柱狀圖形式呈現,分析其涉及的主要生物學過程。并應用R軟件對以上靶點進行KEGG通路富集分析,將結果以氣泡圖形式呈現,并根據P值的大小分析核心通路富集程度,以探討三物白散抗胃癌的可能作用機制。
2.6? 分子對接
選取PPI網絡拓撲分析后篩選出的核心靶蛋白作為核心受體蛋白,在PDB數據庫(https://www.rcsb.org)中輸入靶蛋白名稱,設置ORGANISM為“Homo sapiens”,選取分辨率高的靶蛋白三維結構。使用Pymol軟件對原受體蛋白pdb文件去除水分子及原配體分子,將處理后的受體和配體的pdb文件導入Auto Dock Tools,進行常規處理,保存為pdbqt的格式文件,再用Auto Grid得到對接位點參數,運行Auto Dock Vina[11]進行分子對接。以最低結合能作為靶蛋白和配體對接的結果,使用Pymol軟件進行分析及可視化。
2.7? SGC-7901細胞體外實驗驗證
2.7.1? 含藥血清制備? 將20只SD雄性大鼠適應性喂養7 d后,隨機分為空白對照組和三物白散組,每組10只。參照課題組前期研究的方法[12]進行含藥血清制備:三物白散組按0.07 g/kg劑量灌胃,空白對照組給予等體積生理鹽水灌胃,1 次/d,連灌7 d。于末次給藥1 h后,腹腔注射10%水合氯醛(4 mL/kg)麻醉后,腹主動脈采血,4 ℃下靜置4 h,以3 000 r/min離心20 min,分離血清。經56 ℃水浴鍋滅活30 min后,經0.22 ?滋m微孔濾膜無菌過濾后,放置于-20 ℃冰箱保存備用。
2.7.2? 細胞培養? SGC-7901細胞用含10%胎牛血清的DMEM培養基(含100 IU/mL青霉素、100 μg/mL鏈霉素),在37 ℃、5% CO2、飽和濕度條件下培養,至細胞生長至70%~80%開始傳代,以備后續實驗。
2.7.3? MTT法檢測細胞增殖活性? SGC-7901細胞分為空白對照組與三物白散組,空白對照組加入含5%空白對照組大鼠血清的DMEM培養基;三物白散組加入含5%含藥血清的DMEM培養基。培養48 h后,每孔加5 mg/mL MTT試劑10 ?滋L,繼續放入培養箱孵育4 h。棄培養液,每孔加DMSO 150 ?滋L,振蕩10 min。在490 nm波長下用酶標儀測定每孔吸光度(OD)值。
2.7.4? Giemsa染色法檢測細胞克隆形成? 將SGC-7901細胞以500個/孔接種到6孔板,每組設3個復孔。干預方法同上。當6孔板中出現肉眼可見克隆時終止培養,PBS浸洗細胞2次,甲醇固定5 min,Giemsa染色30 min,沖去染色液,室溫下干燥。在顯微鏡下計數含50個細胞以上的細胞克隆數。
2.7.5? q-PCR法檢測Caspase-3、Caspase-7 mRNA的表達? 提取各組細胞總RNA,按試劑盒指導逆轉錄為cDNA。Caspase-3上游引物為5-TGGAAGCGAATCAATGGACTCTGG-3,下游引物為5-CCAGACCGAGATGTCATTCCAGTG-3,擴增片段為132 bp;Caspase-7上游引物為5-GCTGACTTCCTCTTCGCCTATTCC-3,下游引物為5-TGCCTGGCAACTCTGTCATTCAC-3,擴增片段為167 bp。β-actin上游引物為5-TATGACTT GTTGCGTTACAC-3,下游引物為5-CCTTCCCGTTCAGTTT-3,擴增片段為155 bp。按如下程序擴增:94 ℃ 4 min;94 ℃ 40 s,60 ℃ 30 s,×40 cycle。導出CT值,采用2-?葒?葒CT法計算mRNA的相對表達量。
2.7.6? 統計學方法? 采用SPSS 21.0進行統計分析,數據以“x±s”表示,若滿足正態性和方差齊性,兩組間比較采用獨立樣本t檢驗,均以P<0.05為差異有統計學意義。
3 結果
3.1? 活性成分及作用靶點
通過檢索TCMSP共檢索到三物白散方中化學成分158個,其中包括桔梗102個,浙貝母17個,巴豆39個。以OB≥30%和DL≥0.18為條件篩選出18個化學成分,去重后得到17個活性成分。見表1。
3.2? 作用靶點的篩選結果
通過TCMSP數據庫共得到三物白散活性成分潛在作用靶點176個,其中巴豆35個、桔梗85個、浙貝母56個,剔除重復部分,共有潛在靶點90個。利用Genecards、OMIM、TTD 3個數據庫分別獲得8 611、170、37個與胃癌相關的疾病靶基因,整合數據并刪除重復靶點,獲得與胃癌相關的靶點共8 633個。將藥物活性成分靶點與疾病靶點取交集,最終收集84個共同作用靶點用于后續分析。見圖1。
3.3? “藥物成分-作用靶點”網絡
為進一步分析三物白散中發揮抗胃癌的關鍵活性成分,應用Cytoscape軟件將11個藥物成分與84個作用靶點進行關聯,構建“藥物成分-作用靶點”網絡(圖2),共包括95個節點(藥物活性成分11個,作用靶點84個)和134條邊,結果顯示三物白散關鍵作用成分有木犀草素(luteolin,與51個靶點相關),?茁-谷甾醇(beta-sitosterol,與25個靶點相關),金合歡素(acacetin,與21個靶點相關)及天竺葵素(pelargonidin,與13個靶點相關),這些關鍵作用成分主要是黃酮類和甾醇類。
3.4? PPI網絡構建與分析
將84個共同靶點輸入STRING數據庫,得到靶蛋白間互作關系,節點數(靶點蛋白)78個,邊數(蛋白間相互作用)441條,將數據導入Cytoscape 3.8.0軟件構建PPI網絡。并采用CytoNCA插件,根據DC、BC、CC對此網絡進行拓撲分析,選取大于中位值的靶點構建三物白散抗胃癌的核心靶點網絡。對由78個節點和441條邊組成的PPI網絡進行篩選,經過第1次篩選(DC≥10,BC≥25.581 7,CC≥0.450 2)初步得到含26個節點和172條邊的互作網絡圖,經過第2次篩選(DC≥12,BC≥5.003 9,CC≥0.657 9)得到含12個節點和57條邊的核心作用網絡(圖3),12個核心靶點信息詳見表2。
將12個核心靶點與其他靶點進一步構建PPI網絡,按節點大小降序排序(圖4),節點越大說明該靶點連接的節點越多,在網絡中作用越重要,如TP53、AKT1、MAPK1、JUN、CASP3、CCND1等,可作為三物白散抗胃癌的潛在作用靶點。
3.5? GO功能富集分析
應用R軟件對共同靶點進行GO富集分析,得到柱狀圖(圖5),主要涉及外源性凋亡信號通路、半胱氨酸型內肽酶活性參與凋亡過程、細胞對藥物的反應、肌細胞增殖、細胞周期蛋白依賴性蛋白激酶全酶復合物等生物學過程,體現了三物白散抗胃癌作用可能通過調控多種生物學過程協同作用的結果。
3.6? KEGG通路富集分析
為了揭示三物白散對胃癌的抗癌作用機制,應用R軟件對篩選出的84個共同靶點進行KEGG富集分析,節點的大小表示富集到該通路的靶點數目,節點越大表示靶點富集數目越多;節點的顏色由藍色至紅色表示P值大到小,故紅色節點越大表明信號通路的顯著性越高,作用越重要。圖6中列出了排名前30的信號通路,包括PI3K-Akt、p53、HIF-1及IL-17等涉及調控細胞凋亡、缺氧代謝、免疫炎癥等的信號通路,提示了三物白散可通過多條通路發揮抗胃癌作用,且作用靶點可作用于多條通路發揮作用,通路間存在著較為復雜的交互作用。
3.7? 分子對接結果分析
利用Auto Dock Vina軟件,將12個核心靶蛋白與對應的活性成分進行分子對接,結果見表2,結合能<-5.0 kcal/mol,表明靶蛋白與活性成分結合性好,且結合能越小表明兩者對接越好[13]。TP53與luteolin、AKT1與luteolin、MAPK1與luteolin、JUN與luteolin、CASP3與beta-sitosterol、CCND1與luteolin、EGFR與luteolin、AR與luteolin、VEGFA與luteolin、ESR1與6-Methoxyl-2-acetyl-3-methyl-1,4-naphthoquinone-8-O-beta-D-glucopyranoside、RELA與acacetin、MMP9與luteolin為靶蛋白與活性成分對接最好的組合。見圖7。
3.8? 體外實驗驗證結果
3.8.1? 細胞活性檢測結果? MTT檢測結果表明,與空白對照組比較,三物白散組細胞增殖活性明顯降低(P<0.05)。見圖8。
3.8.2? 細胞克隆形成實驗結果
與空白對照組比較,三物白散組SGC-7901細胞克隆形成數顯著降低(P<0.05)。見圖9。
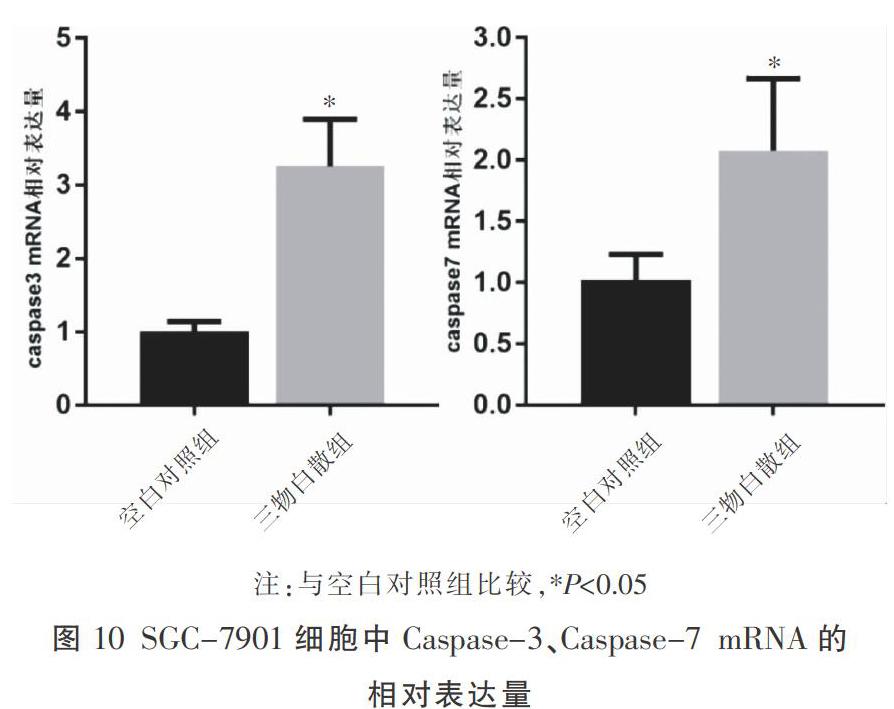
3.8.3? 靶基因Caspase-3、Caspase-7 mRNA的表達? 與空白對照組相比,三物白散組Caspase-3、Caspase-7 mRNA的表達量顯著增高(P<0.05)。見圖10。
4 討論
研究[7,14-15]發現,三物白散可通過抑制腫瘤細胞增殖、拮抗多藥耐藥、減少免疫抑制因子釋放等方面抑制胃癌發展,并能在整體水平上發揮抗腫瘤免疫正相調節作用,但其具體分子機制尚不清楚。因此,本研究采用網絡藥理學和分子對接法,對三物白散抗胃癌的藥效物質及其作用機制進行了探討。
通過構建藥物活性成分-作用靶點網絡、PPI網絡及對PPI網絡進行拓撲分析,得到核心靶點及相作用的藥物活性成分關系,利用分子對接法對兩者進行初步模擬驗證,證實其具有良好的結合能力,發現木犀草素、金合歡素、β-谷甾醇、天竺葵素等可能是三物白散抗胃癌作用的關鍵藥效成分。木犀草素具有抑制胃癌細胞集落形成、遷移、侵襲及促進細胞凋亡的作用,參與調控胃癌細胞PI3K/AKT等信號通路[16]。β-谷甾醇可抑制腫瘤細胞增殖,誘導其發生細胞凋亡,其機制可能與上調凋亡相關分子Caspase-3、Caspase-8及Caspase-9 mRNA和蛋白的表達相關[17]。金合歡素可通過線粒體通路,即金合歡素減少Bcl-2表達,Bax/Bcl-2比例上調,引發線粒體膜電位的喪失,誘導細胞色素C的釋放,啟動Caspase級聯反應,激活下游的Caspase-3,誘導腫瘤細胞凋亡[18]。天竺葵素具有抗細胞腫瘤轉化的防御作用,其分子機制可能是通過Nrf2啟動子去甲基化激活Nrf2-ARE防御途徑[19]。同時發現一個活性成分可作用多個靶蛋白,一個靶蛋白亦能同時被多個活性成分干預,不同靶蛋白之間可通過直接或間接作用組成強大的互作網絡,充分說明了三物白散是通過多種活性成分作用于多靶點協同發揮抗癌效應。
通過對靶點進行功能富集分析,其涉及的生物學過程主要有凋亡信號通路的調控、半胱氨酸型內肽酶活性參與凋亡過程、細胞對藥物的反應、肌細胞增殖、細胞周期蛋白依賴性蛋白激酶全酶復合物等。靶點通路富集分析結合已有研究發現[20-23],胃癌的發生發展與PI3K-AKT、p53、HIF-1、IL-17等多條信號通路相關。細胞異常增殖、凋亡抑制在腫瘤發生發展過程中起著重要作用,PI3K-AKT信號通路對細胞增殖起促進作用,PI3K和AKT蛋白激活后可促進下游抗凋亡蛋白Bcl-2和Bcl-xL的表達增強,其異常可導致包括胃癌在內的惡性腫瘤的發生、發展[24-25]。p53是人體內與腫瘤相關性最高的抑癌基因,具有重要的促使細胞周期停滯和細胞凋亡的功能[26-27],故可介導2條信號通路:其一,是p53能轉錄上調細胞周期素依賴性激酶抑制因子p21的表達,導致細胞周期停滯[28];其二,是通過下調Bcl-2、上調Bax,使Bcl-2/Bax蛋白比例下降,進而激活線粒體通路中的Caspase-9和Caspase-3,觸發Caspase級聯反應引起細胞凋亡[29-30]。缺氧在腫瘤的發展和進程中起著重要作用,HIF-1信號通路對血管內皮細胞、巨噬細胞具有細胞特異性反應,已證實在多種腫瘤細胞中過表達的HIF-1α,可上調促血管生成因子VEGF的表達,誘導血管生成,發揮促癌作用[31]。炎癥細胞因子IL-17在炎癥相關癌變中發揮重要作用,其可通過JAK2/STAT3信號通路促進胃癌細胞的上皮間質轉化[32-33]。因此,推測三物白散活性成分可能通過靶向作用于介導腫瘤細胞增殖、凋亡、缺氧及炎性微環境的關鍵信號通路發揮抗胃癌作用。
體外細胞實驗結合前期研究[12]結果證實,三物白散具有抑制人胃癌SGC-7901細胞增殖、誘導其凋亡、抑制其遷移的作用。通過網絡藥理學方法,對三物白散的作用靶點進行GO和KEGG富集分析,發現其主要涉及對凋亡信號通路的調控,細胞凋亡抵抗是腫瘤發生發展的重要機制之一,Caspase家族對細胞凋亡具有十分重要的作用,在預測的藥物作用靶點中涉及多個Caspase家族成員,有Caspase-3、Caspase-7、Caspase-8及Caspase-9,其中Caspase-8和Caspase-9屬于細胞凋亡的啟動分子[34-35],Caspase-3和Caspase-7是執行細胞凋亡的效應分子[36]。經qPCR法驗證,三物白散可上調Caspase-3和Caspase-7 mRNA的表達,在一定程度上驗證了本研究中網絡藥理學篩選結果的準確性和可靠性。
綜上所述,本研究借助網絡藥理學和分子對接的方法,預測了三物白散抗胃癌的藥效物質、作用靶點,系統分析了其潛在的分子機制,充分體現了中藥復方多成分、多靶點、多通路協同治療的獨特優勢。同時,細胞實驗結果初步證實了網絡藥理學的預測結果有一定的可靠性,為后續指導實驗設計、研發新藥、推廣臨床應用提供依據。
參考文獻
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA: A Cancer Journal for Clinicians, 2016, 66(2): 115-132.
[2] BERGER H, MARQUES M S, ZIETLOW R, et al. Gastric cancer pathogenesis[J]. Helicobacter, 2016, 21(Suppl 1): 34-38.
[3] 李朝燕,趙愛光,竹永寶,等.基于健脾法探討中藥胃腸安對晚期胃癌的影響[J].中華中醫藥雜志,2019,34(5):2012-2017.
[4] 蔡俊媛,金? 宇,林? 洪,等.健脾益氣中藥佐治晚期胃癌療效及對生活質量的影響[J].現代中西醫結合雜志,2019,28(33):3711-3714.
[5] 濮文淵,凌? 云,張? 曦,等.抗腫瘤中藥的耐藥潛質: 假說的建立及對未來研究的思考[J].中醫雜志,2013,54(19):1627-1629.
[6] 朱? 瑩,袁偉建,張曉江,等.加味三物白散方治療進展期胃癌臨床研究[J].中國中醫急癥,2010,19(4):578-580.
[7] 鄒君君,朱? 瑩.三物白散對人胃癌SGC-7901細胞增殖、凋亡的影響[J].中國中醫急癥,2011,20(5):749-750,761.
[8] 王? 萍,唐仕歡,蘇? 瑾,等.基于整合藥理學的中藥現代研究進展[J].中國中藥雜志,2018,43(7):1297-1302.
[9] 陳銘泰,肖? 嬌,林海丹,等.基于網絡藥理學探討逍遙散對動脈粥樣硬化和抑郁癥“異病同治”的作用機制[J/OL].中國中藥雜志:1-13[2020-03-23].https://doi.org/10.19540/j.cnki.cjcmm.20200227.401.
[10] 歐陽效強,饒? 煉,雷? 敏,等.基于網絡藥理學探討加味二至丸治療動脈粥樣硬化的作用機制[J].中國實驗方劑學雜志,2020,26(3):175-182.
[11] TROTT O, OLSON A J. AutoDock Vina: Improving the speed and accuracy of docking with a new scoring function, efficient optimization, and multithreading[J]. Journal of Computational Chemistry, 2010, 31(2): 455-461.
[12] 范婧瑩,婁? 余,張? 娜,等.三物白散對Survivin-RNA基因沉默轉染胃癌SGC-7901細胞凋亡、遷移的影響[J].湖南中醫藥大學學報,2019,39(8):937-942.
[13] 莊? 莉,翟園園,姚衛峰,等.基于網絡藥理學的二至丸對腎臟保護作用的機制研究[J].藥學學報,2019,54(5):877-885.
[14] 徐? 力,王明艷,許冬青,等.三物白散加味方影響腫瘤多藥耐藥基因表達實驗研究[J].上海中醫藥雜志,2005,39(8):59-60.
[15] 王? 梅,劉紅艷,周春祥.三物白散整體水平抗腫瘤免疫正相調節效應研究[J].南京中醫藥大學學報,2006,22(2):83-85.
[16] PU Y S, ZHANG T, WANG J H, et al. Luteolin exerts an anticancer effect on gastric cancer cells through multiple signaling pathways and regulating miRNAs[J]. Journal of Cancer, 2018, 9(20): 3669-3675.
[17] 趙秀紅.β-谷甾醇對肝癌HepG2細胞增殖和凋亡的影響及機制研究[D].蘭州:蘭州大學,2018.
[18] KIM C D, CHA J D, LI S J, et al. The mechanism of acacetin-induced apoptosis on oral squamous cell carcinoma[J]. Archives of Oral Biology, 2015, 60(9): 1283-1298.
[19] LI S Y, LI W J, WANG C, et al. Pelargonidin reduces the TPA induced transformation of mouse epidermal cells-potential involvement of Nrf2 promoter demethylation[J]. Chemico-Biological Interactions, 2019, 309: 108701.
[20] 陳龍云,柳? 葉.槲皮苷通過抑制PI3K/AKT信號通路誘導胃癌SGC7901細胞凋亡[J].中國病理生理雜志,2018,34(11):1976-1980.
[21] 蔡甜甜,潘華峰,張成哲,等.黃芪甲苷保護胃癌前病變大鼠胃黏膜損傷研究[J].中華中醫藥雜志,2018,33(9):4066-4070.
[22] 馬玉濱,燕? 速,于鵬杰,等.低氧誘導因子-1α在胃癌組織中表達水平及分子作用機制研究[J].中國免疫學雜志,2017,33(12):1799-1803.
[23] WU X Q, ZENG Z R, XU L X, et al. Increased expression of IL17A in human gastric cancer and its potential roles in gastric carcinogenesis[J]. Tumor Biology, 2014, 35(6): 5347-5356.
[24] 張紅娜,鄒佳楠,李? 昆,等.基于網絡藥理學推測和分子生物學驗證探討半枝蓮抗胰腺癌的活性成分及其作用機制[J].中草藥,2020,51(12):3234-3245.
[25] MAYER I A, ARTEAGA C L. The PI3K/AKT pathway as a target for cancer treatment[J]. Annual Review of Medicine, 2016, 67: 11-28.
[26] REYES J, CHEN J Y, STEWART-ORNSTEIN J, et al. Fluctuations in p53 signaling allow escape from cell-cycle arrest[J]. Molecular Cell, 2018, 71(4): 581-591.
[27] ROBIN M, ISSA A R, SANTOS C C, et al. Drosophila p53 integrates the antagonism between autophagy and apoptosis in response to stress[J]. Autophagy, 2019, 15(5): 771-784.
[28] 涂? 瀟,李? 雷,張海波,等.一種新的MDM2-p53信號通路抑制劑的研究[J].四川大學學報(自然科學版),2019,56(2):369-376.
[29] 蔡甜甜,林? 琳,潘華峰,等.三七總皂苷激活JNK信號通路對胃癌前病變大鼠胃黏膜組織的保護作用[J].中華中醫藥雜志,2019,34(12):5877-5880.
[30] 甘彩玉,鄭作文,梁冰潔,等.從PI3K/Akt/p53通路探討藤茶總黃酮抗肝癌的作用機制[J].中國實驗方劑學雜志,2019,25(12):90-96.
[31] YE J W, CHEN K L, QI L, et al. Metformin suppresses hypoxia induced migration via the HIF 1α/VEGF pathway in gallbladder cancer in vitro and in vivo[J]. Oncology Reports, 2018, 40(6): 3501-3510.
[32] ZHOU F, QIU L X, CHENG L, et al. Associations of genotypes and haplotypes of IL-17 with risk of gastric cancer in an eastern Chinese population[J]. Oncotarget, 2016, 7(50): 82384-82395.
[33] LI S, CONG X L, GAO H Y, et al. Tumor-associated neutrophils induce EMT by IL-17a to promote migration and invasion in gastric cancer cells[J]. Journal of Experimental & Clinical Cancer Research, 2019, 38(1): 6.
[34] IWAI N, YASUI K, TOMIE A, et al. Oncogenic miR-96-5p inhibits apoptosis by targeting the Caspase-9 gene in hepatocellularcarcinoma[J]. International Journal of Oncology, 2018, 53(1): 237-245.
[35] FULDA S. Caspase-8 in cancer biology and therapy[J]. Cancer Letters, 2009, 281(2): 128-133.
[36] BRENTNALL M, RODRIGUEZ-MENOCAL L, DE GUEVARA R L, et al. Caspase-9, Caspase-3 and Caspase-7 have distinct roles during intrinsic apoptosis[J]. Bmc Cell Biology, 2013, 14: 32.
(本文編輯? 匡靜之)

