潰瘍性結腸炎中小鼠腸道菌群和M1型巨噬細胞異常激活的關系研究
秦和平,石 喆,韋天靈,萬 敏,潘信義,廖耀云,陳祖平
(柳州市人民醫院,廣西 柳州 545006)
潰瘍性結腸炎(UC)是發生在結直腸的一類慢性非特異性炎癥,近10年來,該病在我國的發病率逐年提高[1]。由于UC的致病原因及發病機制尚不明確,臨床上無特異性治療方法,多采用對癥治療以緩解病情,因此其病情容易反復,難以根治,且隨著病程增加,結腸癌的發生風險也大大提高[2]。目前認為腸道菌群失調及巨噬細胞免疫應答異常在UC的發病過程中起著重要作用,研究者通過糞便菌群移植(FMT)改善失調的腸道菌群能在一定程度上改善實驗對象的黏膜病變情況、疾病活動指數、降低炎癥水平等[3]。同時,靶向調節巨噬細胞的免疫活性能有效改善UC患者的臨床癥狀和腸道組織學病變[4]。研究證實,M1型巨噬細胞可以被革蘭陰性菌產物脂多糖(LPS)激活,進而釋放大量促炎細胞因子參與異常的免疫調控反應,參與誘導UC形成[5]。但腸道菌群和M1型巨噬細胞異常激活在UC發病中的關系還不明確。為此,本研究擬從動物實驗水平進行研究,旨在探討腸道菌群和M1型巨噬細胞異常激活的關系,為UC臨床治療提供新的途徑。
1 材料與方法
1.1 實驗動物 實驗動物采用雄性BALB/c小鼠( 購自廣東省醫學實驗動物中心,動物許可證號:SCXK(粵)2018-0002) ,7~8周齡,18~22 g,共60只,SPF級。隨機數表法分為實驗組和對照組,各30只,實驗組制備DSS結腸炎小鼠模型,對照組無處理。實驗前所有小鼠給予標準飼養,環境溫度為20~24℃,相對濕度為55%~60%,自由飲水及日常光照。
1.2 實驗方法
1.2.1 DSS結腸炎小鼠模型制備 實驗前24 h小鼠禁食不禁水,24 h后將小鼠空中懸尾,使其通過掙扎排凈腸道糞便。24 h后實驗組小鼠給予5%DSS溶液(其中DDS購自MP Biomedicals公司,將DSS溶于蒸餾水中配制成5%DSS溶液)自由飲用,連續14 d,形成DSS結腸炎小鼠模型。
1.2.2 菌群分析 取兩組小鼠的糞便,使用DNA提取試劑盒(北京紐樸生物技術有限公司)對糞便菌群進行總DNA提取,提取后的DNA樣本送吉凱基因生物有限公司進行16SrRNA測序分析與菌群鑒定,質檢合格后使用16S rRNAV4區引物進行PCR擴增35個循環。PCR產物經NanoDrop檢測合格后使用美國Illumina公司的Solexa第二代高通量測序平臺進行雙端測序。測序完成后采用Silva數據庫分析樣本,主要對腸道菌群進行物種對比和注釋,使用BugBase進行表型預測,并對菌群α多樣性進行分析。菌群α多樣性指標包括菌群豐度指標(Chao1和ACE)以及菌群多樣性(Shannon和Simpson指數),其中,Chao1和ACE值越大代表物種總數越多;Shannon值越大或Simpson 指數值越小,說明群落多樣性越高。
1.2.3 糞便菌群移植 DSS結腸炎小鼠模型建立后第1天,將BALB/c健康小鼠糞便菌群移植到DSS結腸炎小鼠體內,24 h后頸椎脫臼法處死小鼠;同時,將DSS結腸炎小鼠的糞便菌群移植到BALB/c健康小鼠體內,24 h后頸椎脫臼法處死小鼠。實驗組取病變部位、對照組小鼠取對應腸段的結腸黏膜組織切片均行HE染色及免疫組化染色標識M1型巨噬細胞,對M1型巨噬細胞的免疫組化染色情況進行評估。
1.2.4 M1型巨噬細胞免疫組化染色分析 所取結腸黏膜組織蠟塊行切片、二甲苯脫蠟、乙醇脫二甲苯、水化等操作。浸入PH6.0的檸檬酸緩沖液加熱至98℃ 12 min修復抗原,滴加一抗iNOS抗體(EPR16635, Abcam, Cambridge, MA, USA)和通用型二抗IgG抗體-HRP多聚體,37℃孵育30 min,評估染色情況。iNOS蛋白的表達模式為細胞漿。染色強度分值如下:0分(無染色)、1分(淺黃色,弱陽性)、2分(黃棕色,中陽性);3分(棕色,強陽性)。陽性細胞百分比分值為:0(無細胞陽性)、1分(<25%細胞陽性)、2分(25%~50%細胞陽性)和3分(>50%細胞陽性),染色情況總分數為染色強度與陽性細胞分值的乘積。總分值<3分定義為蛋白低表達,≥3分定義為蛋白高表達。
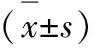
2 結果
2.1 兩組小鼠糞便菌群的LEfSe分析 16S RNA分析結果顯示,兩組小鼠的糞便菌群分布存在明顯差異。實驗組中,擬桿菌、克雷伯桿菌、變形桿菌、無色桿菌屬等占主要優勢(LDA>log10),而對照組中以乳酸桿菌屬、小類桿菌屬、埃希菌屬等占主要優勢。
移植前,UC組小鼠腸道中在門水平,擬桿菌門、變形菌門及β-變形亞菌門是優勢菌群,在綱水平,擬桿菌綱是優勢菌群,在目水平,擬桿菌目、放線菌目、芽孢桿菌目是優勢菌群,在科水平,擬桿菌科、布坦堡菌科、鏈球菌科是優勢菌群,在屬水平,擬桿菌屬、微桿菌屬、無色菌屬、克雷伯氏菌屬、寡養單胞菌屬是優勢菌群;對照組中在門水平,厚壁菌門、負菌門(革蘭氏陰性的厚壁菌門)、γ-變形菌門是優勢菌群,在綱水平,梭菌綱、是優勢菌群,在目水平,乳桿菌目、梭菌目、腸桿菌目是優勢菌群,在科水平,普雷沃特菌科、乳桿菌科、毛螺桿菌科、氨基酸球菌科、腸桿菌科是優勢菌群,在屬水平,乳酸桿菌屬、小類桿菌屬、埃希菌屬是優勢菌群。
移植前,UC組小鼠腸道中的優勢菌群,在屬水平是克雷伯氏菌屬、無色菌屬、寡養單胞菌屬、擬桿菌屬、微桿菌屬,在科水平是擬桿菌科、鏈球菌科、布坦堡菌科,在目水平是擬桿菌目、放線菌目、芽孢桿菌目,在綱水平是擬桿菌綱,在門水平是β-變形菌門及變形菌門;對照組中優勢菌群屬水平是埃希氏菌屬、小類桿菌屬,在科水平是腸桿菌科、乳桿菌科、氨基酸球菌科、毛螺桿菌科、普雷沃特菌科,在目水平是腸桿菌目、乳桿菌目、月形單胞菌目、梭菌目,在門水平是γ-變形菌門、負菌門(革蘭氏陰性的厚壁菌門)。
2.2 兩組小鼠糞便菌群α多樣性的對比 實驗組小鼠的Chao1、ACE指數及Simpson指數明顯高于對照組,Shannon指數明顯低于對照組,差異有統計學意義(P<0.05),見表1。

表1 兩組小鼠菌群α多樣性指標的對比
2.3 兩組小鼠糞便菌群移植后腸粘膜M1型巨噬細胞的病理結果對比 將對照組小鼠的糞便菌群移植到實驗組小鼠后,實驗組小鼠腸黏膜M1型巨噬細胞的數量顯著降低,見圖1;將實驗組小鼠的糞便菌群移植到對照組小鼠后,對照組小鼠腸黏膜M1型巨噬細胞的數量顯著增加,差異有統計學意義(P<0.05)。見表2。

圖1 移植前UC組小鼠糞便菌群腸黏膜組織M1型巨噬細胞的HE(×100)及免疫組化染色結果(×100)

表2 兩組小鼠糞便菌群移植后腸粘膜M1型巨噬細胞的病理結果對比
2.4 不同病原菌水平與M1型巨噬細胞水平的相關性 擬桿菌、克雷伯桿菌、變形桿菌、無色桿菌等病原菌相對豐度與小鼠糞便菌群移植前腸黏膜M1型巨噬細胞的病理評分對比均呈正相關(P<0.05)。見表3。

表3 不同病原菌水平與小鼠糞便菌群移植前腸黏膜M1型巨噬細胞病理評分的相關性
2.5 不同病原菌水平與M1型巨噬細胞水平的多因素Logistic回歸分析 多因素Logistic回歸分析顯示,擬桿菌水平是小鼠糞便菌群移植前腸黏膜M1型巨噬細胞水平的獨立危險因素,見表4。

表4 不同病原菌水平與M1型巨噬細胞水平的多因素Logistic回歸分析
3 討論
腸道菌群失調和免疫異常在UC發病中均被認為有重要作用。但由于尚未明確UC致病的特定菌種,因此目前認為腸道菌群失調后協同作用共同參與UC致病[6]。而巨噬細胞是免疫系統中十分重要的一類免疫細胞,具有吞噬病原體、抗原呈遞、分泌細胞因子等多種作用,其M1亞型異常激活被認為是UC發生的一個重要環節[7-8]。
巨噬細胞被周圍微環境中的T淋巴細胞輔助因子和病原體等極化后可分化為M1型巨噬細胞和M2型巨噬細胞。其中M1型巨噬細胞主要發揮促炎作用,LPS是該類巨噬細胞最有效的激活信號,LPS通過與M1型巨噬細胞表面的Toll樣受體4(TLR4)作用,激活MyD88和MaL/TirapM2依賴的信號轉導通路進而促進炎性因子釋放,如IFN-b, IL-12,TNF,IL-6和IL-1β等,發揮促炎作用[9-10]。因此革蘭氏陰性菌在巨噬細胞極化為M1型巨噬細胞的發育中具有重要作用。研究發現,在UC中,結腸黏膜的固有層存在較多M1 型巨噬細胞,這些巨噬細胞較正常結腸黏膜內的巨噬細胞有更高的激活狀態,對細菌及其產物表現為高敏感性,能產生大量促炎細胞因子[11-12]。由于UC中同時存在異常數量及活性的菌群,我們推測這些異常的菌群可能通過LPS等方式異常激活M1型巨噬細胞,從而在UC發病中發揮作用。M1型巨噬細胞表達誘導型一氧化氮合酶(iNOS)用于促進一氧化氮合成,此外其細胞表面還特異性表達共刺激因子CD16/32等,因此這些標記物可用于M1型巨噬細胞的鑒別標記[13]。
本研究通過對DSS結腸炎動物模型研究,發現DSS結腸炎小鼠的腸道菌群總數明顯增加,但多樣性明顯降低,提示DSS結腸炎小鼠存在明確的菌群失調現象,且失調菌群中以擬桿菌、克雷伯桿菌、變形桿菌、無色桿菌屬等占主要優勢。腸道的正常菌群不但可以對其他菌群產生生物拮抗作用,防止致病菌的異常攻擊,正常菌群之間還存在活性功能等相互制約,保持生物個體內環境的穩定[14]。當菌群失調發生后,菌群間的制約能力及防御外來菌的能力均下降,腸道黏膜便成為被攻擊的對象而產生諸類病理反應[15]。此外,通過對M1型巨噬細胞的免疫組化標記發現,在DSS結腸炎小鼠的腸道中M1型巨噬細胞特異性的標記物均明顯增多,提示DSS結腸炎小鼠的M1型巨噬細胞較正常小鼠黏膜明顯增多。M1型巨噬細胞即經典的巨噬細胞亞型,主要被微生物產物LPS等和炎性因子激活,發揮高效的抗原呈遞作用,釋放促進炎癥反應的細胞因子,直接發揮促炎作用或促進Th1型免疫應答引起炎癥反應[16-18]。可見在UC中,失調菌群和異常激活的M1型巨噬細胞均有重要致病作用。
此外,將正常小鼠的糞便菌群移植到DSS結腸炎小鼠后,其腸黏膜M1型巨噬細胞的數量顯著降低,而將DSS結腸炎的糞便菌群移植到正常小鼠后,其腸黏膜M1型巨噬細胞的數量顯著增加,提示在UC中腸道菌群的變化與M1型巨噬細胞異常激活存在關聯,且相關性分析證明擬桿菌(在M1型巨噬細胞異常激活中有更為重要的誘導作用。當菌群失調后,正常菌群對擬桿菌(原為大腸桿菌)的拮抗作用降低,使得擬桿菌的致病力和侵襲性增強,從而對腸道黏膜造成攻擊[19]。由于UC是一種非特異性炎癥,因此推測擬桿菌等致病菌對UC的致病并非直接感染,而是通過激活免疫系統產生異常的免疫反應。LPS是大腸桿菌的常見產物,其恰好能通過對M1型巨噬細胞的異常激活形成異常的免疫應答,繼而促進Th1類淋巴細胞的免疫應答作用發揮[20]。國外學者Stout等人[21]研究發現在特定病原體存在情況下,體外培養的巨噬細胞經LPS誘導可激活成為M1型巨噬細胞,提示確實存在異常的病原菌可以通過LPS機制誘導M1型巨噬細胞的異常激活,驗證了本實驗的結果。由于本研究結果尚局限于實驗動物階段,有待于行進一步的臨床實驗以證實實驗結果及推論。
綜上所述,DSS結腸炎小鼠存在腸道菌群失調現象,其菌群失調,尤其是擬桿菌與M1型巨噬細胞異常激活有直接相關性,健康小鼠糞便菌群的移植能夠抑制DSS結腸炎小鼠M1型巨噬細胞的異常激活。

