七氟烷對心肌缺血再灌注損傷模型大鼠心肌的保護作用及其機制
白雪 宋思宜 郭海燕 趙洋 王士雷 李瑜
(青島大學附屬醫院麻醉科,山東 青島 266003)
心肌缺血再灌注損傷(MIRI)是臨床常見的病理過程,是冠心病發病以及心肌血運重建治療過程中心肌損傷的核心環節,如何減輕缺血再灌注損傷一直是國際研究的熱點之一。七氟烷是目前臨床應用最為廣泛的吸入性麻醉藥。研究發現,圍手術期吸入七氟烷對心肌有保護作用[1-2]。隨著研究的深入,SARKAR等[3]證實七氟烷后處理(SPC)可調節圍手術期患者心血管系統的功能,如增加心肌收縮力、減輕MIRI所致心肌梗死等。在糖尿病大鼠受損的心肌組織中,SPC可顯著上調HIF1α及其下游遞質血管內皮生長因子蛋白的表達,減少心肌梗死面積,改善心臟功能[4]。研究表明,HIF2α可以誘導雙調蛋白(AREG)的表達[5],該研究首次提出心肌細胞特異性HIF2α能增加心肌缺血耐受性,并且AREG可抑制HIF2α缺失小鼠的MIRI。但七氟烷對心肌細胞的保護作用是否與HIF2α-AREG通路有關,目前尚不明確。本研究通過構建大鼠MIRI模型,檢測經不同方式處理的大鼠血流動力學、心肌梗死面積的變化,以及大鼠心肌組織中促凋亡蛋白Bax及抗凋亡蛋白Bcl-2表達的變化,探討七氟烷對心肌細胞的保護作用及其與HIF2α-AREG通路的相關性。
1 材料及方法
1.1 材料
1.1.1實驗動物 成年清潔級雄性SD大鼠45只,體質量280~320 g,由山東省實驗動物中心提供,生產許可證號:SCXK(魯)20140007。實驗前大鼠于安靜環境下,24 ℃恒溫飼養3~4 d,正常飲食,12-12 h明暗交替光照。所有大鼠實驗前12 h禁食不禁水。
1.1.2主要試劑及實驗設備 AREG蛋白購自加拿大Biomatik公司,PT2385購自美國MCE公司,兔抗大鼠Bax、Bcl-2抗體購自武漢三鷹公司,正置白光顯微鏡(日本Olympus公司),HX-100E小動物呼吸機購自成都泰盟科技有限公司。蛋白電泳系統購自美國BIO-RAD公司。
1.2 方法
1.2.1動物分組及處理 根據處理方法不同將大鼠隨機分為A、B、C、D、E組,每組9只大鼠。
A組在MIRI模型制備過程中[6],分離出左冠狀動脈前降支(LAD)后,在LAD下方穿線但不結扎,觀察160 min;B組在建立大鼠MIRI模型后,結扎LAD 40 min,隨后松開結扎線再灌注120 min;C組在B組操作的基礎上,再灌注開始時大鼠先吸入體積分數0.024的七氟烷15 min,然后停止吸入七氟烷繼續再灌注105 min;D組于MIRI模型制備前1 h先腹腔注射HIF2α阻滯劑10 mg/kg,其后操作同C組;E組大鼠于LAD結扎前15 min經頸內靜脈注射AREG蛋白50 μg,其余操作同D組。處理過程中每組隨機選取5只大鼠,分別檢測缺血前、缺血15 min及再灌注2 h末的心率和血壓。
1.2.2標本處理及各項指標的檢測 ①上述各組大鼠處理結束后,每組隨機選取3只大鼠切取的心尖組織,HE染色后,顯微鏡下觀察心肌細胞的形態;②每組再隨機選取3只大鼠,均再次結扎LAD后,在頸內靜脈注射伊文斯藍溶液3 mL,當大鼠眼睛內出現伊文斯藍時,快速取下心臟,保留左心室部分,生理鹽水沖洗后,于-80 ℃冰箱冷凍后切薄片,TTC染液脫色,置于37 ℃水浴箱中15 min,然后用組織固定液固定過夜,分離左心室和梗死部分(白色部分)并分別稱質量,比較各組大鼠心肌梗死質量占左心室質量的比值;③每組取剩余3只大鼠,快速取下心臟,切取包含心尖的1/3體積心臟,去掉右心室,保留左心室部分,稱質量。用組織裂解液裂解組織,獲取組織液,離心后取上清液,用BCA法測定蛋白濃度。以40 μg蛋白量計算每組的上樣體積,加入上樣緩沖液,煮沸變性,并按照Western Blot試劑盒說明書進行操作;封閉結束后,分別加入兔抗大鼠單克隆抗體Bax(稀釋比1∶5 000)、Bcl-2(稀釋比1∶4 000)4 ℃孵育過夜;次日洗膜以后加入二抗,室溫孵育以后加入顯影液,采用凝膠成像儀觀察。用Image J軟件分析條帶灰度值,以目的蛋白的條帶灰度值表示目的蛋白的表達水平,計算各組大鼠的Bax/Bcl-2比值。
1.3 統計學方法
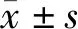
2 結 果
2.1 各組大鼠心率及平均動脈壓變化
時間、分組、時間與分組交互作用對大鼠心率無明顯影響(P>0.05),對大鼠平均動脈壓有明顯影響(F時間=101.41,F組間=10.23,F交互=6.93,P<0.05)。各組缺血前心率及平均動脈壓比較差異無顯著性(P>0.05)。除A組外,其余各組大鼠不同時間點平均動脈壓比較差異有顯著性(F=16.07~34.08,P<0.05),其中各組大鼠缺血15 min和再灌注2 h末與缺血前平均動脈壓相比均具有明顯下降(P<0.05),C組和E組再灌注2 h末平均動脈壓較缺血15 min時明顯上升(P<0.05)。再灌注2 h末,與B組相比,C、E組平均動脈壓均有明顯上升(F=13.62,P<0.05),而D組與B組比較差異無顯著性(P>0.05)。見表1。

表1 各組大鼠缺血前、缺血15 min及再灌注2 h末心率及平均動脈壓比較
2.2 各組大鼠心肌梗死質量占左心室質量比值
B~E組大鼠的心肌梗死質量占左心室質量比值為0.207±0.003、0.115±0.009、0.207±0.010、0.112±0.008,組間比較差異有顯著性(F=193.26,P<0.05),其中C、D組與B組及D組與E組大鼠心梗質量占左心室質量比值比較差異有顯著性(t=14.24~20.01,P<0.05)。
2.3 各組大鼠心肌組織Bax/Bcl-2比值比較
A~E組大鼠心肌組織Bax/Bcl-2比值分別為2.56±0.11、20.92±4.37、5.30±0.29、11.34±1.22、3.54±0.34,各組間比較差異均具有顯著意義(F=27.92,P<0.05),A、C組與B組以及C、E組與D組大鼠心肌組織Bax/Bcl-2比值比較差異有顯著意義(t=5.04~6.79,P<0.05)。
2.4 各組大鼠光鏡下心肌細胞形態比較
光鏡下觀察,A組大鼠心肌細胞排列整齊,無水腫(圖1A);B組大鼠心肌細胞嚴重水腫,心肌細胞周圍可見炎性細胞聚集,心肌纖維組織周圍紅細胞滲漏(圖1B);C組大鼠心肌細胞輕度水腫,心肌細胞周圍可見少量炎性細胞聚集,心肌細胞排列比較整齊(圖1C);D組大鼠心肌細胞水腫、核固縮嚴重,心肌細胞周圍可見大量炎性細胞積聚(圖1D);E組大鼠心肌細胞水腫程度較輕,心肌細胞排列略為紊亂,心肌細胞周圍炎性細胞聚集不明顯(圖1E)。

A~E分別為A~E組,HE染色法,400倍圖1 光鏡下各組大鼠心肌組織HE染色結果
3 討 論
心肌缺血治療的關鍵是盡快恢復缺血區域的血供,但是再灌注又會產生MIRI。迄今為止,溶栓療法仍然是目前治療急性心肌缺血的有效方法[7]。在心肌缺血期間,心肌組織氧供減少,缺氧嚴重[8],而低氧誘導因子(HIFs)是低氧適應性轉錄反應的主要調節因子[9],在心臟適應性反應中發揮著作用,降低心肌梗死的程度[6],抑制HIFs的降解,從而減輕MIRI[10-11]。遠程缺血預處理對疑似首次心肌梗死的患者具有心肌保護作用[12],而這一保護作用在敲除了HIF1α基因的小鼠中消失,證明HIF1α在遠程缺血預處理誘導的心臟保護中起著重要作用[13]。
HIF2α是一種由缺氧敏感的HIF2α亞單位與其專一性伴侶亞單位ARNT二聚體形成的異二聚體轉錄因子[14]。研究顯示,HIF2α是肝癌治療的首選靶點[15],且HIF2α阻滯劑對腎細胞癌早期模型有效[16]。但HIF2α對心肌細胞的影響研究報道較少,并且其與七氟烷在心肌細胞保護作用中的相關性也不是很清楚。KOEPPEN等[5]研究發現,激活HIF2α-AREG通路可抑制小鼠MIRI,改善缺血后數周小鼠的心臟功能,同時在缺血性心肌病患者中AREG表達增強。這些發現表明重組AREG可用于預防性治療心臟手術患者,以增強心肌缺血耐受。因此本研究擬通過建立大鼠MIRI模型來探討七氟烷對心肌缺血的保護作用是否與HIF2α-AREG通路有關,明確七氟烷對心肌保護作用的具體機制。
SPC可以發揮類似于缺血預處理或缺血后處理的心肌保護作用,這是應對圍手術期MIRI損傷的一種非常有效的手段[17-18]。本研究發現C組缺血15 min和再灌注2 h末平均動脈壓均高于B組,且C組心梗質量占左心室質量比值小于B組,表明C組心肌損傷輕于B組,也證實了七氟烷對心肌細胞具有保護作用。而在同樣使用了七氟烷的情況下,加入了HIF2α阻滯劑的D組心梗質量占左心室質量比值大于C組且Bax/Bcl-2比值上調,但是與B組相比差異無顯著性。Bax/Bcl-2比值上調表明細胞趨于凋亡狀態[19],表明經HIF2α阻滯劑預處理的心肌MIRI的大鼠,即使應用了對心肌組織具有保護作用的七氟烷,心肌梗死仍然加重。由此推斷臨床上使用了HIF2α阻滯劑治療其他疾病的心肌缺血患者,七氟烷對患者的心肌組織可能不能發揮保護作用。與D組相比較,E組心梗質量占左心室質量比值顯著減小,光鏡下心肌細胞的結構更完整且Bax/Bcl-2比值下調,表明E組心肌細胞損傷輕于D組。由此猜測對于正在使用HIF2α阻滯劑治療其他疾病且伴有心肌缺血的患者,雖然七氟烷的心肌保護作用被抵消,但仍然可以考慮應用重組AREG蛋白來減輕MIRI。
綜上所述,SPC能夠減輕大鼠MIRI,減輕心肌梗死面積,改善血流動力學;HIF2α抑制劑可以抵消七氟烷的心肌保護作用,使心肌損傷加劇。而重組AREG則可以改善心功能、增強對血流動力學的保護。但是本研究有一定的局限性,首先,本研究使用的是特定藥物阻滯劑而不是基因操作來阻斷HIF2α;第二,本研究僅采用動物實驗證明了SPC對心肌具有保護作用且該保護作用可以通過HIF2α-AREG通路來實現,沒有進行臨床研究。因此,有必要進一步的臨床試驗研究進行驗證。

