α-硫辛酸聯合甲鈷胺對糖尿病周圍神經病變患者骨鞘堿性蛋白表達及氧化應激狀態的影響
張伶君
(北京市垂楊柳醫院神經內科,北京 100022)
糖尿病周圍神經病變(DPN)是糖尿病的常見并發癥之一,發病機制較為復雜,目前多數學者認為其是代謝障礙、免疫機制、降糖藥物影響等多種因素共同作用的結果,仍需進一步研究[1]。 DPN 病程持續時間較長,對患者的身心健康和生活質量造成嚴重影響[2]。研究表明, 機體的氧化應激反應與DPN 的發病及病情進展密切相關[3]。 骨鞘堿性蛋白(MBP)是與神經髓鞘結構、 功能密切相關的重要營養因子, 研究證實,DPN 患者的血清MBP 水平明顯增高,這與髓鞘結構改變、神經血管病變等病理過程有關,因此可將MBP作為反映神經系統有無實質性損傷的特異性指標[4]。既往臨床針對DPN 的常規藥物治療雖能在一定程度上緩解患者癥狀,延緩病情進展,但治療效果仍欠理想;α-硫辛酸(ALA)屬于抗氧化劑,能夠有效改善機體的神經傳導速度, 目前已被廣泛應用于DPN 的臨床治療中[5]。 為進一步探明 ALA 治療 DPN 的效果,本研究選取2019 年3 月—2020 年3 月我院收治的200例DPN 患者為對象,探討ALA 聯合甲鈷胺對其MBP表達及氧化應激狀態的影響。 現報道如下。
1 資料與方法
1.1 一般資料
選取我院收治的200 例DPN 患者為研究對象,根據隨機數字表法分為對照組和觀察組,每組100例。對照組中男 54 例,女 46 例;平均年齡(51.6±4.3)歲;平均病程(6.4±2.3)年;1 型糖尿病 16 例,2 型糖尿病例 84 例。 觀察組中男 56 例, 女 44 例; 平均年齡(51.1±4.5)歲;平均病程(6.6±2.4)年;1 型糖尿病14例,2 型糖尿病例 86 例。 兩組患者的性別、年齡、病程、糖尿病類型等一般資料比較,差異無統計學意義(P>0.05),具有可比性。 本研究經我院倫理委員會批準,患者和家屬均自愿參加并簽署知情同意書。
納入標準:所有患者均符合糖尿病的相關診斷標準[6];心肌電圖檢查結果顯示正中神經、腓總神經的感覺傳導速度及正中神經、尺神經的運動傳導速度中至少存在兩項減慢。 排除標準: 妊娠期和哺乳期婦女;心、肝、腎功能嚴重損害者;存在自身免疫性疾病、中樞神經系統及外周神經系統疾病者;合并嚴重感染及糖尿病急性病癥者; 近期接受過抗氧化藥物或α-硫酸鋅治療者;不配合本研究治療方案者及存在語言溝通障礙者。
1.2 方法
兩組患者均接受常規治療,包括降糖、降壓調脂等藥物治療,及加強鍛煉、控制飲食等日常生活干預,囑患者注意休息,保證充足睡眠。
對照組采用甲鈷胺治療:給予患者甲鈷胺(揚子江藥業集團南京海陵藥業有限公司, 國藥準字H20058993, 規格:1 mL∶0.5 mg)0.5 mg+100 mL 生理鹽水靜脈滴注,1 次/d,持續治療1 個月,治療過程中應密切監測患者的血糖、血壓水平[7]。
觀察組在對照組基礎上采用ALA 治療: 給予患者硫辛酸注射液(江蘇神龍藥業有限公司,國藥準字H20059737, 規格:12 mL∶0.3 g)0.6 g+200 mL 生理鹽水靜脈滴注,1 次/d,持續治療1 個月。 治療過程中注意觀察患者是否存在不良反應。
1.3 觀察指標
(1)神經病變自覺癥狀評分(TSS)。分別于治療前和治療1 個月后,采用TSS 量表評估患者的臨床癥狀,該量表包括燒灼感、疼痛、麻木及感覺減退4 個項目,依據患者癥狀的發作頻率、嚴重程度及持續時間等進行評分,每項評分 0~3.66 分,總分0~14.64 分,得分越高提示患者神經病變癥狀越嚴重。癥狀評估均由經專業培訓的醫護人員進行,且治療前后評估人員相同。
(2)神經傳導速度。 分別于治療前和治療1 個月后,采用肌電圖儀[美國Medtronic 公司,全功能肌電誘發電位儀key-point,國食藥監械(進)字 2013 第3214136 號]測定患者的腓總神經、正中神經感覺神經傳導速度(SNCV)及運動神經傳導速度(MNCV)。
(3)骨鞘堿性蛋白(MBP)水平。 分別于治療前及治療1 個月后,抽取患者清晨空腹靜脈血,3 000 r/min離心 15 min 后取血清, 采用 ELISA 法測定 MBP 含量。 檢測用試劑盒購自上海北諾生物科技有限公司,均嚴格按照說明書要求進行實驗檢測操作。
(4)氧化應激反應指標水平。 分別于治療前及治療1 個月后, 抽取患者清晨空腹靜脈血,3 000 r/min離心15 min 后取血清, 采用黃嘌呤氧化酶法測定血清超氧化物歧化酶(SOD)活性;采用硫代巴比妥酸法測定血清丙二醛(MDA)含量;采用鄰苯三酚比色法測定血清過氧化氫酶(CAT)活性。所有檢測試驗操作均嚴格按照試劑盒說明書進行。
(5)不良反應。 治療過程中密切觀察患者病情變化,并記錄出現的不良反應。
1.4 統計方法
采用SPSS 19.0 統計學軟件進行數據分析。 計數資料用[n(%)]表示,進行 χ2檢驗;計量資料用()表示,進行t 檢驗。 P<0.05 為差異有統計學意義。
2 結 果
2.1 兩組患者自覺癥狀評分比較
治療前,兩組患者的燒灼感、疼痛、麻木、感覺減退評分及總癥狀評分比較, 差異無統計學意義 (P>0.05); 治療后, 兩組的各項評分均較治療前顯著降低,且觀察組評分均明顯低于對照組,差異有統計學意義(P<0.05)。 見表 1。
表1 兩組患者治療前后自覺癥狀評分比較[(),分]

表1 兩組患者治療前后自覺癥狀評分比較[(),分]
組別燒灼感治療前 治療后疼痛治療前 治療后對照組(n=100)觀察組(n=100)t 值P 值3.21±1.97 3.19±2.02 0.071 0.944 1.69±0.62*1.22±0.41*6.323 0.001 2.78±0.61 2.79±0.70 0.108 0.914 1.67±0.45*1.24±0.43*6.909 0.001

續表1
2.2 兩組患者神經傳導速度和骨鞘堿性蛋白水平比較
治療前,兩組患者的腓總神經、正中神經SNCV、MNCV 及 MBP 水平比較,差異無統計學意義(P>0.05);治療后,兩組的腓總神經、正中神經SNCV 及觀察組的腓總神經、正中神經MNCV 均較治療前顯著增高,兩組的MBP 水平均較治療前顯著降低,且觀察組腓總神經、正中神經 SNCV、MNCV 均快于對照組,MBP 水平低于對照組,差異有統計學意義(P<0.05)。 見表2。
表2 兩組患者治療前后神經傳導速度和骨鞘堿性蛋白水平比較比較()

表2 兩組患者治療前后神經傳導速度和骨鞘堿性蛋白水平比較比較()
組別腓總神經 MNCV(m/s)治療前 治療后正中神經MNCV(m/s)治療前 治療后對照組(n=100)觀察組(n=100)t 值P 值37.51±2.32 37.73±2.14 0.697 0.487 38.23±2.81 44.12±2.73*15.034 0.001 41.75±1.82 41.39±1.74 1.430 0.154 42.38±1.71 46.15±1.43*16.912 0.001

續表2
2.3 兩組患者氧化應激反應指標水平比較
兩組治療前的 SOD、MDA 及CAT 水平比較,差異無統計學意義(P>0.05);治療后,兩組的 MDA 水平均明顯降低,兩組的CAT 活性及觀察組的SOD 活性均顯著升高, 且觀察組MDA 水平低于對照組,SOD和CAT 活性均高于對照組, 差異有統計學意義(P<0.05)。 見表 3。
表3 兩組患者治療前后氧化應激反應指標水平比較()
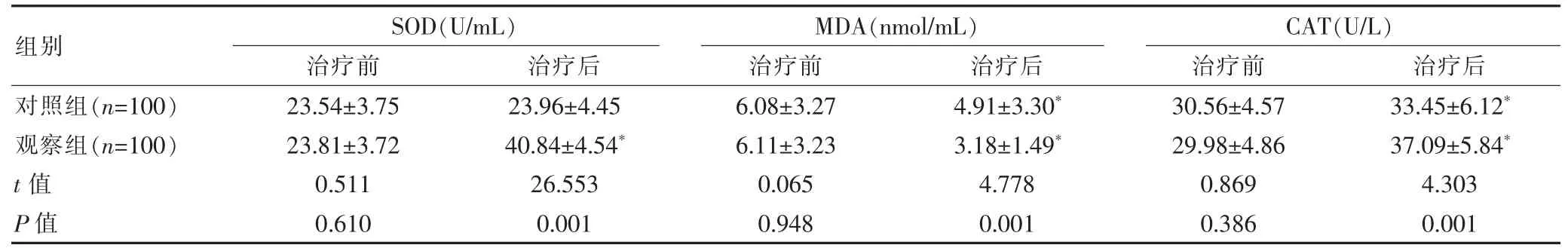
表3 兩組患者治療前后氧化應激反應指標水平比較()
注:與同組治療前比較,*P<0.05
組別SOD(U/mL)治療前 治療后MDA(nmol/mL)治療前 治療后對照組(n=100)觀察組(n=100)t 值P 值23.54±3.75 23.81±3.72 0.511 0.610 23.96±4.45 40.84±4.54*26.553 0.001 6.08±3.27 6.11±3.23 0.065 0.948 4.91±3.30*3.18±1.49*4.778 0.001 CAT(U/L)治療前 治療后30.56±4.57 29.98±4.86 0.869 0.386 33.45±6.12*37.09±5.84*4.303 0.001
2.4 兩組患者不良反應比較
治療過程中, 兩組患者均未出現嚴重不良反應,且無患者退出。
3 討 論
DPN 是糖尿病患者常見的并發癥, 目前多數學者認為其發病機制為氧化應激[8]。機體血糖升高,線粒體活性氧自由基及過氧化物生成過多,體內脂質過氧化,使Na+-K+-ATP 酶活性受到抑制,影響神經電生理過程,造成神經傳導速度減慢[9]。 而機體體內氧化-抗氧化機制失衡、活性氧自由基積聚又使得MDA 水平進一步增高。 SOD 和CAT 在機體抗氧化方面具有重要作用, 能夠有效清除機體氧自由基和過氧化物,減輕神經組織的微血管損傷。 既往臨床上常采用降糖、降脂、營養神經、改善微循環等措施治療DPN,取得了一定的效果[10-12]。
ALA 屬于活性較強的抗氧化劑, 可在體內轉化為二氫硫辛酸而發揮活性,能夠有效清除體內過氧化物、氧自由基,抑制脂質過氧化,同時還具有促進其他抗氧化劑再生、螯合金屬離子的作用。 大量的動物及人體實驗表明,ALA 能夠改善神經細胞Na+-K+-ATP酶活性和感覺神經的傳導特性, 抑制機體氧化應激,減輕神經組織病變,抑制神經細胞凋亡[13]。
本研究結果顯示,經不同方案治療后,觀察組的灼感、疼痛、麻木、感覺減退各項自覺癥狀評分及總癥狀評分均明顯低于對照組(P<0.05),提示 ALA 聯合甲鈷胺治療糖尿病周圍神經病變的效果顯著,優于僅使用甲鈷胺治療, 可明顯改善患者癥狀。 分析認為,ALA 在體內具有良好的生物活性, 能夠清除機體過多的過氧化物和氧自由基, 從而發揮抗氧化作用,抑制機體氧化應激造成的損傷。 而通過檢測患者治療后的氧化應激指標水平發現,觀察組的MDA 水平低于對照組,SOD 和 CAT 活性均高于對照組(P<0.05),與上述分析結果及糖尿病周圍神經病變的發病機制吻合。此外,ALA 的不良反應極少,治療過程中患者未出現嚴重不良反應,提示聯合治療方案的安全性良好。
MBP 是神經髓鞘的重要營養蛋白, 在髓鞘的形成及維持髓鞘結構、功能穩定過程中發揮重要作用[14]。當機體神經系統受到損傷時, 血腦屏障遭到破壞,血管通透性發生變化,血清中的MBP 水平明顯增高。國內外學者的報道指出,MBP 水平可作為判斷感覺神經受損范圍和程度的重要指標[15-16]。本研究結果顯示,治療后,觀察組的腓總神經、正中神經SNCV、MNCV均快于對照組,MBP 水平低于對照組(P<0.05),說明ALA 聯合甲鈷胺治療能夠有效增強糖尿病周圍神經病變患者的神經傳導速度,同時降低患者血清MBP水平,延緩病情進展,改善微血管循環,促進患者康復。
綜上所述,ALA 聯合甲鈷胺治療糖尿病周圍神經病變的效果顯著,能明顯改善患者的臨床癥狀和氧化應激狀態,提高神經傳導速度,降低骨鞘堿性蛋白水平,值得臨床推廣應用。

