轉基因大穗小麥與受體小麥差異基因的初步研究
李 靜 李艷紅 陸雪瑩 張志強 吳思雅
(1.新疆輕工職業技術學院食品與生物技術分院 新疆烏魯木齊 830021;2.新疆師范大學生命科學學院 新疆烏魯木齊830054;3.中國科學院新疆理化技術研究所干旱區植物資源化學重點實驗室 新疆烏魯木齊 830011)
優良品種是現代農業生產的重要基礎,小麥(Triticum aestivum L)作為世界上第一大糧食作物,是人類最主要的食物來源。轉基因大穗小麥是本實驗室采用花粉管通道法將大賴草總DNA導入受體春麥761后獲得的轉基因小麥新株系,其具有大穗、多粒、大粒、高蛋白、抗黃萎病等優良變異[1]。繆軍、王子霞等對大賴草、轉基因大穗小麥及春麥761進行了RFLP、RAPD及SSR等一系列分析工作,從分子的角度證實了轉基因大穗小麥中確實引入了供體大賴草的基因[2-3]。由于轉基因大穗小麥是通過導入大賴草總DNA獲得的,其在獲得優良變異性狀的同時,也引入了生長期延長、冬性化、分蘗數增加、株型分散等不利變異。為了去除不利變異基因,進一步獲取優良性狀基因片段,本文對轉基因大穗小麥中導入的外源性DNA片段進行化學發光生物素探針標記Southern雜交檢測分析,以期為后續小麥的遺傳育種提供參考。
1 材料與方法
1.1 實驗材料
轉基因大穗小麥和春麥761幼苗葉片(將其同條件種植后幼苗長至5 cm~8 cm時,剪取幼嫩葉片作為實驗材料);大賴草基因組總DNA為本實驗室保存。
1.2 實驗方法
1.2.1 基因組DNA的提取純化
(1)提取。將植物幼嫩葉片樣品分別加液氮依次磨碎,分別用CTAB法[4]抽提,經兩次離心后,使用無水乙醇洗滌,真空抽干,在得到的DNA中加入2 mLl0 mmol/L的Tris·HCl(pH=8.0)充分溶解,于4 ℃保存。
(2)純化。第一次純化:向DNA溶液中加入RNA酶(RNase)(10 mg/mL),37 ℃保溫30 min,加蛋白酶K使終濃度為100 μg/mL,37 ℃保溫1 h,苯酚抽提兩次,氯仿抽提一次;上清液分別過Sepharose 2B柱(柱長22 cm,直徑2.4 cm),洗脫液為0.2 M NaCl、10 mmol/L Tris·HCl(pH=8.0),洗脫速度3 滴/min~4 滴/min,走紙6 cm/min,靈敏度2A;收集第一峰,乙醇沉淀,-20 ℃放置4 h以上,離心,真空抽干,10 mmol/L Tris·HCl溶解沉淀。第二次純化:由于第一次過柱后,RNA峰和DNA峰分界不明顯,認為仍然混有RNA,故又加入RNase,再過柱。
1.2.2 基因組總DNA電泳檢測及紫外分光光度法定量測定
將提取的兩種樣品總DNA于1.2%Agarose、40 V電泳2 h[5],紫外燈下看條帶是否清晰。分別取30 μL兩種樣品總DNA稀釋至3 mL,蒸餾水對照,紫外分光光度計分別測OD260和OD280值。
1.2.3 化學發光生物素標記Southern雜交檢測
(1)植物材料基因組總DNA的限制性雙酶切。
取滅菌0.5 mL離心管,按照表1中所列配制反應液進行酶切反應,總體積為30 μL。37 ℃水浴鍋中保育5 h,同時對作為對照的λDNA進行37 ℃保育2 h,BamHⅠ和HindⅢ雙酶切。

表1 不同植物材料基因組總DNA限制性雙酶切反應液配制量表
(2)酶切DNA的電泳分離及硝酸纖維素膜轉印。
酶切DNA的電泳分離:酶切后的DNA樣品與Marker一起進行1.2%瓊脂糖凝膠電泳,紫外燈下觀察結果。
酶切片段的原位變性及硝酸纖維素膜轉印:變性,將凝膠上的雙鏈DNA片段經過原位變性處理,使之成為單鏈;凝膠上的單鏈DNA片段經毛細管的虹吸作用,轉移到硝酸纖維膜上,硝酸纖維膜真空80 ℃烘烤處理2 h固定,室溫保存。
(3)生物素標記探針的制備。
對大賴草基因組DNA進行BamHⅠ和HindⅢ的限制性雙酶切后,-20 ℃保存。探針的制備方法按照碧云天生物公司的《生物素隨機引物DNA標記試劑盒操作說明書》,生物素標記好的DNA探針于-20 ℃保存。
(4)印跡雜交并放射自顯影。
轉印完畢且固定好的硝酸纖維素膜與制備好的生物素標記大賴草DNA探針進行雜交,清洗干凈的雜交膜進行化學發光自顯影檢測,雜交檢測生物素標記核酸探針的方法參照碧云天生物公司的《化學發光法生物素標記核酸檢測試劑盒操作說明書》進行。
2 結果與分析
2.1 總DNA純化結果與分析
提取植物材料總DNA的目的是要進行后續實驗,做限制性雙酶切、Southern雜交等,要求DNA純度較高,將雜蛋白、多糖、RNA有效去除。殘余的雜蛋白和多糖通過酚-氯仿進行多次抽提,然后用乙醚除去酚,之后再加入蛋白酶K來去除。而RNA的去除,起初認為過柱可以順利將其除去,但過柱后,如圖1所示,RNA峰和DNA峰分界不明顯,認為溶液中仍然混有RNA,故又加入RNase,再次過柱后,如圖2所示,RNA去除得較干凈。
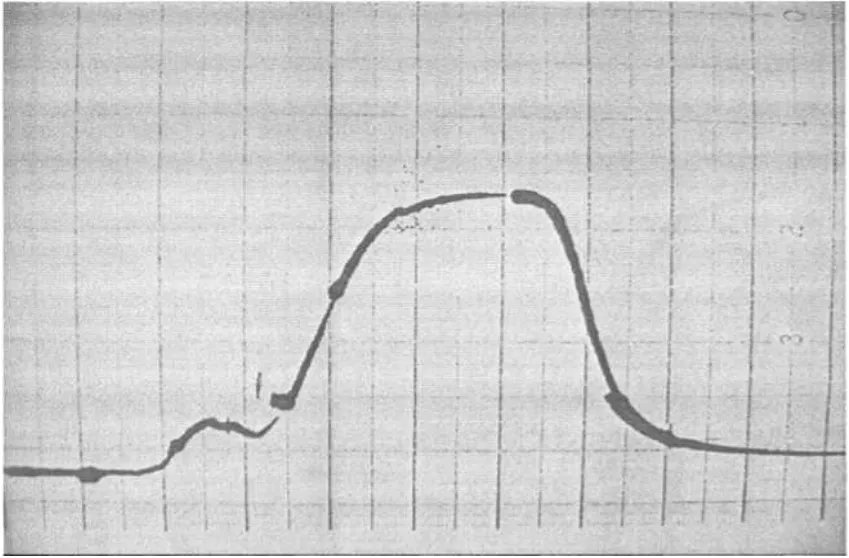
圖1 總DNA Sepharose2B柱層析洗脫曲線圖

圖2 RNA酶解后總DNA Sepharose2B柱層析洗脫曲線圖
2.2 總DNA電泳檢測及紫外分光光度法定量測定結果與分析
總DNA電泳圖(如圖3)和紫外分光光度計定量測定結果(如表2)顯示,利用CTAB法提取再過柱純化得到的植物材料基因組總DNA的純度較高,濃度達到了預期的值,滿足限制性雙酶切及Southern雜交等后續實驗要求。

圖3 總DNA電泳圖

表2 總DNA的OD260和OD280值
2.3 總DNA的限制性雙酶切結果與分析
對轉基因大穗小麥和春麥761進行BamHⅠ和HindⅢ雙酶切,將酶切的總DNA進行1.2%瓊脂糖凝膠電泳,電泳的目的是將酶切后得到的不同長度的片段在凝膠上依次分開,然后把凝膠上分開的DNA片段原位轉移到硝酸纖維素膜上。實驗對高純度的植物材料基因組總DNA和作為對照的λDNA進行BamHⅠ和HindⅢ雙酶切后,電泳結果如圖4所示,得到了長度合適的在凝膠上依次分開的DNA片段,為后續成功地將雙酶切的DNA片段轉移到硝酸纖維素膜上打下良好的基礎。
對轉基因大穗小麥和春麥761進行BamHⅠ和HindⅢ雙酶切,將酶切的總DNA進行1.2%瓊脂糖凝膠電泳,電泳的目的是將酶切后得到的不同長度的片段在凝膠上依次分開,然后把凝膠上分開的DNA片段原位轉移到硝酸纖維素膜上。實驗對高純度的植物材料基因組總DNA和作為對照的λDNA進行BamHⅠ和HindⅢ雙酶切后,電泳結果如圖4所示,得到了長度合適的在凝膠上依次分開的DNA片段,為后續成功地將雙酶切的DNA片段轉移到硝酸纖維素膜上打下良好的基礎。

圖4 總DNA雙酶切電泳圖
2.4 化學發光生物素標記Southern雜交檢測結果與分析
化學發光Southern雜交檢測自顯影后的X光膠片如圖5所示,由圖可知,雜交條帶位于第四條泳道上,即轉基因大穗小麥所在的泳道上,且只有唯一一條,而春麥761泳道上沒有,經過和轉膜前瓊脂糖凝膠上的條帶位置及Marker比對,條帶大小約在750 bp~1 000 bp。

圖5 Southern雜交化學發光自顯影圖
3 討論與結論
20世紀90年代,花粉管通道法被廣泛應用于轉基因小麥的研究中[6]。本實驗室采用與小麥同亞族的且具有多種小麥不具有的優良性狀的大賴草總DNA對春麥761進行轉化,獲得了一系列的轉基因新品系。分析研究轉基因大穗小麥中大穗相關的功能基因對小麥品質育種具有重要意義[7]。本研究利用化學發光生物素標記大賴草總DNA探針對轉基因大穗小麥和受體春麥761基因組DNA進行了Southern印跡雜交,產生了轉基因大穗小麥和大賴草共有的而春麥761中沒有的特異性DNA條帶,實驗結果顯示該DNA片段長度約在750 bp~1 000 bp,推測它是大賴草總DNA導入受體春麥761之后在轉基因大穗小麥中留下的DNA片段,即此片段來自大賴草基因組,為后續獲取并研究該特異性外源DNA片段奠定了基礎。

