選擇性雌激素受體調節劑對高糖血癥大鼠胰腺組織氧化損傷等的影響
張昊旻 喬炳龍 李超 齊衛紅 盧彩霞 孫平
(1 青島大學附屬醫院產科,山東 青島 266003; 2 諸城市婦幼保健院產科;3 青島大學附屬醫院放射科; 4 青島市第三人民醫院產科)
妊娠期糖尿病(GDM)為妊娠期常見的代謝紊亂性疾病,嚴重威脅孕婦及胎兒身體健康[1]。GDM患者不僅子癇前期的風險增加,而且在以后的生活中患2型糖尿病和心血管疾病的風險也會增高[2-4],其后代在青春期和成年早期更容易發生糖耐量受損及心血管系統疾病[5]。全世界GDM發病率呈逐年上升趨勢,受到越來越多國內外學者關注。國際糖尿病聯合協會(IDF)2019年的統計結果顯示,全球范圍內約1/6新生兒受到孕期高糖血癥的影響[6]。然而,由于妊娠期的特殊性,孕婦除了控制飲食和適量運動的生活方式干預,以及偶爾的胰島素治療之外,GDM沒有更為有效的治療和預防策略[7-8]。
GDM臨床過程復雜,其具體發病機制至今尚未十分明確。研究表明,多種因素可引起GDM的發生,如胰島素抵抗、胰島β細胞功能缺陷及妊娠期激素分泌異常等[9]。雌激素是女性體內最重要的類固醇激素之一,在調節機體代謝中發揮著重要作用,其中雌二醇(E2)是妊娠期胎盤合成和分泌的主要激素之一,在女性血糖代謝中具有重要功能[10]。雌激素需要與ER結合后激活經典的信號傳導途徑,發揮多種雌激素效應。ER包括ERα和ERβ兩種亞型,其中ERα參與介導多數雌激素效應,特別是雌激素對血糖代謝的調節[11],ERα基因的異常表達可能參與GDM的發生發展[12]。此外,ERα基因敲除的小鼠可有葡萄糖耐量的改變,表明ERα在胰島素調控葡萄糖穩態中發揮重要作用[13],但具體的作用機制尚不明確。糖類代謝紊亂造成血糖濃度長期偏高,引起高糖血癥,持續或波動性高糖環境導致線粒體產生大量活性氧,造成細胞氧化應激損傷和細胞死亡[14]。鐵死亡是近年新發現的一種調節性細胞死亡方式,常伴隨細胞鐵含量和活性氧的積累,被證明與多種疾病的發生發展有關,而鐵死亡在高糖血癥發生過程中的作用尚不明確。本研究旨在通過構建鏈脲佐菌素(STZ)誘導的高糖血癥大鼠模型,探討選擇性ER調節劑對高糖血癥大鼠胰腺組織氧化損傷等的影響。
1 材料與方法
1.1 材料
1.1.1實驗動物 清潔級雌性SD大鼠24只,雄性SD大鼠12只,體質量180~220 g,購自湖北省疾病預防控制中心。在室溫23~25 ℃、相對濕度65%~70%、12-12 h循環光照環境中飼養。動物實驗符合青島大學附屬醫院動物倫理委員會制定的標準,并通過我院委員會批準。
1.1.2試劑及設備 過氧化氫酶(CAT)、谷胱甘肽過氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)活性測定試劑盒(南京建成生物工程研究所),STZ(美國Sigma公司),ELISA試劑盒(武漢依萊瑞特生物科技股份有限公司),兔抗-長鏈脂酰CoA合成酶4(ACSL4)、ERα、谷胱甘肽過氧化物酶4(GPX4)抗體均購買自中國Abclonal公司,兔抗-鐵蛋白重鏈1(FTH1)抗體購買自美國Affinity公司,兔抗-GAPDH抗體(杭州賢至生物科技有限公司),ECL化學發光試劑盒(北京普利萊基因技術有限公司),逆轉錄試劑盒(日本TaKaRa公司),自動生化分析儀(日本Hitachi公司),ABI PRISM 7900 PCR儀(Applied美國Biosystems公司)。
1.2 方法
1.2.1動物分組及干預 大鼠經標準飲食適應性飼養1周后,按照雌雄2∶1比例合籠過夜,次日清晨將其分開,雌性大鼠陰道分泌物中鏡檢觀測到精子者確定為孕鼠,記做妊娠D0。隨機選取6只孕鼠為正常對照組(A組),常規標準飼養。對剩余孕鼠腹腔注射STZ溶液(45 mg/kg),24 h后空腹尾部采血檢測血糖濃度,以血糖濃度>11.1 mmol/L為高糖血癥大鼠模型制備成功。取18只模型制備成功的大鼠隨機分為高糖血癥模型組(B組)、他莫昔芬(TAM)低劑量組(C組)及TAM高劑量組(D組),每組6只。B組大鼠不做任何處理,標準飼養,C、D組大鼠每天分別腹腔注射2.5、5.0 mg/kg的TAM進行藥物干預處理,14 d后斷頸處死所有大鼠,取大鼠胰腺組織樣本進行后續實驗。
1.2.2實時熒光定量PCR方法(RT-qPCR)檢測胰腺組織中ERα等基因表達水平 將胰腺組織于液氮中研磨后,Trizol法提取總RNA,測定RNA的濃度后,逆轉錄合成cDNA。使用SYBR?Green Real-time PCR-Msater Mix(Toyobo,日本)進行RT-qPCR反應,反應條件:95 ℃預變性10 min;然后95 ℃變性15 s,60 ℃退火延伸60 s,共進行40個循環,以GADPH作為內參照,引物名稱及其序列見表1。采用2-ΔΔCT方法計算胰腺組織中ERα、ACSL4、GPX4及FTH1 mRNA相對表達量。實驗重復3次,取均值。

表1 引物名稱及其序列
1.2.3Western Blot方法檢測胰腺組織中ERα、ACSL4、GPX4和FTH1蛋白的表達水平 將胰腺組織置于含有蛋白酶抑制劑PMSF的裂解緩沖液中裂解,于4 ℃下以13 000 r/min離心15 min,使用BCA蛋白試劑盒檢測上清液中的蛋白濃度。取20 μg蛋白樣品,使用120 g/L的SDS-PAGE電泳分離后轉移至PVDF膜上,于50 g/L脫脂乳中常溫封閉2 h,加入特異性一抗4 ℃孵育過夜。一抗分別為兔抗-ERα抗體(1∶1 000)、兔抗-ACSL4抗體(1∶1 000)、兔抗-GPX4抗體(1∶1 000)、兔抗-FTH1抗體(1∶1 000)及兔抗-GAPDH抗體(1∶1 000)。洗脫游離一抗后,將膜與HRP標記的二抗在常溫下孵育2 h,利用ECL化學發光試劑盒曝光顯影后,通過Image J軟件分析蛋白條帶的灰度值。
1.2.4大鼠胰腺組織生化分析 采用組織生化分析試劑盒檢測大鼠胰腺組織中過氧化氫(H2O2)、丙二醛(MDA)、谷胱甘肽(GSH)的含量以及SOD、CAT、GSH-PX的活性水平;采用比色法檢測胰腺組織中的鐵含量。所有操作均嚴格按照試劑盒說明書進行。
1.2.5蘇木精-伊紅染色觀察大鼠胰腺組織形態將胰腺組織采用體積分數為0.04的多聚甲醛固定24 h后,梯度乙醇脫水至透明,包埋于石蠟中并切成大小約1 cm3的小塊,行5 μm厚切片,60 ℃烤片后,用蘇木精和伊紅染色,在生物光學顯微鏡下觀察胰腺組織形態。
1.2.6透射電子顯微鏡觀察胰島細胞形態 將浸泡在體積分數為0.025的戊二醛固定液(4 ℃,pH為7.8)中的胰島組織樣本,4 ℃下用0.1 mol/L磷酸鹽緩沖液(pH 7.4)充分清洗3次,每次15 min;然后用0.1 mol/L鋨酸室溫(20 ℃)固定2 h,4 ℃下用0.1 mol/L磷酸鹽緩沖液(pH 7.4)再度清洗3次;接著用體積分數為0.3~1.0的乙醇梯度脫水,丙酮置換后,環氧樹脂浸透包埋。包埋塊行30 nm厚超薄切片,并載于200目銅網上,經醋酸鈾和枸櫞酸鉛電子染色,采用FEI Tecnai G20 TWIN 型透射電鏡(TEM)觀察并拍照,加速電壓為80 kV。
1.3 統計學分析
2 結 果
2.1 各組大鼠胰腺組織中ERα mRNA和蛋白表達水平比較
RT-qPCR和Western Blot檢測結果顯示,A~D組大鼠胰腺組織中ERα mRNA的表達水平分別為1.01±0.17、3.67±0.31、2.71±0.36、1.93±0.30,ERα蛋白表達水平分別為0.05±0.01、0.31±0.07、0.16±0.05、0.07±0.02,4組大鼠胰腺組織ERα mRNA和蛋白表達水平比較差異具有顯著性(F=44.86、23.29,P<0.05),其中B組大鼠胰腺組織中ERα mRNA和蛋白表達水平與A組比較顯著升高(t=13.14、6.81,P<0.05);C、D組的ERα mRNA和蛋白表達水平與B組比較顯著降低(t=3.18~7.10,P<0.05)。
2.2 各組大鼠胰腺組織中氧化應激指標水平及鐵含量比較
生化檢測結果顯示,4組大鼠胰腺組織中氧化應激指標水平及鐵含量比較差異具有顯著性(F=50.82~204.01,P<0.05),其中B組大鼠胰腺組織中CAT、SOD、GSH-PX等的活性以及GSH含量與A組比較顯著降低(t=11.83~14.45,P<0.05),而H2O2、MDA及鐵含量與A組比較顯著升高(t=12.50~15.77,P<0.05);C、D組CAT、SOD、GSH-PX等的活性以及GSH含量與B組比較顯著升高(t=4.36~20.29,P<0.05),而H2O2、MDA水平以及鐵含量明顯降低,差異均具有統計學意義(t=5.22~11.62,P<0.05)。見表2。
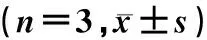
表2 各組大鼠胰腺組織中氧化應激指標水平及鐵含量比較
2.3 大鼠胰腺組織中鐵死亡通路相關基因和蛋白的表達水平比較
RT-qPCR和Western Blot檢測結果顯示,4組大鼠胰腺組織中鐵死亡通路相關基因和蛋白表達水平比較差異具有顯著意義(F=31.06~84.37,P<0.05),其中B組大鼠胰腺組織中GPX4、FTH1 mRNA以及蛋白表達水平與A組比較顯著降低,而ACSL4 mRNA和蛋白表達水平與A組比較顯著升高(t=7.30~13.55,P<0.05);C、D組與B組比較,GPX4、FTH1 mRNA和蛋白表達水平顯著升高,而ACSL4 mRNA和蛋白表達水平則顯著降低(t=2.13~8.58,P<0.05)。見表3。
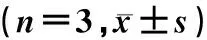
表3 鐵死亡通路相關基因和蛋白的表達水平比較
2.4 大鼠胰腺組織形態學變化情況
胰腺組織HE染色結果顯示,與A組相比,B組大鼠的胰島形態不規則,胰島與外分泌腺界限模糊,胰島細胞胞漿數量減少,部分胰島細胞胞漿空泡變性;而C、D組大鼠與B組相比,胰島形態趨于規則,少見胞漿空泡的胰島細胞,胰島與外分泌腺界限清晰,胰島細胞胞漿數量與對照組沒有明顯差異,D組大鼠胰島損傷的程度明顯輕于C組(圖1)。
2.5 大鼠胰島細胞超微結構變化
透射電鏡觀察胰島細胞超微結構結果顯示,A組大鼠胰島細胞胞漿內分布著大量電子致密的分泌顆粒,呈圓形,大小200~500 nm,外包界膜,界膜與芯之間的間隙較大,芯有不同程度的電子密度,細胞核大呈圓形,染色質均勻分布,線粒體可見明顯的嵴結構(圖2A);B組大鼠胰島細胞受損變形,胞漿中分泌顆粒數量及電子沉積密度明顯下降,部分分泌顆粒界膜消失,線粒體腫脹變形,嵴結構消失呈空泡化(圖2B);C、D組大鼠胰島細胞胞漿中分泌顆粒數量相對于B組大鼠明顯增加,線粒體可見明顯嵴結構(圖2C、D)。

上排放大倍數100倍,右下角bar代表50 μm;下排為上排黑色框區域的局部放大(200倍),右下角bar值代表100 μm;黑色箭頭所指為胰島

A~D分別代表A~D組,圖中n為細胞核,mt為線粒體,sg為分泌顆粒
3 討 論
GDM嚴重危害母嬰健康,全球范圍內約1/6新生兒受到孕期高血糖的影響[6],其臨床過程復雜,發病機制至今尚不十分明確。研究發現胎盤組織中ERα基因表達水平與GDM的發生發展相關[12],然而其具體機制未知。研究證實,ERα可以調節葡萄糖轉運蛋白4(GLUT4)的表達,ERα的異常表達會影響GLUT4的表達及功能,這可能影響胰島素的信號傳導和葡萄糖攝取,導致妊娠期胰島素抵抗,進而發展為GDM[15]。
本研究通過對STZ誘導的高糖血癥大鼠模型進行研究發現,B組大鼠胰腺組織中ERα mRNA和蛋白表達水平與A組相比顯著升高。選擇性ER調節劑TAM腹腔注射高糖血癥大鼠,能夠明顯降低ERα mRNA和蛋白表達水平。TAM作為選擇性ER調節劑,能夠有效地阻斷雌激素與ER的結合,使得雌激素不能發揮應有的作用。大量證據表明,機體內雌激素水平的變化同時也伴隨著鐵儲量的變化[16-17]。過度的鐵負荷會影響機體的氧化應激水平,與高血糖之間存在密切聯系[18-20]。本研究中,B組大鼠胰腺組織中鐵含量明顯高于A組,但是在ERα表達抑制的C、D組中,鐵含量明顯低于B組。對細胞氧化應激指標分析顯示,B組大鼠的胰腺組織中CAT、SOD、GSH-PX等抗氧化酶的活性以及GSH含量顯著低于A組,而H2O2、MDA水平顯著高于A組。這種抗氧化劑的減少和氧化應激產物的增加會導致ROS的過量產生,從而直接損害β細胞[21]。對胰腺組織的HE染色結果顯示,B組大鼠胰腺組織出現明顯的病理損傷,這可能是ROS的過量積累導致的。隨著ERα水平降低,大鼠胰腺組織中抗氧化酶活性以及GSH含量明顯升高,H2O2、MDA的水平明顯降低,且高糖血癥引起的胰腺組織病理損傷也得到明顯緩解。以上這些結果表明,ERα表達水平的下降,降低了組織鐵水平及氧化應激損傷,緩解了高糖血癥引起的胰腺組織病理損傷。
鐵離子的大量積累和脂質過氧化的爆發,提示細胞鐵死亡。鐵死亡是近年新發現的一種細胞死亡方式,細胞形態上表現為線粒體皺縮,線粒體嵴減少或消失。鐵死亡被證實與多種疾病相關,已有研究表明,可以通過激活或抑制鐵死亡來干預疾病的發展[22-23]。本研究通過透射電子顯微鏡觀察胰島細胞超微結構,結果顯示,B組大鼠胰島細胞中呈現明顯的鐵死亡特征,線粒體相比于A組明顯皺縮,線粒體嵴消失。鐵死亡通路中關鍵基因的mRNA和蛋白表達水平檢測結果顯示,B組大鼠胰腺組織中GPX4、FTH1 mRNA和蛋白表達水平相對于A組顯著降低,而ACSL4 mRNA和蛋白表達水平相對于A組顯著升高。GPX4活性被抑制,導致膜脂上活性氧自由基的積累,而FTH1的活性被抑制導致鐵離子儲存調控被破壞,使得細胞內的鐵含量升高[24-25],ACSL4的活性升高,使得易被氧化的膜磷脂的合成增加,引發鐵死亡。而通過抑制ERα的表達水平,C、D組大鼠胰島細胞內可見正常線粒體,出現完整的線粒體嵴。同時基因GPX4和FTH1 mRNA和蛋白表達水平相對于B組大鼠明顯升高,而ACSL4 mRNA和蛋白表達水平相對于B組大鼠明顯降低,呈現出鐵死亡抑制狀態。這些結果表明,高糖血癥大鼠出現明顯鐵死亡,而ERα mRNA和蛋白表達水平的抑制可以顯著降低細胞鐵死亡,推測ERα的表達水平影響雌激素的作用進而影響機體鐵水平和氧化應激水平。
總之,本研究結果顯示,選擇性ER調節劑可能通過ER介導抑制胰腺組織氧化應激水平,降低細胞鐵死亡,進而緩解高糖血癥所致大鼠胰腺的病理損傷。后期還需要更多的臨床試驗和體外研究來分析ERα水平在高糖血癥病程中所發揮的作用,并對其作為潛在藥物靶點用以治療妊娠期高糖血癥的可行性進行分析。

