基于化學(xué)學(xué)科核心素養(yǎng)的教學(xué)設(shè)計(jì)
胡春艷
一、教學(xué)設(shè)計(jì)背景
《普通高中化學(xué)課程標(biāo)準(zhǔn)(2017年版)》要求“認(rèn)識(shí)酸、堿、鹽等電解質(zhì)在水溶液中或熔融狀態(tài)下能發(fā)生電離。通過(guò)實(shí)驗(yàn)事實(shí)認(rèn)識(shí)離子反應(yīng)及其發(fā)生的條件,了解常見(jiàn)離子的檢驗(yàn)方法。”離子反應(yīng)就是這一課程要求的體現(xiàn),編排在人民教育出版社普通高中教科書(shū)《化學(xué)(必修 第一冊(cè))》第一章第二節(jié),位于“物質(zhì)的分類(lèi)和轉(zhuǎn)化”的后一節(jié)內(nèi)容,是認(rèn)識(shí)化學(xué)物質(zhì)的一個(gè)重要途徑。
離子反應(yīng)是高中化學(xué)課程中的核心概念,是微粒觀、變化觀形成的重要載體,是學(xué)習(xí)鹽類(lèi)的水解平衡、沉淀溶解平衡以及電化學(xué)等知識(shí)的基礎(chǔ),在中學(xué)化學(xué)理論知識(shí)中占有非常重要的地位。學(xué)生在初中學(xué)習(xí)了復(fù)分解反應(yīng)及其規(guī)律,本節(jié)教材第一課時(shí)又學(xué)習(xí)了酸、堿、鹽在水溶液中的電離,對(duì)于溶液?jiǎn)栴}的討論,學(xué)生能夠從初中僅關(guān)注溶質(zhì)、溶液這些宏觀的具體物質(zhì),初步過(guò)渡到關(guān)注微觀粒子,本節(jié)課將繼續(xù)探討微粒間的相互作用。離子反應(yīng)的核心功能在于幫助學(xué)生形成從微觀角度認(rèn)識(shí)物質(zhì)在水溶液中的行為,教師在教學(xué)過(guò)程中以離子反應(yīng)的概念、離子反應(yīng)發(fā)生的條件、離子反應(yīng)方程式的書(shū)寫(xiě)等具體技能落實(shí)教學(xué)目標(biāo),但是學(xué)生在學(xué)習(xí)過(guò)程中,如果僅從宏觀角度分析,缺乏從微觀角度分析問(wèn)題的意識(shí),就會(huì)缺少分析問(wèn)題的思路和方法。
所以,教師在教學(xué)中如何落實(shí)知識(shí)的同時(shí)滲透學(xué)科方法及學(xué)科核心素養(yǎng)是當(dāng)今教學(xué)面臨的一大挑戰(zhàn),是教師需要深入思考的問(wèn)題。以下是我對(duì)本節(jié)課教學(xué)設(shè)計(jì)的一點(diǎn)思考。
二、基于化學(xué)學(xué)科核心素養(yǎng)的教學(xué)設(shè)計(jì)
學(xué)科核心素養(yǎng)是學(xué)科育人價(jià)值的集中體現(xiàn),是學(xué)生通過(guò)學(xué)科學(xué)習(xí)而逐步形成的正確價(jià)值觀念、必備品格和關(guān)鍵能力。高中化學(xué)學(xué)科核心素養(yǎng)是高中學(xué)生發(fā)展核心素養(yǎng)的重要組成部分,是學(xué)生綜合素質(zhì)的具體體現(xiàn),反映了社會(huì)主義核心價(jià)值觀下化學(xué)學(xué)科育人的基本要求,全面發(fā)展了化學(xué)課程學(xué)習(xí)對(duì)學(xué)生未來(lái)發(fā)展的重要價(jià)值。
化學(xué)學(xué)科核心素養(yǎng)將化學(xué)知識(shí)與技能的學(xué)習(xí)、化學(xué)思想觀念的建構(gòu)、科學(xué)探究與問(wèn)題解決能力的發(fā)展、創(chuàng)新意識(shí)和社會(huì)責(zé)任感的形成等多方面的要求融為一體,體現(xiàn)了化學(xué)課程在幫助學(xué)生形成未來(lái)發(fā)展需要的正確價(jià)值觀念、必備品格和關(guān)鍵能力中發(fā)揮的重要作用。高中化學(xué)課程應(yīng)體現(xiàn)化學(xué)學(xué)科核心素養(yǎng),幫助學(xué)生自主構(gòu)建化學(xué)基礎(chǔ)知識(shí)和基本技能;幫助學(xué)生體驗(yàn)科學(xué)探究的過(guò)程,學(xué)習(xí)科學(xué)研究的基本方法,增強(qiáng)創(chuàng)新精神和實(shí)踐能力。因此,我將本節(jié)課設(shè)計(jì)為以下幾個(gè)環(huán)節(jié):
環(huán)節(jié)一:創(chuàng)設(shè)問(wèn)題情境
【教師】視頻播放。
《三國(guó)演義》中有這樣一個(gè)故事:諸葛亮率領(lǐng)的漢軍誤飲了“啞泉”。啞泉,“人若飲之,則不能言,不過(guò)旬日必死”。后來(lái),漢軍將士經(jīng)地方隱士指點(diǎn),飲了萬(wàn)安溪的“安樂(lè)泉”水方才轉(zhuǎn)危為安。
【提出問(wèn)題】萬(wàn)安溪安樂(lè)泉水又是什么靈丹妙藥?
【學(xué)生】欣賞,感悟。
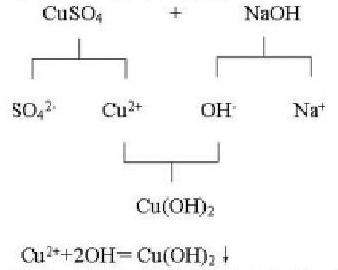
【教師】引導(dǎo)分析。從化學(xué)的視角看啞泉,它實(shí)際上就是一些溶有CuSO4的泉水,其真正致病的就是溶液中的Cu2+。為了除去啞泉中的有害離子,請(qǐng)同學(xué)們?cè)O(shè)計(jì)方案,動(dòng)手實(shí)驗(yàn),看看實(shí)際效果如何。
【學(xué)生】思考、交流、實(shí)驗(yàn)。
【教師】引導(dǎo)、分析。
設(shè)計(jì)意圖:從學(xué)生感興趣的歷史故事出發(fā),引出與本節(jié)課內(nèi)容相關(guān)的問(wèn)題,激發(fā)學(xué)生學(xué)習(xí)興趣,營(yíng)造探究學(xué)習(xí)情景,學(xué)生通過(guò)實(shí)驗(yàn)以及教師的引導(dǎo),培養(yǎng)學(xué)生透過(guò)現(xiàn)象看本質(zhì)的能力。
環(huán)節(jié)二、實(shí)驗(yàn)探究,創(chuàng)設(shè)問(wèn)題情境。
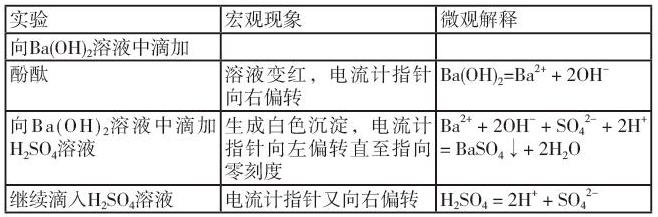
【教師】播放“氫氧化鋇溶液中滴加稀硫酸”實(shí)驗(yàn)視頻。
【提出問(wèn)題】那么如果將氫氧化鋇和硫酸溶液混合,導(dǎo)電能力會(huì)發(fā)生什么樣的變化呢?
【學(xué)生】觀察、記錄實(shí)驗(yàn)現(xiàn)象。
【教師】在實(shí)驗(yàn)過(guò)程中產(chǎn)生了什么實(shí)驗(yàn)現(xiàn)象?電流計(jì)的指針如何變化?為什么這樣變化?請(qǐng)同學(xué)們?cè)囍鴱奈⒂^角度分析產(chǎn)生以上宏觀現(xiàn)象的原因。
【學(xué)生】分析、思考、填表。
設(shè)計(jì)意圖:從學(xué)生熟悉的化學(xué)反應(yīng)入手,采用實(shí)驗(yàn)探究的方式引導(dǎo)學(xué)生構(gòu)建科學(xué)探究的思維模型。學(xué)生從實(shí)驗(yàn)現(xiàn)象,結(jié)合上節(jié)課所學(xué)的電解質(zhì)的電離相關(guān)知識(shí),從宏觀現(xiàn)象與微觀分析相結(jié)合的角度分析解決化學(xué)問(wèn)題。
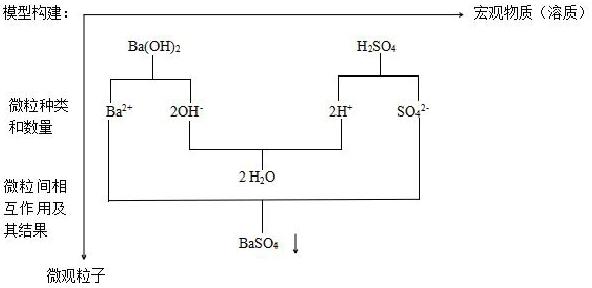
【教師】通過(guò)剛才對(duì)實(shí)驗(yàn)現(xiàn)象的觀察和分析,請(qǐng)同學(xué)們以Ba(OH)2溶液與H2SO4溶液的反應(yīng)為例,試著總結(jié)溶液體系的分析過(guò)程。
【學(xué)生】思考、討論、交流。嘗試構(gòu)建分析模型。
【教師】引導(dǎo)、分析、歸納總結(jié)。
設(shè)計(jì)意圖:通過(guò)構(gòu)建模型,讓學(xué)生建立電解質(zhì)在水溶液中的行為問(wèn)題的認(rèn)識(shí)角度和思路。學(xué)生在分析過(guò)程中逐步形成“微粒觀”,認(rèn)識(shí)到電解質(zhì)在水溶液中的反應(yīng)實(shí)際上是離子之間的反應(yīng)。
環(huán)節(jié)三、探究離子反應(yīng)的本質(zhì)
【教師】根據(jù)以上分析我們知道,電解質(zhì)溶于水時(shí)電離成為離子,所以電解質(zhì)在水溶液中發(fā)生的化學(xué)反應(yīng)都是離子反應(yīng)。是不是所有的電解質(zhì)溶液混合都會(huì)發(fā)生離子反應(yīng)呢?
【學(xué)生】帶著問(wèn)題進(jìn)行實(shí)驗(yàn)探究,并填寫(xiě)下列表格。
實(shí)驗(yàn) 現(xiàn)象
向盛有2mlNa2SO4溶液的試管里加入2ml稀KCl溶液
向盛有2mlNa2SO4溶液的試管里加入2ml稀BaCl2溶液
【教師】引導(dǎo)學(xué)生分析產(chǎn)生不同現(xiàn)象的原因。
【學(xué)生】根據(jù)實(shí)驗(yàn)現(xiàn)象,分析并完成下列表格,并交流討論離子反應(yīng)的本質(zhì)。
【教師】根據(jù)上述實(shí)驗(yàn)探究,水溶液中微粒間作用的結(jié)果是什么呢?也就是說(shuō)溶液發(fā)生了什么變化呢?
【學(xué)生】反應(yīng)物離子濃度和數(shù)目減少,生成新的物質(zhì)。
【教師】引導(dǎo)分析得出結(jié)論:離子反應(yīng)的本質(zhì)是離子之間結(jié)合生成新的物質(zhì),使反應(yīng)物的某些離子的濃度減小。
設(shè)計(jì)意圖:從宏觀與微觀的角度分析電解質(zhì)溶液反應(yīng)的本質(zhì)就是離子濃度的變化,體現(xiàn)了宏觀辨析與微觀探析的核心素養(yǎng)。
【教師】像Na2SO4溶液與BaCl2溶液的反應(yīng)實(shí)質(zhì)是Ba2++SO42-=BaSO4↓,像這種用實(shí)際參加反應(yīng)的離子的符號(hào)來(lái)表示離子反應(yīng)的式子叫做離子方程式。
【學(xué)生】完成下列表中個(gè)反應(yīng)的化學(xué)方程式和離子方程式,思考兩種方程式在表示某一類(lèi)反應(yīng)時(shí),表達(dá)的含義有什么不同,并進(jìn)行討論。
【教師】分析完成的表格,你能得出離子方程式的意義嗎?
【學(xué)生】思考,在教師的引導(dǎo)下得出離子方程式的意義:不僅表示某一個(gè)具體的反應(yīng),還表示一類(lèi)反應(yīng)。
設(shè)計(jì)意圖:學(xué)生通過(guò)對(duì)微觀粒子的分析,知道了離子反應(yīng)的本質(zhì)就是溶液中某些離子濃度的減少,微觀粒子在溶液中的行為其實(shí)就是離子反應(yīng)方程式的書(shū)寫(xiě)。因此,離子方程式的書(shū)寫(xiě)不再是按教材的“寫(xiě)、拆、刪、查”的書(shū)寫(xiě)步驟,從而簡(jiǎn)化了離子方程式的書(shū)寫(xiě);同時(shí)通過(guò)思考與交流,很直觀的得出離子反應(yīng)方程式的意義。
環(huán)節(jié)四、探究離子反應(yīng)發(fā)生的條件
【教師】根據(jù)前面的實(shí)驗(yàn)我們知道了不是所有的電解質(zhì)溶液混合都有離子反應(yīng)發(fā)生,那離子反應(yīng)要發(fā)生需具備哪些條件呢?請(qǐng)同學(xué)們從微觀的角度解釋現(xiàn)象產(chǎn)生的原因。
【學(xué)生】分組實(shí)驗(yàn)并完成下列表格。
【教師】投屏展示學(xué)生實(shí)驗(yàn)結(jié)果,并讓學(xué)生從微觀角度解釋產(chǎn)生上述實(shí)驗(yàn)結(jié)果的原因。并讓學(xué)生歸納總結(jié)離子反應(yīng)發(fā)生的條件。
【學(xué)生】復(fù)分解型離子反應(yīng)發(fā)生的條件是生成物有沉淀、氣體或水生成。
設(shè)計(jì)意圖:學(xué)生通過(guò)分組實(shí)驗(yàn),從微觀角度對(duì)宏觀實(shí)驗(yàn)現(xiàn)象進(jìn)行分析和解釋?zhuān)瑢?duì)離子反應(yīng)發(fā)生的條件有了更深刻的感悟,能夠利用溶液中離子反應(yīng)的基本模型理解電解質(zhì)在溶液中發(fā)生復(fù)分解反應(yīng)的條件。
環(huán)節(jié)五、課堂評(píng)價(jià)—應(yīng)用所學(xué)知識(shí),解決實(shí)際問(wèn)題。
【教師】設(shè)計(jì)情境:水體中含量過(guò)高的Ca2+、Mg2+既會(huì)造成鍋爐結(jié)垢,也會(huì)降低洗滌衣物時(shí)肥皂的使用效率;同時(shí)飲用水中含有過(guò)多的Ca2+、Mg2+、SO42-等離子,對(duì)人體健康產(chǎn)生了一定的危害。
提出問(wèn)題:如何在不引入新雜質(zhì)的情況下除去這些離子,使水得到凈化?
【學(xué)生】分析、思考、小組合作探究,設(shè)計(jì)實(shí)驗(yàn)方案。
【教師】展示學(xué)生成果加以評(píng)價(jià),并引導(dǎo)學(xué)生對(duì)實(shí)驗(yàn)方案進(jìn)行修正。
【學(xué)生】歸納總結(jié)實(shí)驗(yàn)方案設(shè)計(jì)時(shí)應(yīng)注意以下幾點(diǎn):
(1)藥品的選擇,確定加藥順序和操作順序;
(2)確保所加藥品(應(yīng)適當(dāng)過(guò)量)在后續(xù)反應(yīng)中被清除。
設(shè)計(jì)意圖:將所學(xué)理論知識(shí)與生活實(shí)際相結(jié)合,以學(xué)生熟悉的生活用水為情境設(shè)計(jì)問(wèn)題,用所學(xué)知識(shí)解決實(shí)際問(wèn)題,讓學(xué)生體會(huì)化學(xué)知識(shí)在實(shí)際生產(chǎn)生活中的應(yīng)用,進(jìn)一步加深學(xué)生對(duì)離子反應(yīng)的理解。
三、教學(xué)反思
1.本節(jié)課從Ba(OH)2溶液與H2SO4溶液反應(yīng)的導(dǎo)電性實(shí)驗(yàn)出發(fā),分析電解質(zhì)在溶液中的行為,并從微觀角度解釋宏觀現(xiàn)象,構(gòu)建電解質(zhì)在水溶液中離子反應(yīng)的認(rèn)知模型;
2.通過(guò)實(shí)驗(yàn)探究,應(yīng)用所構(gòu)建的認(rèn)知模型分析歸納得出離子反應(yīng)的本質(zhì)是溶液中某些離子濃度的減少,并根據(jù)本質(zhì)寫(xiě)出離子反應(yīng)方程式,簡(jiǎn)化了離子方程式的書(shū)寫(xiě);
3.利用認(rèn)知模型結(jié)合實(shí)驗(yàn)探究得出復(fù)分解反應(yīng)型離子反應(yīng)發(fā)生的條件,使宏觀辨識(shí)與微觀探析、證據(jù)推理與模型認(rèn)知等學(xué)科核心素養(yǎng)在課堂教學(xué)中得以落實(shí);
4.最后通過(guò)課堂評(píng)價(jià),利用所學(xué)原理解決生活中的實(shí)際問(wèn)題,體現(xiàn)了化學(xué)在實(shí)際生產(chǎn)中的應(yīng)用。
本節(jié)課極大的發(fā)揮了實(shí)驗(yàn)探究的教學(xué)功能,從微觀的角度解釋了宏觀的實(shí)驗(yàn)現(xiàn)象,并引導(dǎo)學(xué)生構(gòu)建了水溶液的認(rèn)知模型,很好的體現(xiàn)了宏觀辨識(shí)與微觀探究、證據(jù)推理與模型認(rèn)知得化學(xué)學(xué)科核心素養(yǎng),真正的將學(xué)科核心素養(yǎng)融入到了課堂教學(xué)中。

