適應性進化技術選育優良乙醇耐受性能Millerozyma farinosa
李瑩,陳延儒,吳曉江,鄧夢菲,吳生文,萬茵,劉成梅,付桂明*
1(南昌大學,食品科學與技術國家重點實驗室,食品學院,國際食品創新研究院,江西 南昌,330047) 2 (四特酒有限責任公司,江西 樟樹,331200)
Millerozyma(Pichia)farinosaCBS 7064屬于畢赤酵母屬[1],對生物胺有降解作用[2],在白酒酒醅[3]、醬油[4]、泡菜[5]、大豆醬[6]中均有發現。目前,關于M.farinosa的性質與應用研究較少。酒類的發酵,會帶來高乙醇含量和高滲透壓等環境,引起細胞活力和發酵性能的改變[7-8]。研究發現,5%的乙醇便會使酵母降解生物胺能力大幅下降[9]。過高的乙醇含量會破壞離子平衡,導致蛋白質聚集和功能障礙,對線粒體中酶活性、細胞膜的組分和細胞結構產生影響,抑制細胞的生長甚至導致細胞死亡[10-11]。
目前,提高酵母乙醇耐受性的方法有誘變菌株、基因工程、基因組改造等手段[12],或是提供營養底物和生物活性成分改善酵母菌株的環境耐受性[13-14]。其中適應性實驗室進化技術是預先將微生物暴露于脅迫環境中,以提高其適應性。目前已被廣泛應用于對菌株表型特征、生理生化特性、發酵性能的影響及其分子機制的研究[15]。如TOMS-PEJ等[16]研究發現,短期適應抑制劑的釀酒酵母生長延滯期明顯縮短,比生長速率顯著提高,菌株的乙醇生產能力提高了80%。
本研究以實驗室保藏菌株M.farinoseNCUF 304.1進行適應性進化,以期獲得乙醇耐受性得到提高的酵母菌株,并研究其與原始菌株間生長與性能的差異,為后續探究M.farinosaNCUF 304.1耐乙醇的內在機制奠定前期基礎,對其更好應用于酒類釀造降解生物胺,提高酒類質量安全有深遠意義。
1 材料與方法
1.1 菌株與培養基
菌株:實驗室保藏的從特香型白酒酒醅中篩選所得菌株MillerozymafarinosaNCUF304.1。
培養基:酵母膏胨葡萄糖(yeast peptone dextrose,YPD)培養基。
1.2 試劑和儀器設備
試劑均購于西隴科學。
MMC-1全自動高通量微生物液滴培養儀,洛陽華清天木生物科技有限公司;SP-756P型紫外可見分光光度計,上海光譜儀器有限公司;DDS-307型電導率儀,上海雷磁儀器有限公司;日立SU8100型場發射掃描電鏡, 日本日立集團。
1.3 實驗方法
1.3.1 菌株適應性進化
適應性進化:M.farinosaNCUF304.1菌液按5%接種量接入新的YPD培養基中,混勻后將培養液轉移至進樣瓶,接入MMC-1全自動高通量微生物液滴培養儀,設置培養溫度28 ℃、起始乙醇體積分數為5%,以1%遞加,每一個梯度傳代馴化5~10代,收集最后一個梯度下生長狀況最優的菌株。
1.3.2 耐乙醇能力測定
參照MO等[17]的方法,以不同乙醇體積分數梯度(0%、5%、6%、7%、8%、9%、10%、11%、12%和13%)培養M.farinosa,進行平板點種實驗。
1.3.3 高乙醇脅迫下酵母菌株生長的測定
向滅菌的50 mL YPD培養基(乙醇體積分數分別為0%、8%),接種2%酵母種子液,28 ℃、180 r/min培養,每4 h取樣,測定OD600值,計算平均值,繪制酵母生長趨勢曲線。
1.3.4 乙醇脅迫培養和樣液處理
乙醇脅迫培養:基于生長曲線的結果,向滅菌的50 mL YPD培養基(乙醇體積分數分別為0%、8%),接種2%酵母種子液,于28 ℃、180 r/min分別培養28、36、44 h。
樣液處理:收集5 mL酵母種子液,4 ℃,6 000 r/min,離心5 min,相同體積的無菌生理鹽水洗滌2次,加入5 mL蒸餾水,28 ℃水浴15 min,按上述條件離心5 min,保留上清液為實驗樣液,菌體沉淀烘干至恒重,測其干重。
1.3.5 細胞泄漏內容物含量測定
可溶性蛋白含量測定采用考馬斯亮藍法[18],單位為 μg/g DCW;總糖含量測定采用蒽酮-硫酸法[19],單位為mg/g DCW。
1.3.6 電導率測定
參照李沖偉等[20]的方法,單位為 μg/(cm·g DCW)。
1.3.7 丙二醛含量
參照文獻[21-22]的方法,單位為mmol/g DCW。
1.3.8 海藻糖含量
參照李艷玲[19]的方法提取海藻糖并測定其含量,單位為mg/g DCW。
1.3.9 菌體表面結構觀察
參照LI等[14]的實驗方法,使用掃描電子顯微鏡系統對酵母在不同乙醇含量下的酵母細胞表面形態進行觀察。收集菌體,0.1 mol/L磷酸緩沖液(pH 7.2)洗滌菌體3次,加入2.5%的戊二醛固定液(pH 7.2)于4 ℃冰箱固定12 h,0.1 mol/L磷酸緩沖液洗滌菌體2次。乙醇體積分數依次為30%、50%、70%、90%,脫水15 min,100%乙醇3次洗脫(每次20 min),叔丁醇置換乙醇2次,每次20 min。樣品冷凍干燥,噴金后用場發射掃描電鏡進行分析。
1.3.10 數據統計分析
上述實驗均進行3次平行重復,用Excel 2013軟件計算數據標準偏差和均值,用 SPSS 17.0軟件進行顯著性分析(P<0.05),用Origin 9軟件制作圖像。
2 結果與分析
2.1 適應性進化體系下酵母馴化結果
原始菌株自乙醇體積分數超過5%,生長開始受抑制(圖1)。之后,對原始菌株進行時間長達18 d的乙醇耐受適應性進化。最后在8%乙醇體積分數下馴化10代后,分離純化得到2株生長量有明顯提升的菌株,分別命名為M.farinosaNCUF 304.1-1,M.farinosaNCUF 304.1-2。
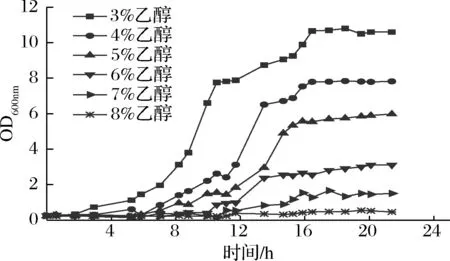
圖1 乙醇含量對M.farinosa NCUF 304.1生長的影響Fig.1 Effects of ethanol concentration on growth of M.farinosa NCUF 304.1
圖2表明在8%乙醇體積分數下,2株適應性進化菌株NCUF 304.1-1、NCUF 304.1-2相比原始菌株,生物量有顯著差異。24 h時,M.farinosaNCUF 304.1-1的OD值約為6.60,比原始菌株高1.5。進行生長量驗證實驗,結果表明馴化菌株NCUF 304.1-1、NCUF 304.1-2相比原始菌株,在8%乙醇體積分數下培養24 h后生長量分別提高了12.18%和7.98%(表1)。后續使用M.farinosaNCUF 304.1-1和原始菌株作為實驗菌株。
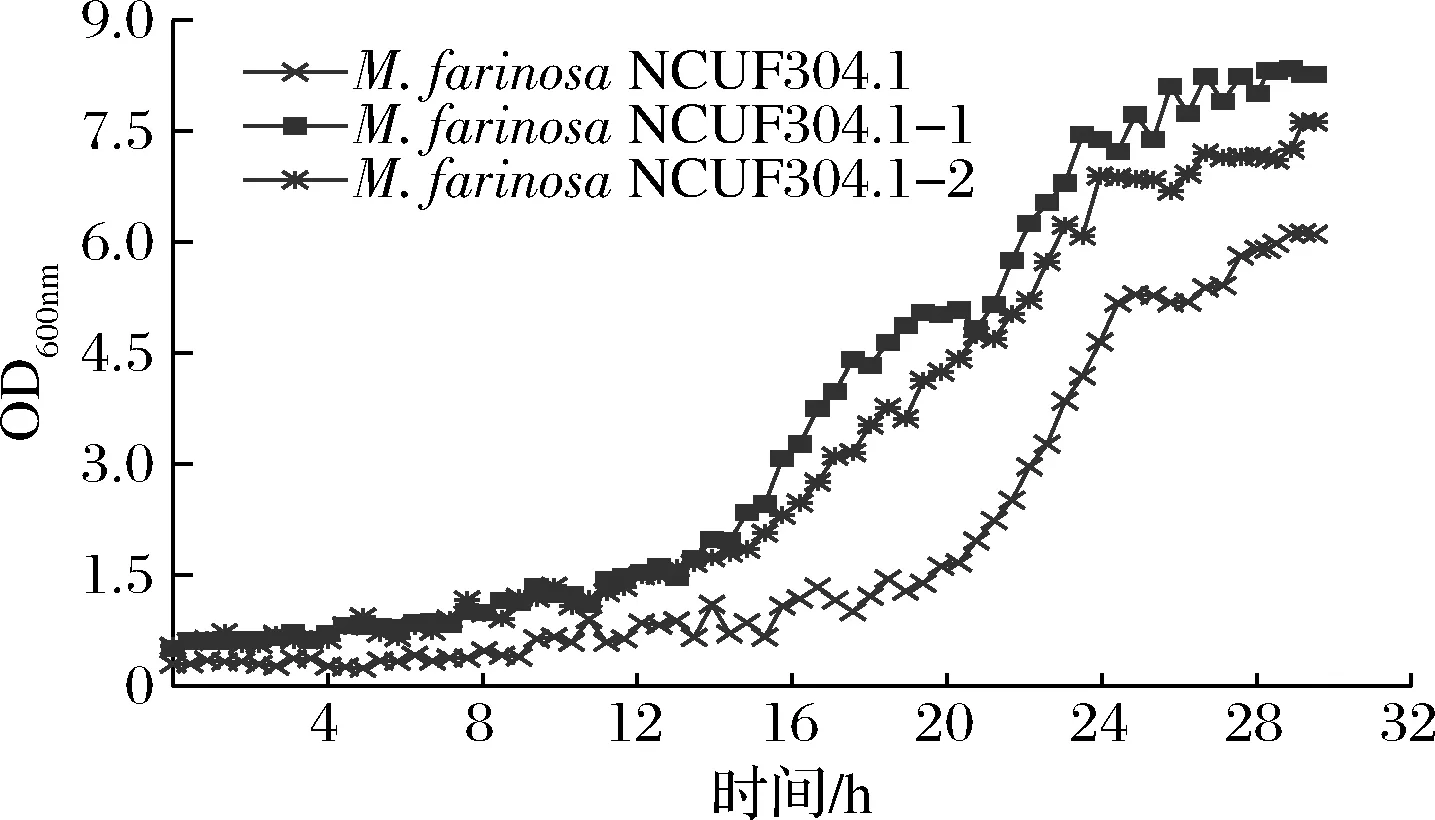
圖2 8%乙醇對出發菌株和進化菌株生長的影響Fig.2 Effect of 8% ethanol on growth of original and evolved strains
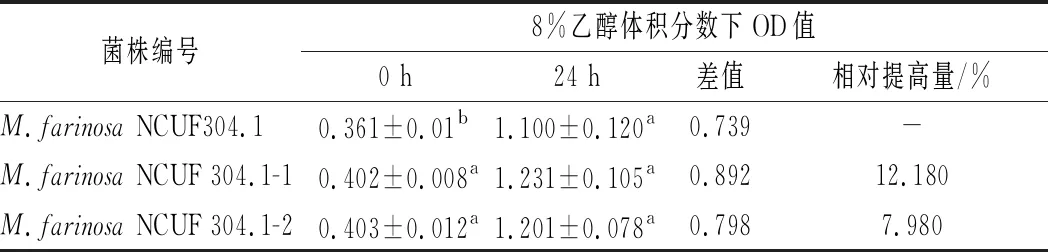
表1 8%乙醇對出發菌株和進化菌株OD值的影響Table 1 Effect of 8% ethanol on OD value of original and evolved strains
2.2 菌株與原始菌株耐受乙醇能力對比
不同乙醇含量下酵母生長情況如圖3所示。M.farinosaNCUF304.1和M.farinosaNCUF 304.1-1對乙醇的最大耐受體積分數達到12%~13%,相比之下,NCUF 304.1-1有較好的乙醇耐受性,耐受度比原始菌株高出1%(體積分數),在13%乙醇體積分數,菌液稀釋10倍后仍能形成較明顯的菌落,表明適應性進化后的菌株NCUF 304.1-1,提高了對乙醇的耐受性。

1-原菌液;10-稀釋10倍后的菌液圖3 出發菌株和進化菌株耐受乙醇能力Fig.3 Ability of original and evolved strains to tolerate ethanol
2.3 乙醇脅迫對菌株生長的影響
圖4表明,0%乙醇體積分數下,出發菌株和進化菌株較快進入生長期,而在8%乙醇下,酵母具有16~20 h的生長延滯期。M.farinosaNCUF 304.1-1顯示出更高的生長速率,并且最終生長量高于M.farinosa
NCUF 304.1,結果表明高體積分數乙醇(8%)對酵母具有延緩生長,降低生物量的負面作用,但適應性進化后的M.farinosaNCUF 304.1-1受到的消極影響較少。
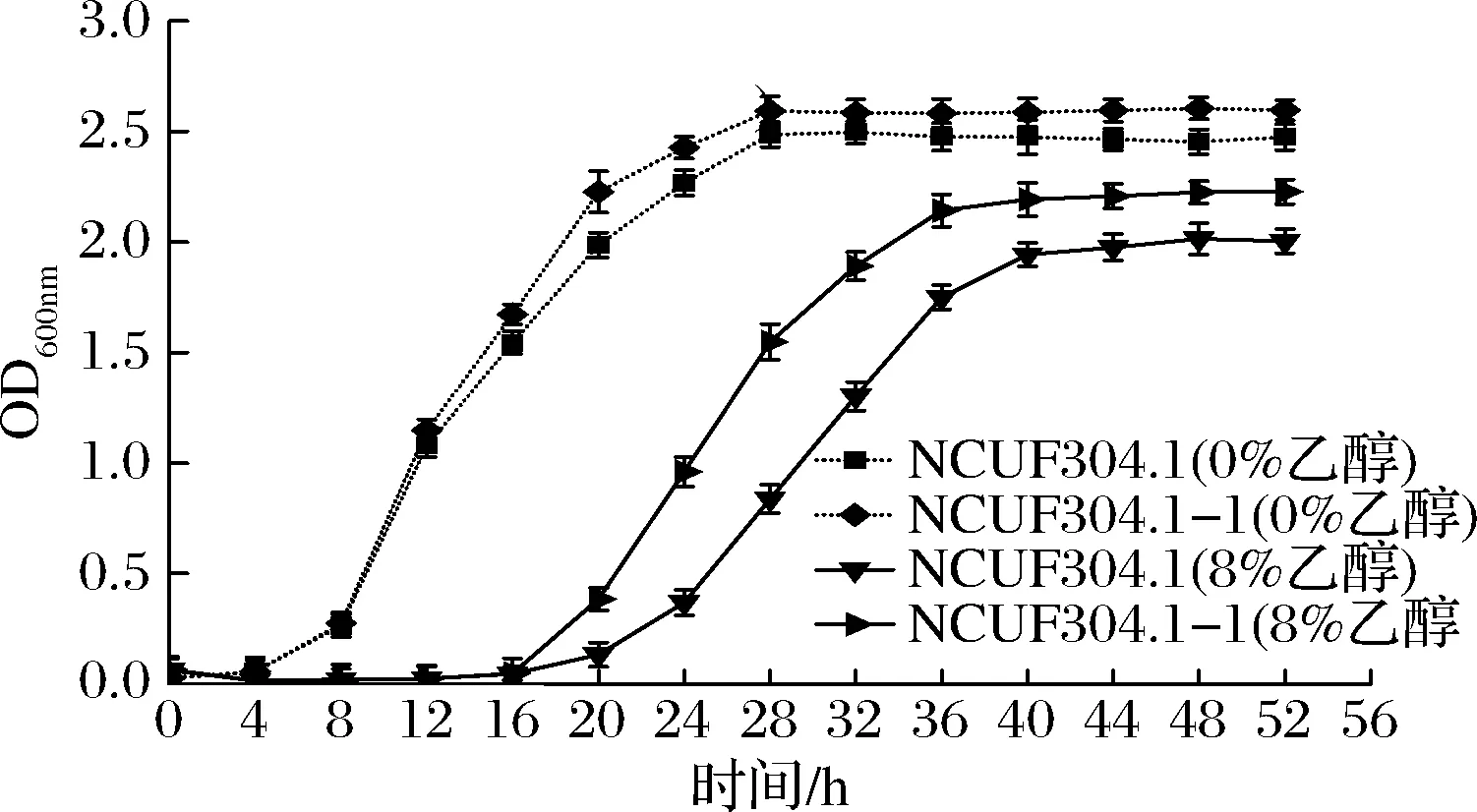
圖4 乙醇對酵母生長的影響Fig.4 Effect of ethanol on yeast growth
2.4 乙醇脅迫對菌株細胞膜的影響
酵母細胞膜是乙醇毒性作用的主要靶標。乙醇對脂質雙層具有擾動作用,破壞膜的結構并抑制膜蛋白的活性[23],導致離子泄漏和電化學梯度的耗散,抑制營養物質在膜上的轉運和吸收[24]。選擇8%乙醇下M.farinosaNCUF304.1和M.farinosaNCUF 304.1-1的指數生長期中期、穩定期初期、穩定期后期,分別為28、36和44 h,測定酵母的可溶性蛋白含量、總糖含量和電導率[25]以顯示膜通透性的變化,研究高體積分數乙醇對酵母細胞膜的損害作用。如圖5-a所示,8%乙醇下,M.farinosaNCUF304.1和M.farinosaNCUF 304.1-1胞內泄漏可溶性蛋白質的含量呈現隨時間增加而降低,36 h后含量降低。可能是細胞長期受到高體積分數乙醇脅迫,膜破損較為嚴重,細胞內容物有較大程度的泄漏。相比原始菌株,M.farinosaNCUF 304.1-1的泄漏量明顯減少(P<0.05)。總糖含量變化與可溶性蛋白含量變化趨勢相似(圖5-b)。

a-可溶性蛋白質含量;b-總糖含量;c-電導率圖5 乙醇含量對細胞泄漏可溶性蛋白質含量、總糖含量和電導率的影響Fig.5 Effect of ethanol concentration on the protein content,total sugar and electric conductivity of cell注:圖中各組中不同的小寫字母表示含量具有顯著性差異(P<0.05)(下同)
電導率是衡量細胞膜通透性的重要指標,其值越大,細胞膜受害程度越重[20]。鞏林林等[26]研究發現,高體積分數乙腈會使酵母菌液電導率值不斷增加。圖5-c顯示,在28 h時,2株菌電導率有顯著差異(P<0.05),且都高于無乙醇脅迫組。這一結果也論證8%乙醇使得酵母細胞膜通透性增加。NCUF 304.1-1在適應性進化過程中,可能激發了抵御乙醇損傷的機制,表現出較好的細胞膜完整性,獲得了優于出發菌株的乙醇耐受性。
2.5 乙醇脅迫對菌株丙二醛含量的影響
丙二醛(malondialdehyde,MDA)常作為脂質過氧化的指標,反映細胞膜脂過氧化的程度[27]。圖6表明,隨著乙醇脅迫時間的增加,8%的乙醇體積分數下,出發菌株和進化菌株的MDA的含量呈現先增加后減少的趨勢,28~36 h時,細胞受到乙醇引發的氧化脅迫,MDA含量因此增加,顯著高于無乙醇脅迫組(P<0.05)。趙素娟[28]研究表明乙醇脅迫下酵母細胞MDA含量幾乎為對照的3倍。M.farinosaNCUF 304.1的MDA含量高達10.147 mmol/g,細胞受到較嚴重的膜氧化損傷。進化菌株M.farinosaNCUF 304.1-1減少了19.5% MDA生成量,表明其細胞受到的氧化傷害減少,自身抗氧化體系的增強,提高了細胞膜的完整性。
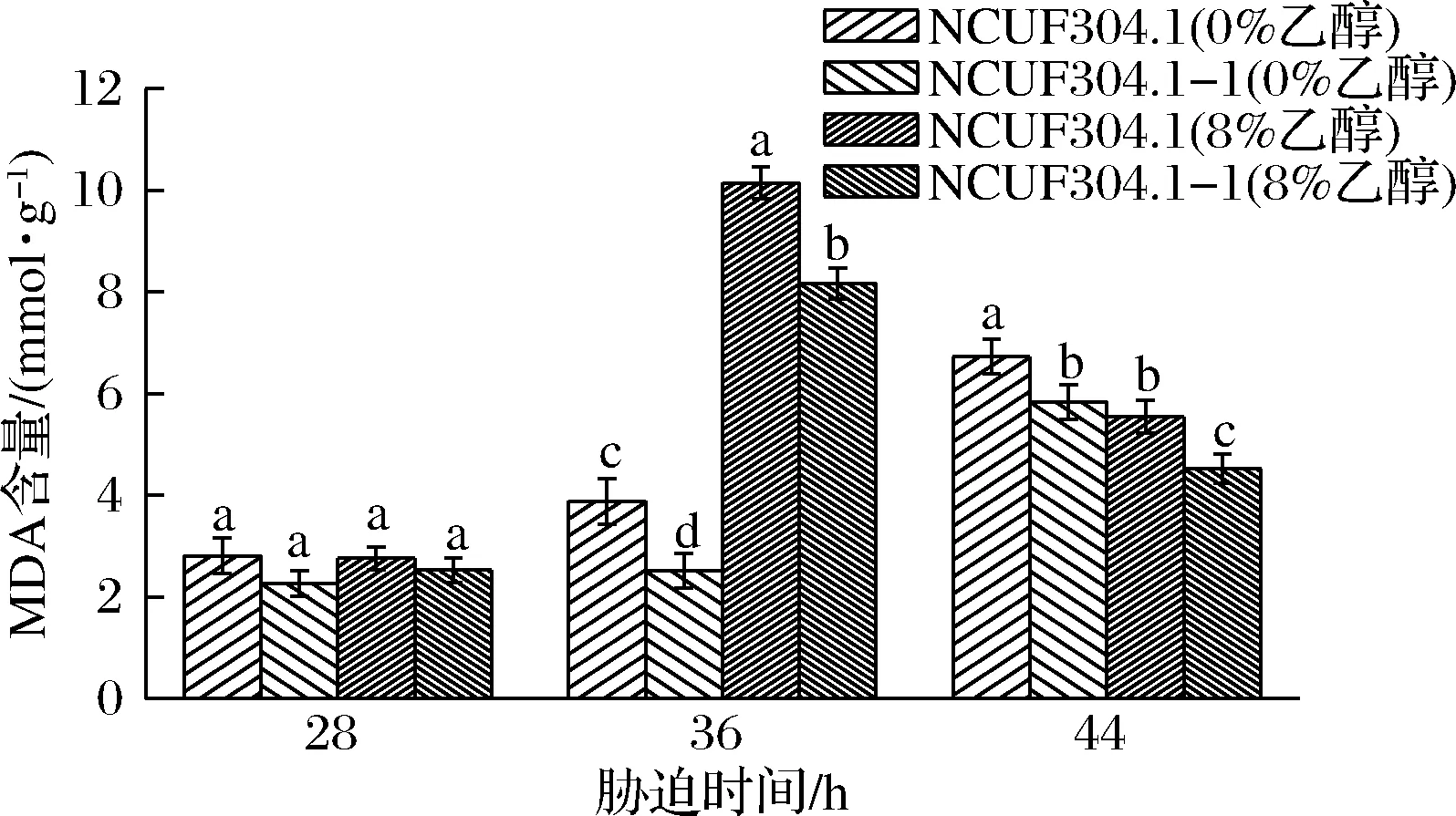
圖6 乙醇含量對MDA含量的影響Fig.6 Effect of ethanol concentrations on MDA content
2.6 乙醇脅迫對菌株海藻糖含量的影響
酵母面臨高溫、乙醇等脅迫時,會引起細胞內海藻糖含量不同程度的上升[11]。海藻糖可保護蛋白質避免其發生變性[29]。28 h時8%體積分數下出發菌株和進化菌株海藻糖積累較少,細胞處于指數生長期,分配給海藻糖合成的能量較低。44 h時8%乙醇下海藻糖積累量下降,可能是由于酵母細胞長時間處于脅迫環境下,細胞死亡量增加,海藻糖含量顯著降低(圖7)(P<0.05)。值得注意的是,M.farinosa應對高乙醇脅迫環境時,海藻糖含量并沒有顯著的上升。相類似的是,MO等[17]發現Kluyveromycesmarxianus處于高濃度乙醇脅迫環境時,海藻糖代謝基因并沒有出現上調(低乙醇濃度脅迫時出現),而固醇生物合成和分泌的途徑均被激活,K.marxianus激發了獨特的途徑抵抗不同乙醇濃度造成的細胞損傷。M.farinosaNCUF 304.1-1海藻糖的積累量低于M.farinosaNCUF304.1,可能原因是M.farinosaNCUF 304.1-1在適應性進化中,誘導了除海藻糖外的其他自身抗氧化體系的增強。然而,具體的途徑還有待進一步的研究。
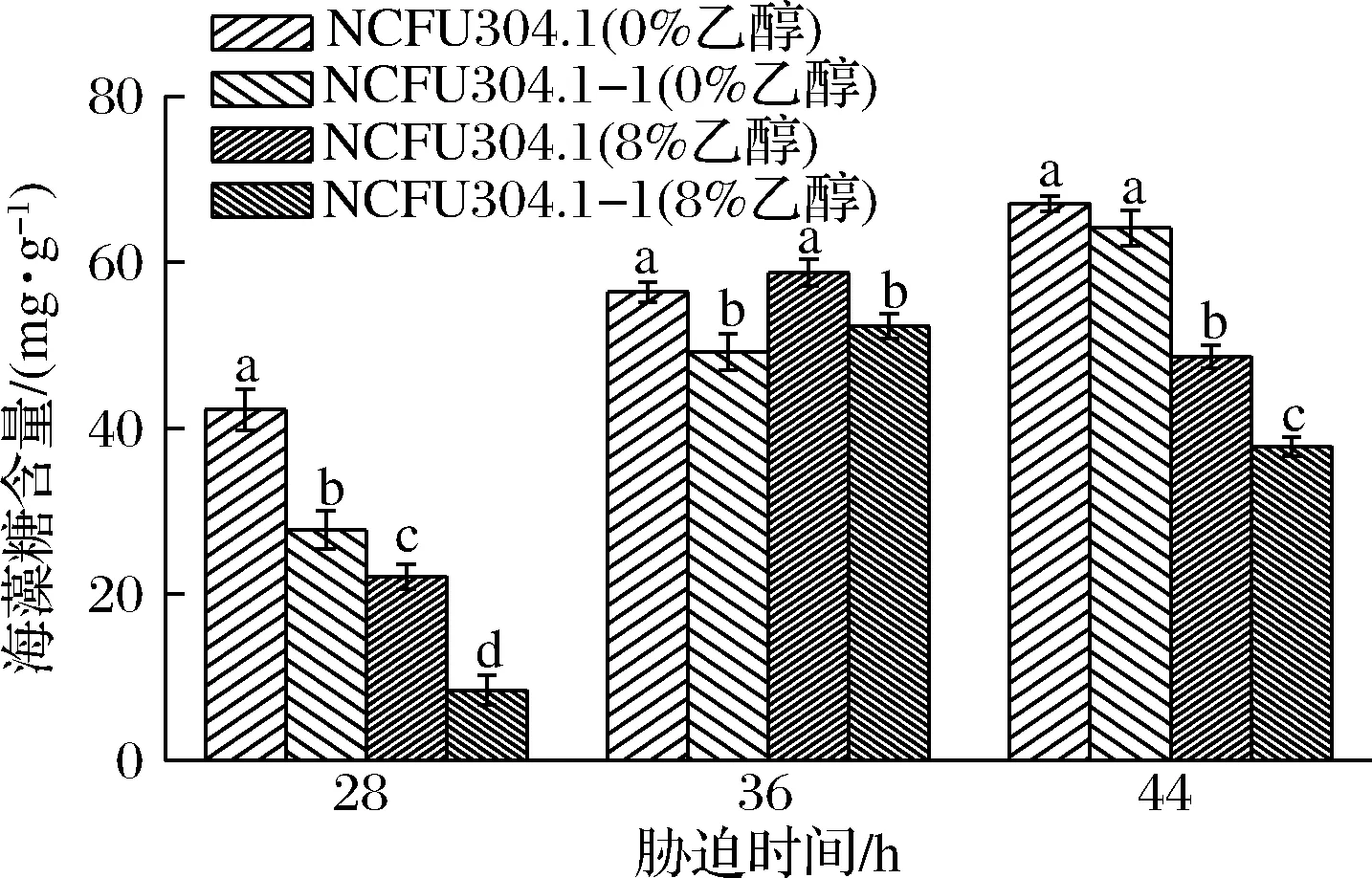
圖7 乙醇含量對出發菌株和進化菌株海藻糖含量的影響Fig.7 Effect of ethanol concentrations on trehalose content of original and evolved strains
2.7 乙醇脅迫對菌株表面結構的影響
如圖8-a和8-b所示,無乙醇脅迫時,出發菌株和進化菌株的菌體為橢圓形,細胞表面光滑,菌體飽滿。28和36 h時,8%乙醇下2株菌都出現明顯的表面凹陷和褶皺,細胞形態出現嚴重的變形(圖8-c、8-d、8-e和8-f)。相比之下,進化菌株NCUF 304.1-1相比出發菌株NCUF304.1菌體損傷較小,受損細胞數的比例降低。8%乙醇脅迫酵母44 h后,出發菌株NCUF304.1變形嚴重,細胞表面出現明顯裂縫,進化菌株NCUF 304.1-1變形程度較輕,細胞表面可觀察到的裂縫較少,相比原始菌株具有較好的膜完整性(圖8-g,8 h)。
3 結論
本研究結果表明,適應性進化獲得的進化菌株M.farinosaNCUF 304.1-1,在8%乙醇體積分數下,相比原始菌株,縮短了4 h的生長延滯期,增加了生物量,其耐受乙醇能力提高至13%乙醇。細胞內物質泄漏減少,細胞膜完整性提高,細胞表面結構破損較少,細胞內丙二醛含量顯著降低19.5%,抵抗氧化損傷能力有所增加,但其海藻糖含量的積累量降低。

a-NCUF304.1(0%乙醇);b-NCUF 304.1-1(0%乙醇);c-NCUF304.1(8%乙醇,28 h);d-NCUF 304.1-1(8%乙醇,28 h);e-NCUF304.1(8%乙醇,36 h);f-NCUF 304.1-1(8%乙醇,36 h);g-NCUF304.1(8%乙醇,44 h);h-NCUF 304.1-1(8%乙醇,44 h)圖8 不同乙醇含量下酵母菌株掃描電子電鏡觀察圖(5 000×)Fig.8 SEM examination of yeast in different ethanol concentrations (5 000×)
適應性進化菌株M.farinosaNCUF 304.1-1的乙醇耐受性顯著提高,其細胞膜完整性和抗氧化性及表面結構完整性都優于原始菌株,對于M.farinosaNCUF 304.1-1應用于白酒、果酒釀造,提高其生存性及降低酒體生物胺能力,提高酒品安全質量有重要意義。

