復合誘變選育高產α-環糊精葡萄糖基轉移酶的菌株及產酶條件優化
陶大煒,張小丹,寧喜斌,2,3,4*,孫夢潔
1(上海海洋大學 食品學院,上海,201306) 2(上海水產品加工及貯藏工程技術研究中心,上海,201306) 3(農業部水產品貯藏保鮮質量安全風險評估試驗室(上海),上海,201306) 4(國家淡水水產品加工技術研發分中心(上海),上海,201306)
環糊精通常由6個以上D-吡喃葡萄糖基通過α-1,4-糖苷鍵相連而成,由于葡萄糖基個數的不同,又被分為α-、β-和γ-環糊精三種,其中α-環糊精有6個葡萄糖基,β-環糊精有7個,而γ-環糊精有8個[1]。環糊精葡萄糖基轉移酶(cyclodextrin glycosyltransferase,CGTase)是一種典型的淀粉分解酶,可對淀粉等物質進行降解,使葡萄糖基團發生轉移,從而獲得環糊精[2]。環糊精分子具有的外表親水、內里疏水的中空圓筒結構,使得環糊精可以包絡不同化合物,從而改變它們物理和化學性質,例如抗氧化、避免熱分解、提高物質的溶解度和穩定性等,因此環糊精可以被廣泛地應用于食品工業、農藥、化妝品、醫藥、環保、化學分析與檢測等諸多領域里[3-6]。CGTase可廣泛應用于多種反應:環化、歧化、耦合和水解反應,其中前3種為轉糖基反應,環糊精由于其高效的轉糖基反應而具有廣闊的工業運用價值[7-8]。紫外線(ultraviolet,UV)可穿透細菌細胞直接作用于DNA,使得堿基無法正常配對,從而產生基因突變,其具有成本低、操作簡便、高突變率、高安全性等特點[9]。微波作為一種高頻率(300 MHz~3 000 GHz)電磁波,具有設備簡單、操作簡便和安全可靠的誘變特點。微波誘變可通過引起極性分子的劇烈震動,使菌懸液內DNA分子間強烈摩擦,細菌DNA結構發生變化,發生遺傳變異的可能[10]。
目前國內報道的關于此類酶的誘變育種與培養基優化等方面,多為物理-化學復合誘變,未見紫外-微波復合誘變方法[11-13]。國內外報道的產α-CGTase菌株酶活力較低[14-16]、熱穩定性較差[17-19]。本試驗在前期菌株篩選的基礎上,使用紫外-微波復合誘變菌株,研究菌株的最適誘變條件后篩選出酶活力高且遺傳性狀穩定的菌株,結合Plackett-Burman試驗及Box-Behnken中心組合試驗2種方法優化菌株發酵條件,旨在高效地提高出發菌株PaenibacillusmaceransTLLY7的產酶能力,為進一步工業化開發利用性狀穩定且高產α-CGTase的菌株提供借鑒。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株來源
α-環糊精葡萄糖基轉移酶產生菌株P.maceransTLLY7,由本實驗室自行篩選鑒定,-80 ℃冰箱甘油管保存[20]。其生理生化特性為可水解淀粉、葡萄糖產酸產氣、硝酸鹽還原試驗陽性,吲哚試驗、分解酪氨酸試驗陰性等。菌株PCR擴增產物經測序得到的16S rRNA序列為1 480 bp,經構建系統發育樹后,與P.maceransNBRC 15307T(NR112729.1)在同一分支上,同為類芽孢桿菌屬,結合形態學、生理生化鑒定確定菌株TLLY7為浸麻類芽孢桿菌(P.macerans),菌株的核酸序列通過Bankit向GenBank申請的登錄號為MT705866。該菌株產酶的酶活力為1.35 U/mL,其最適反應溫度為50 ℃、最適反應pH值為6.0,并且在40~45 ℃、pH 6.0~9.0穩定性良好。
1.1.2 試劑
酵母浸粉、可溶性淀粉、蛋白胨等,上海生工生物工程有限公司;α-環糊精,Sigma(上海)公司;NaCl、K2HPO4·3H2O、MgSO4·7H2O、Na2CO3、酚酞、甲基橙及其他試驗所用試劑均為分析純。
1.1.3 培養基
篩選培養基(g/L):可溶性淀粉10,蛋白胨5,酵母浸粉5,瓊脂15,NaCl 5,Na2CO31,K2HPO4·3H2O 1,MgSO4·7H2O 0.5,酚酞 0.3,甲基橙 1,自然pH,121 ℃,0.1 MPa滅菌20 min。
種子及發酵培養基(g/L):可溶性淀粉10,蛋白胨5,酵母浸粉5,NaCl 5,K2HPO4·3H2O 1,MgSO4·7H2O 0.5,pH 7.0,121 ℃,0.1 MPa滅菌20 min。
斜面培養基(g/L):蛋白胨10,牛肉膏3,NaCl 5,瓊脂 15,pH 7.0,121 ℃,0.1 MPa滅菌20 min。
1.2 主要儀器與設備
UV-1800PC紫外可見分光光度計,上海美譜達儀器有限公司;立式高壓蒸汽滅菌鍋,上海申安醫療器械廠;超凈工作臺,蘇凈集團安泰公司;臺式pH精密測試儀,德國WTW公司;高速臺式離心機,上海安亭科學儀器廠。
1.3 試驗方法
1.3.1 生長曲線的測定
接種5 mL菌株TLLY7種子液至100 mL/250 mL發酵培養基中,在37 ℃,160 r/min下培養,每隔4 h取樣,在波長600 nm下測定吸光度,繪制菌株生長曲線。
1.3.2 酶活力測定
制備粗酶液:發酵培養基裝液量50 mL/250 mL,菌種接種量為體積分數4%的種子培養基,37 ℃、160 r/min搖床培養48 h,于10 000 r/min離心10 min后所得上清液即為粗酶液。
采用甲基橙褪色法測定酶的環化活力。在酸性(pH 1.1~1.4)條件下,α-環糊精與甲基橙發生反應,形成絡合物,使溶液的吸光度下降。在一定范圍內,吸光度的下降與α-環糊精的濃度存在著線性關系[21]。用濃度為50 mmol/L Na2HPO4-NaH2PO4緩沖液(pH 6.0)配制40 g/L的可溶性淀粉溶液做底物,取0.9 mL于試管中,加入適當稀釋的粗酶液0.1 mL,均勻混合。50 ℃水浴反應10 min,加入濃度為1 mol/L HCl溶液1 mL中止反應。再加入濃度為0.1 mmol/L甲基橙溶液1 mL,于20 ℃靜置15 min,507 nm測定吸光度[22]。對應α-環糊精標準曲線計算濃度,酶活力單位(U)定義為上述條件下每分鐘生成1 μmol α-環糊精所需的酶量。
1.3.3 菌懸液的制備
在100 mL/250 mL的發酵培養基中接種活化完成的菌株種子液(4%,體積分數)作為發酵液。取處于對數生長后期的發酵液,于10 000 r/min離心10 min,棄上清液收集菌體。用無菌生理鹽水充分振蕩洗滌后,離心2 min棄去上清液,重復2~3次后用生理鹽水重新懸浮菌體,所得即為菌懸液。用顯微鏡進行觀察計數,適當稀釋后使菌液濃度在108CFU/mL左右。
1.3.4 紫外誘變
1.3.4.1 紫外誘變條件的確定
選用的功率為20 W紫外燈,設置其與培養皿間距30 cm。預熱紫外燈30 min后,吸取10 mL菌懸液加入到直徑9 cm的無菌空培養皿中,分別照射10、20、30、40、50、60、70、80、90、100 s,并用磁力攪拌器攪拌均勻。對紫外誘變后的菌懸液梯度稀釋,吸取100 μL稀釋度為10-4、10-5、10-6的稀釋液至篩選培養基中,涂布均勻,37 ℃避光倒置培養48 h,進行菌落計數[9]。挑選出長勢良好的單菌落,發酵培養并分別測定酶活力,計算正突變率。取未經誘變處理的等濃度菌懸液作為對照組,對致死率進行計算。根據致死率和正突變率確定紫外誘變的最佳時間。按公式(1)(2)計算致死率和正突變率:

(1)

(2)
1.3.4.2 紫外誘變選育高酶活力菌株
對菌株TLLY7在最佳的紫外誘變條件下進行誘變,并測定平板中長勢良好的菌株酶活力,得到酶活力較高的菌株做進一步研究。
1.3.5 微波誘變
1.3.5.1 微波誘變條件的確定
選用額定功率為700 W,脈沖頻率為2 450 MHz的微波爐。吸取1 mL菌懸液至2 mL離心管中,將離心管放在盛有蒸餾水的燒杯中,每隔15 s換1次水,以減少微波的熱效應造成菌懸液溫度過高而導致菌體大量死亡。使用低火檔,輻照時間依次為15、30、45、60、75、90 s,并對微波誘變后的菌懸液梯度稀釋,吸取100 μL稀釋度為10-4、10-5、10-6的稀釋液至篩選培養基中,涂布均勻,37 ℃避光倒置培養48 h,進行菌落計數[10]。挑選出長勢良好的單菌落,發酵培養并分別測定酶活力,計算正突變率。取未經誘變處理的等濃度菌懸液作為對照組,計算致死率。根據致死率和正突變率確定微波誘變的最佳時間。
1.3.5.2 微波誘變選育高酶活力菌株
對經紫外誘變后得到的高酶活力菌株UV2-10在最佳微波誘變條件下進行誘變,并對平板中長勢良好的菌株進行酶活力測定,得到酶活力較高的菌株做進一步研究。
1.3.6 突變菌株遺傳穩定性的測定
對經復合誘變處理后選取的高酶活力菌株UM2-6連續傳代8次培養,每代菌株均測酶活力,考察其遺傳的穩定性。
1.3.7 復合誘變菌株產α-CGTase條件的優化
在前期單因素試驗的基礎上,對復合誘變菌株UM2-6的產酶條件進行優化,通過Plackett-Burman(PB)試驗對顯著因素進行篩選,再中心組合Box-Behnken(BBD)設計響應面試驗,以獲得最優產酶條件。
1.3.7.1 PB試驗設計
選取影響產酶的9個因素進行考察,分別為可溶性淀粉含量、酵母浸粉含量、培養溫度、初始pH、NaCl含量、接種量、CaCl2含量、裝液量、K2HPO4·3H2O含量,以酶活力(Y)為響應值,進行PB試驗設計(N=12),記低水平為-1,高水平為+1。此外K為虛擬因素,用來考察實驗誤差。PB試驗設計的因素與水平見表1。
1.3.7.2 響應面試驗設計
利用PB設計試驗篩選出的3個顯著性因素,即培養溫度(A)、初始pH(B)、接種量(C),采用BBD中心組合設計,以A、B、C為自變量,以酶活力(Y)為響應值設計3因素3水平試驗。中心組合試驗方案中的因素及水平見表2,使用Design-Expert 8.0.6進行分析處理數據。

表1 Plackett-Burman設計變量Table 1 Process variables used in Plackett-Burman design

表2 響應面試驗因素與水平Table 2 Factors and levels of response surface experiments
2 結果與分析
2.1 菌株TLLY7的生長曲線
圖1為菌株的生長曲線。從培養8 h開始,菌株TLLY7的菌體數快速增長,并在24 h后逐漸緩慢增長并趨于穩定,40 h后菌體逐漸走向衰亡。
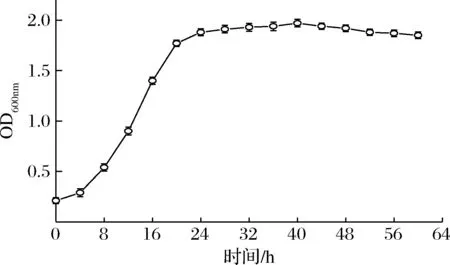
圖1 菌株TLLY7的生長曲線Fig.1 The growth curve of strain TLLY7
2.2 α-環糊精的標準曲線
根據標準方法繪制α-環糊精標準曲線。擬合線性回歸方程:y=0.546 1x-0.000 8,R2=0.999 1,表明線性良好。
2.3 物理誘變
2.3.1 紫外誘變的致死率和正突變率
圖2反映了紫外誘變時間與菌株致死率和正突變率的關系。菌株致死率隨著紫外線照射時間的延長而逐漸升高,當紫外線照射時間為100 s時,紫外誘變菌株致死率接近100%。在0~70 s時,菌株正突變率隨著紫外線照射時間的延長也在不斷升高。當紫外線照射時長為70 s時,菌株正突變率最高,為21.42%,此時菌株致死率為80.95%。近年來許多學者的研究表明,正向突變的菌株較多出現在致死率為80%左右,結合致死率和正突變率曲線,確立菌株TLLY7的紫外誘變的最佳時間為70 s,這與前人研究中的致死率選擇相近[23-24]。
2.3.2 紫外誘變選育高酶活力菌株
對菌株TLLY7進行紫外誘變后,得到共計56株誘變菌株。挑選出長勢較好的菌株19株進行發酵復篩,得到高酶活力誘變菌株UV2-10,菌株酶活力由初始的1.35 U/mL提高到2.27 U/mL。表3為部分紫外誘變菌株的酶活力測量值。
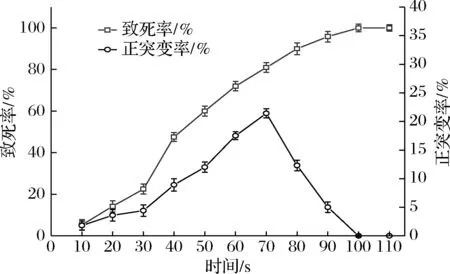
圖2 紫外誘變的致死率和正突變率Fig.2 Lethal rate and positive mutation rate of ultraviolet mutagenesis

表3 紫外誘變菌株的篩選結果Table 3 Screening results of ultraviolet mutagenesis strains
2.3.3 微波誘變的致死率和正突變率
圖3反映了微波誘變時間與菌株致死率和正突變率的關系。菌株致死率隨著微波輻照時間延長而逐漸升高,當微波輻照時間為105 s,致死率為100%。在0~60 s時,菌株正突變率隨著微波輻照時間的延長也在不斷升高,當微波誘變時間為60 s,致死率為77.36%,此時正突變最高,為23.61%。結合致死率和正突變率曲線,確立最佳微波誘變時間為60 s。
2.3.4 微波誘變選育高酶力菌株
對菌株UV2-10進行微波誘變后,得到共計72株誘變菌株。挑選出長勢較好的菌株31株進行發酵復篩,得到高酶活力復合誘變菌株UM2-6,酶活力由2.27 U/mL提高到3.09 U/mL。表4為部分微波誘變菌株的酶活測量值。
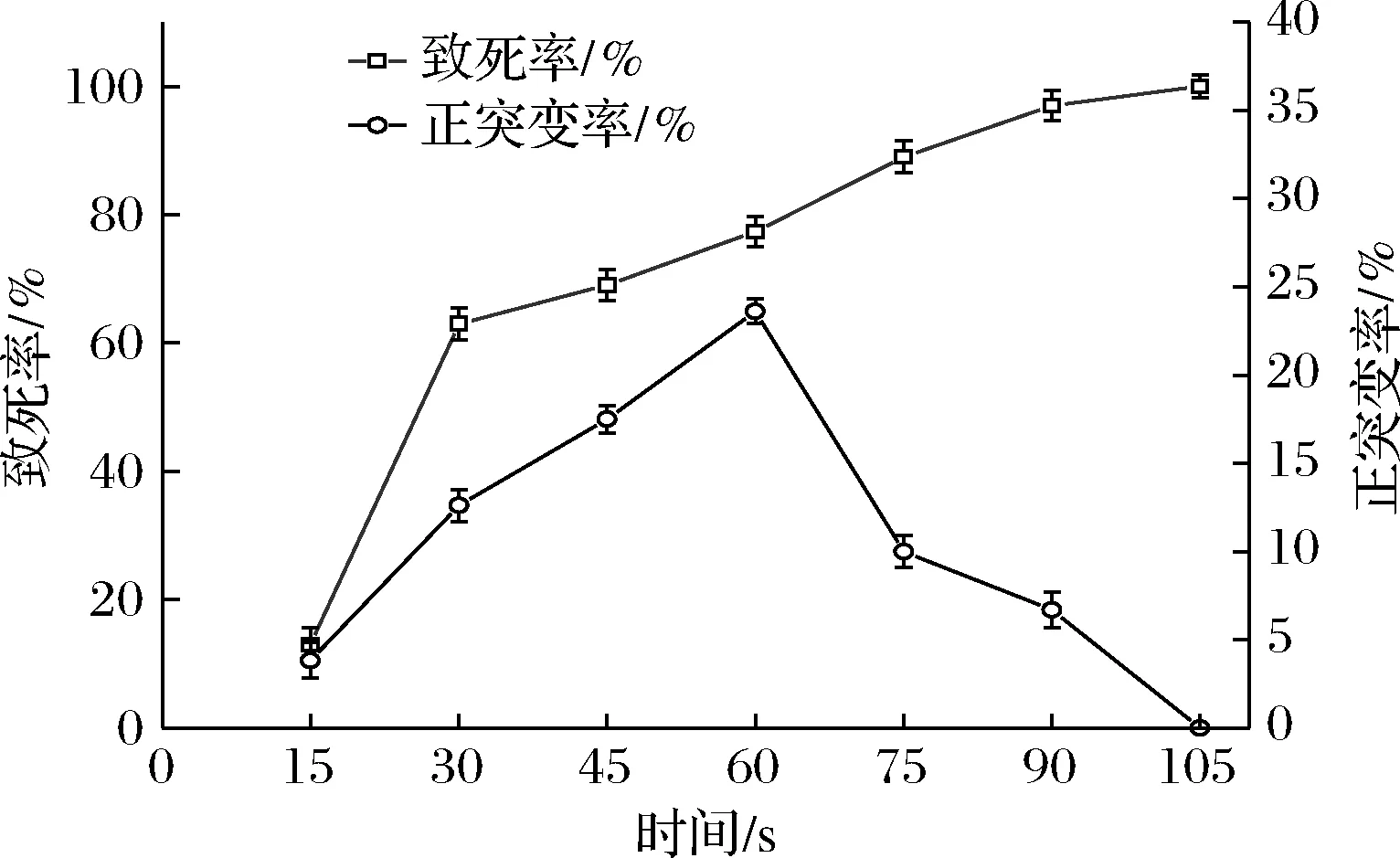
圖3 微波誘變的致死率和正突變率Fig.3 Lethal rate and positive mutation rate of microwave mutagenesis

表4 微波誘變菌株的篩選結果Table 4 Screening results of microwave mutagenesis strains
2.3.5 復合誘變菌株UM2-6遺傳穩定性的測定
對復合誘變菌株UM2-6進行連續傳代8次,測定各代菌株產α-CGTase酶活力,結果見表5。復合誘變菌株UM2-6產酶活力比較穩定,沒有顯著變化,說明遺傳性能穩定,具有進一步研究的價值。

表5 突變株UM2-6各代產α-CGTase活力Table 5 α-CGTase activity produced by mutant UM2-6 of every generation
2.4 突變菌株UM2-6產酶條件的優化
2.4.1 PB試驗設計與顯著性因素篩選結果
前期通過單因素試驗已分析出9個影響菌株產酶的因素,分別為可溶性淀粉含量、酵母浸粉含量、培養溫度、初始pH、NaCl含量、接種量、CaCl2含量、裝液量、K2HPO4·3H2O含量。在此基礎上,對這9個因素進行PB試驗設計(N=12),以考察各因素對菌株產酶能力的影響,并篩選顯著性影響因素,對試驗設計結果進行主效應分析,結果見表6。篩選出的顯著因素分別為培養溫度、初始pH、接種量,P值分別為0.033、0.034、0.045,均小于0.05。
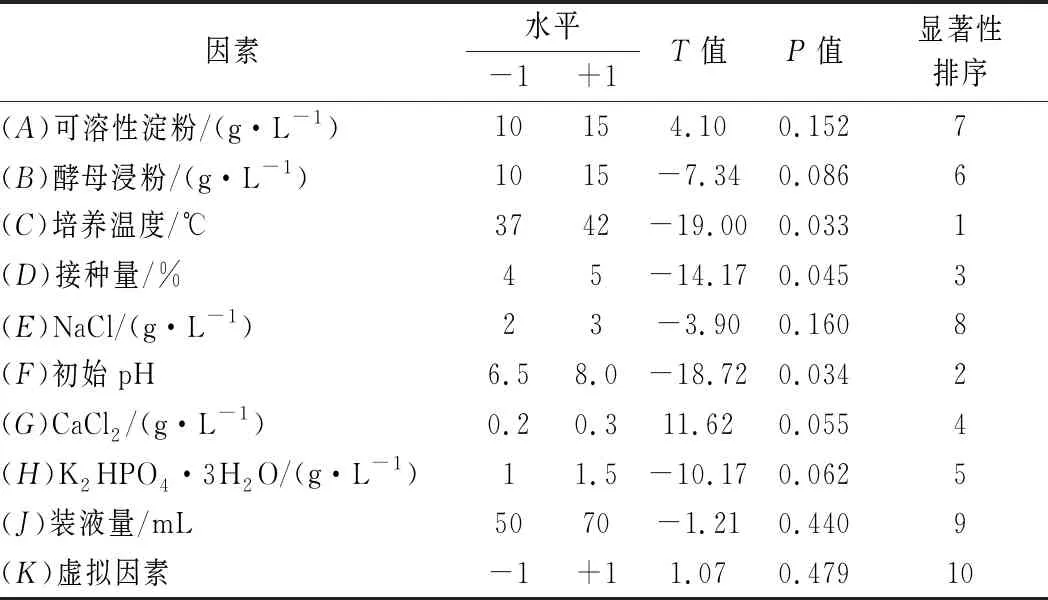
表6 Plackett-Burman設計的各因素水平及主效應分析Table 6 Factors,levels and significance analysis of Plackett-Burman design
2.4.2 響應面設計與結果分析
2.4.2.1 BBD試驗設計結果與回歸模型的方差分析
以培養溫度(A)、初始pH(B)、接種量(C)為考察因素,響應值為酶活力(Y),設計響應面試驗,并對試驗結果的數據進行多元回歸擬合,得到模型的二次回歸方程:
Y=4.11+0.031A+0.31B-0.081C+0.015AB+0.027AC+0.040BC-0.45A2-0.22B2-0.84C2
式中:Y,α-CGTase的預測酶活力(U/mL);A、B、C,分別代表培養溫度(℃)、初始pH、接種量(%)。
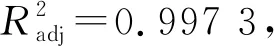
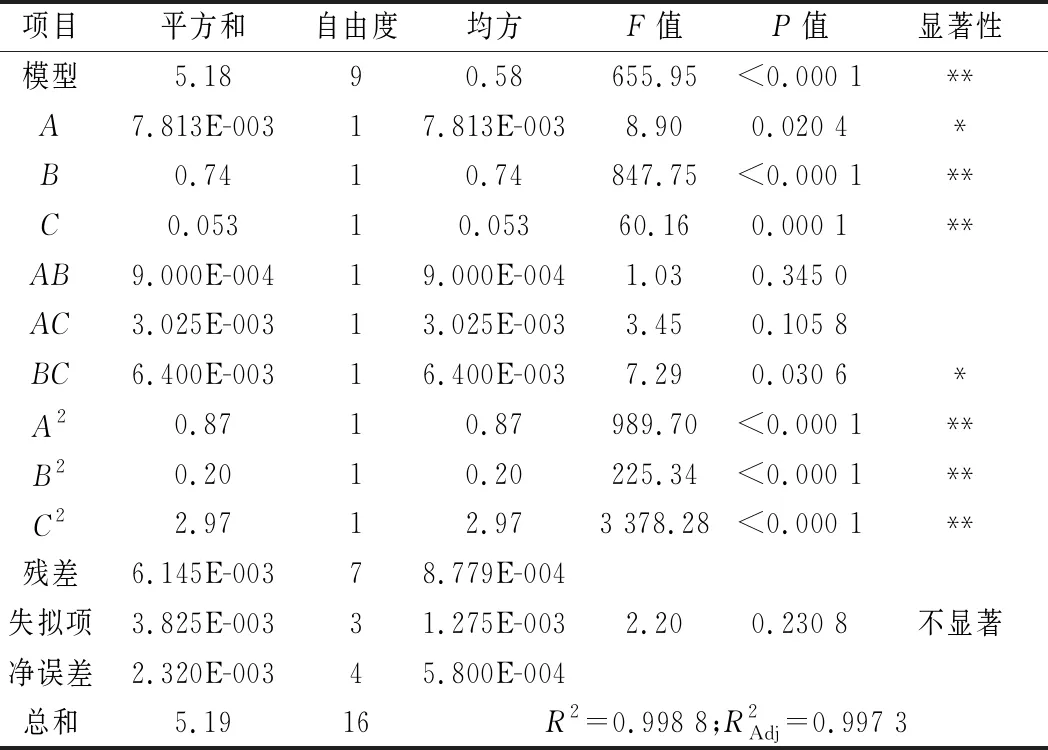
表7 回歸模型的方差分析Table 7 Variance analysis of regression model
2.4.2.2 響應面曲線及等高線分析
圖4為通過Design-Expert軟件分析出3種顯著性影響因素的響應面曲線和等高線。
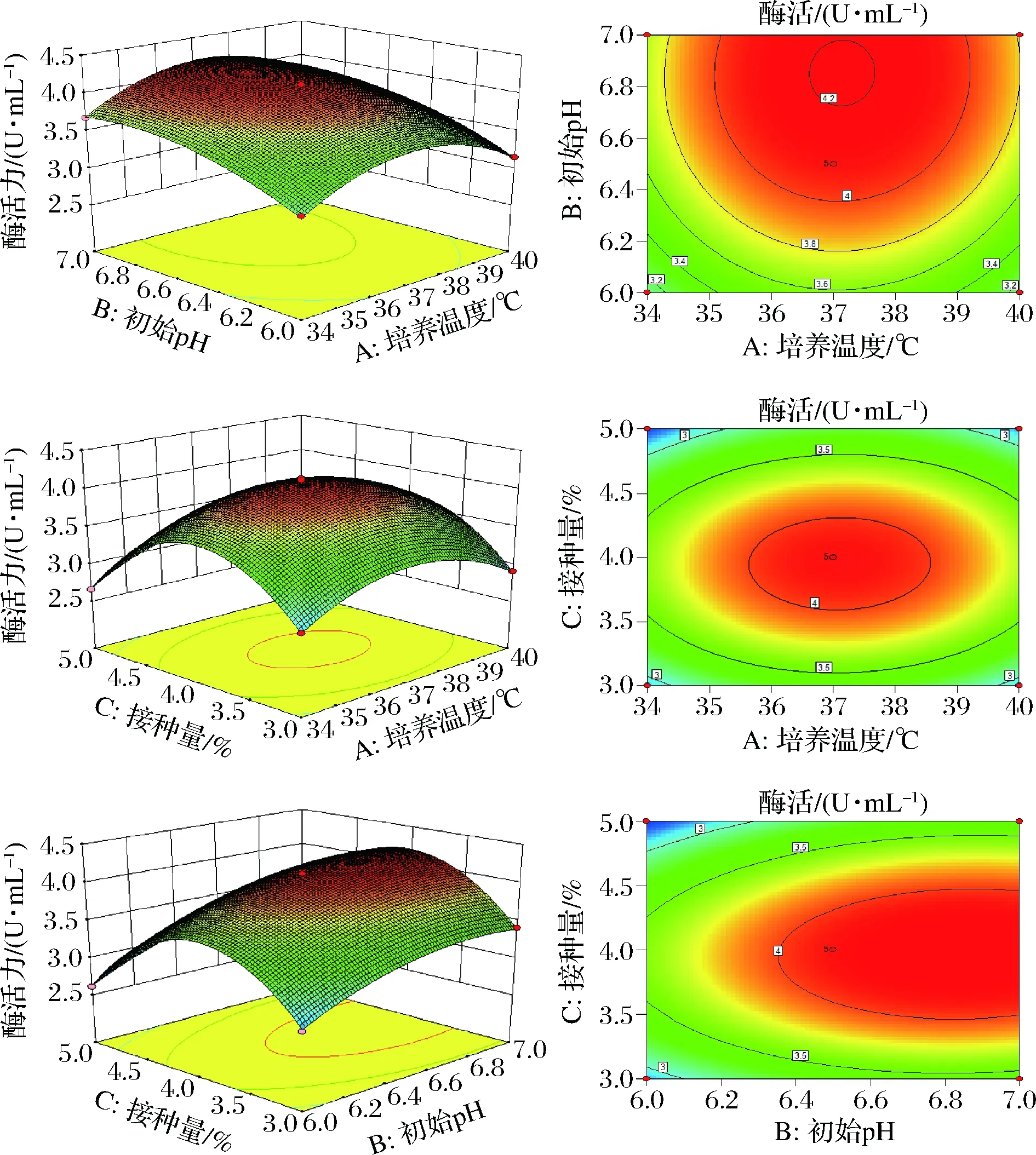
圖4 培養溫度、初始pH、接種量交互作用對酶活力影響的響應面曲線及等高線Fig.4 Response surface plots and contour line of effects of interaction between temperature,initial pH and inoculum on enzyme activity
各因素的響應面曲線皆呈拋物線形狀,且開口向下,表明存在響應最大值。等高線的形狀與響應面曲線的陡緩程度可反應因素交互作用的強弱,響應面曲線越陡,因素間的交互作用就越顯著;響應面曲線越平滑,因素間的交互作用越小。若等高線呈橢圓形,表明因素間的交互作用較顯著;等高線呈圓形,表明因素間交互作用不顯著[25-26]。則根據圖4的結果,說明B和C交互作用顯著,A和B、A和C交互作用不顯著。
2.4.3 驗證實驗
利用Design-Expert 8.0.6分析得到影響α-CGTase酶活力的最佳條件理論值為培養溫度37.13 ℃,初始pH 6.85,接種量3.97%,理論最高酶活力為4.22 U/mL。考慮到實際操作,調整最佳條件為培養溫度37.1 ℃,初始pH 6.9,接種量4.0%,測得α-CGTase酶活力為4.19 U/mL,證實了響應模型的有效性,說明經優化所得的最佳條件可信。優化前的發酵條件為:可溶性淀粉10 g/L、蛋白胨5 g/L、酵母浸粉5 g/L、NaCl 5 g/L、K2HPO4·3H2O 1 g/L、MgSO4·7H2O 0.5 g/L、初始pH 7.0、培養溫度37 ℃、接種量4%、裝液量50 mL/250 mL,突變菌株UM2-6產α-CGTase的酶活力為3.09 U/mL,優化之后的酶活力為優化之前的1.36倍,氮源、金屬離子及其他條件的改變有效地提升了該菌株的產酶能力。
3 結論與討論
本研究對α-環糊精葡萄糖基轉移酶產生菌株P.maceransTLLY7進行了紫外-微波復合誘變,并對所得復合誘變菌株UM2-6的發酵條件進行優化,顯著提高菌株產酶水平。確定了紫外、微波復合誘變的最佳誘變條件,其中紫外誘變的最佳誘變條件為:紫外線照射70 s,致死率為80.95%,此時菌株正突變率最高,為21.42%,經過篩選后得到酶活力最高的菌株UV2-10,酶活力為2.27 U/mL;微波誘變的最佳誘變條件為:低火檔輻照60 s,致死率為77.36%,此時菌株正突變最高,為23.61%,將紫外誘變所得菌株UV2-10進行微波誘變處理,經過篩選后得到復合誘變菌株UM2-6,其酶活力為3.09 U/mL。在前期單因素試驗的基礎上,通過PB試驗設計篩選出培養溫度、初始pH、接種量3個顯著因素,再用BBD試驗確定最佳發酵條件。結果表明,最佳發酵培養基成分為可溶性淀粉10 g/L、酵母浸粉10 g/L、NaCl 2 g/L、CaCl20.2 g/L、K2HPO4·3H2O 1 g/L,最佳發酵條件為培養溫度37.1 ℃、初始pH 6.9、接種量4%。在此優化條件下,突變菌株UM2-6產α-CGTase的酶活力為4.19 U/mL,為優化之前酶活力(3.09 U/mL)的1.36倍。
陳龍然[16]通過紫外-硫酸二乙酯復合誘變地衣芽孢桿菌(Bacilluslicheniformis),再通過單因素試驗和正交試驗優化誘變株產α-CGTase的發酵條件,其酶活力達2.28 U/mL,是出發菌株(0.95 U/mL)的2.4倍。雷新輝等[27]通過紫外-亞硝酸復合誘變產酸克雷伯氏菌(Klebsiellaoxytoca),誘變株產α-CGTase酶活力達3.76 U/mL,是出發菌株(0.62 U/mL)的5.06倍。上述研究中,發酵優化后的菌株酶活力均不及本研究中經復合誘變和產酶條件優化后所得菌株酶活力。陳龍軍等[12]利用基因工程技術將嗜熱芽胞桿菌(Gebacilliussp.)異源表達后,利用單因素試驗優化發酵條件,其產α-CGTase酶活達5.3 U/mL,是野生菌(0.66 U/mL)的8倍。本研究的野生菌株的酶活力高于此研究中野生菌株的酶活,但是突變菌株低于其經產酶基因異源表達后基因工程菌的酶活力。為進一步提高酶活力,仍需要通過對菌株產酶基因進行克隆表達或對目的基因片段進行蛋白質工程改良等基因工程技術,而篩選出酶活力高、性質優良的出發菌株是這些方法的基礎。本研究為實驗室后期提高酶活力等試驗奠定了基礎,為工業生產α-CGTase及應用提供了參考。

