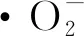酪蛋白糖巨肽酶解產物抗氧化活性及其對RAW 264.7細胞氧化損傷的保護作用
唐麒雯,吳澤儀,余寧翔,葉沁,孟祥河*,聶小華*
1(浙江工業大學 食品科學與工程學院,浙江 杭州,310014) 2(浙江省農業科學院 食品科學研究所,浙江 杭州,310021)
氧化應激是生物體內氧化與抗氧化作用失衡的一種狀態,可造成脂質、蛋白質和DNA等氧化損傷而引起細胞凋亡,其已被證實與多種慢性疾病、衰老有著密切關系[1]。為此,應用抗氧化活性物質成為了降低生物體氧化損傷的一種策略。抗氧化肽源于食品蛋白質,由于具有資源豐富、穩定性好、安全性高等優勢,逐漸備受關注。
酪蛋白糖巨肽(glycomacropeptide,GMP)是一種具有64個氨基酸殘基的糖肽,富含纈氨酸、亮氨酸等支鏈氨基酸,但幾乎不含苯丙氨酸、酪氨酸和色氨酸等芳香族氨基酸[2];其主要糖基為唾液酸[3]。正因為GMP獨特的氨基酸構成,其酶解產物在結構與功能活性方面可能不同于其他蛋白酶解產物。近年來科研工作者開始關注GMP酶解產物,發現其具有益生、抗炎等功能活性,如GMP酶解產物可促進保加利亞乳桿菌和嗜熱鏈球菌的生長[4];可通過阻斷NF-κb信號通路,抑制脂多糖(lipopolysaccharide,LPS)誘導的巨噬細胞中一氧化氮(nitric oxide,NO)產生和炎癥因子mRNA表達,發揮抗炎作用[5]。
目前國內外關于GMP酶解產物的抗氧化性研究報道較少,僅CHENG等[6]采用木瓜蛋白酶酶解GMP,發現其酶解產物對RAW 264.7小鼠巨噬細胞的氧化損傷有保護作用。基于此,本文擬采用堿性蛋白酶、中性蛋白酶和木瓜蛋白酶等商業酶制劑對GMP進行降解,比較其酶解產物的自由基清除能力與抗氧化損傷能力,為GMP酶解產物功能食品配料開發提供研究依據。
1 材料與方法
1.1 材料與試劑
GMP,丹麥Arla公司;中性蛋白酶、木瓜蛋白酶,上海瑞永生物科技有限公司;堿性蛋白酶,上海麥克林生化科技有限公司;RAW 264.7(小鼠巨噬細胞),中國科學院生物化學與細胞生物學研究所上海細胞庫;2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzenesulfonic acid,TNBS)、2,2,-聯氨-雙-3-乙基苯并噻唑啉-6-磺酸(2,2-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid,ABTS))、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)等試劑均為分析純,美國sigma公司;焦性沒食子酸,國藥集團化學試劑有限公司。
1.2 儀器與設備
MCO-17AC型二氧化碳培養箱,日本Sanyo 公司;CKX41型倒置光學顯微鏡、IX53型倒置熒光顯微鏡,日本Olympus公司;Synergy H1多功能酶標儀,美國Bio-TEK公司;ACB-4A1超凈工作臺,南京非同科學儀器有限公司。
1.3 實驗方法
1.3.1 GMP酶解產物的制備
采用不同pH的0.1 mol/L磷酸鹽緩沖溶液配制30 g/L GMP溶液,按100 U/g添加量分別加入中性蛋白酶、木瓜蛋白酶和堿性蛋白酶,酶解條件見表1,酶解0.5、1、2、4、6 h后取樣,快速置于85 ℃下熱處理20 min使酶失活;而后快速冷卻至室溫,離心(10 000 r/min,20 min),上清液冷凍干燥,備用;酶解產物分別命名為N-GMPH、P-GMPH和A-GMPH。

表1 GMP的酶解參數Table 1 Enzymatic parameters of GMP
1.3.2 水解度
參考ADLER-NISSEN等的方法[7]。0.1 mL樣液中依次加入1 mL 0.2 mol/L磷酸鹽緩沖液(pH 8.2)和1 mL 0.1% TNBS溶液,混勻,50 ℃下避光反應60 min,而后加入2 mL 0.1 mol/L HCl溶液以終止反應,快速冷卻至室溫,340 nm處測定吸光度。以L-亮氨酸為標準品做標準曲線,根據公式(1)計算水解度:

(1)
式中:ω1,水解前的氨基氮質量分數,mg/g (蛋白);ω2,水解后的氨基氮質量分數,mg/g (蛋白);ω3,GMP完全水解后的氮質量分數,mg/g (蛋白)。
1.3.3 抗氧化活性測定
1.3.3.1 ABTS陽離子自由基清除能力
參考WANG等[8]的方法。取0.1 mL樣液與3.9 mL ABTS工作液混勻,室溫下避光反應10 min,734 nm處測定吸光度。以蒸餾水為陰性對照,以維生素C為陽性對照。根據公式(2)計算其ABTS陽離子自由基清除活性,且以維生素C當量/mL來表示:
(2)
式中:A1,陰性對照吸光度;A2,樣液或陽性對照吸光度。
1.3.3.2 DPPH自由基清除能力
(3)
式中:A1,陰性對照吸光度;A2,樣液或陽性對照吸光度。
采用HOMAYOUNI-TABRIZI等[10]的方法。0.1 mL樣液與2.8 mL 1 mmol/L Tris緩沖液(pH 8.2)混合,加入0.1 mL 30 mmol/L焦性沒食子酸引發反應,室溫下反應4 min。以蒸餾水為陰性對照,維生素C為陽性對照,320 nm處每30 s測定其吸光度。
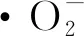
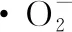
(4)
式中:V1,陰性對照氧化速率,Abs/min;V2,樣液或陽性對照氧化速率,Abs/min。
河道縱向剖面規劃設計應保護河道與河道、河道與湖塘之間的連通性,不設或少設擋水建筑物及構筑物。對河道內已建的壅水、阻水或影響河道排澇能力的建筑物,應給予改(擴)建或拆除。不能拆除的應考慮通過改變運營方式等保持水流暢通,或修建跌水與魚道工程。
1.3.4 對H2O2誘導RAW 264.7細胞氧化損傷的保護作用
1.3.4.1 細胞培養
RAW 264.7 細胞以RPIM1640(含10%胎牛血清,1%青霉素-鏈霉素雙抗)為培養基,置于37 ℃、5% CO2的培養箱中進行培養。
1.3.4.2 細胞存活率的測定
將對數生長期的RAW 264.7細胞接種到96孔板(1×104/孔),在培養箱中37 ℃培養24 h后,分別加入100 μL樣液使其終質量濃度為0.05、0.1、0.5、1 mg/mL,繼續培養12 h,再加入100 μL 400 μmol/L H2O2共培養6 h。采用MTT法[11]測定細胞活力。對照組中未加H2O2和樣液,其細胞存活率計為100%;雙氧水組未加樣液。
1.3.4.3 活性氧(reactive oxygen species,ROS)生成量的測定
將對數生長期的RAW 264.7細胞分別接種到96孔板(1×104/孔)和6孔板中(5×105/孔),在培養箱中37 ℃培養24 h后,加入樣液使終質量濃度為0.5 mg/mL,培養12 h,然后加入100 μL 400 μmol/L H2O2共培養6 h。采用DCFH-DA法[12]測定細胞ROS生成量,同時使用倒置熒光顯微鏡觀察細胞ROS熒光強度。對照組中未加H2O2和樣液;雙氧水組未加樣液,其ROS生成量計為100%。
1.4 數據處理
所有實驗至少重復3次,結果表示為平均值±標準差(SD)。采用GraphPad Prism 7.0軟件對實驗數據進行單因素方差檢驗(analysis of variance,ANOVA)及Tukey檢驗;P<0.05說明統計學上存在顯著性差異。
2 結果與討論
2.1 蛋白酶種類對GMP水解度的影響
蛋白酶種類對GMP酶解程度的影響如圖1所示。隨著酶解時間的增加,GMP酶解程度逐漸增加而后趨于平緩,其中中性蛋白酶對GMP的酶解作用明顯優于木瓜蛋白酶和堿性蛋白酶,后二者之間并無明顯差異。這可能是因為:(1)GMP分子中蘇氨酸、谷氨酸、脯氨酸等氨基酸殘基所占比例較高,基本不含酪氨酸、色氨酸和苯丙氨酸等芳香族氨基酸殘基[2];(2)蛋白酶作用位點不同,其中堿性蛋白酶作用位點主要為酪氨酸、苯丙氨酸、色丙氨酸、亮氨酸、異亮氨酸等氨基酸殘基,木瓜蛋白酶作用位點主要為賴氨酸、精氨酸、甘氨酸和半胱氨酸等氨基酸殘基,而中性蛋白酶作用位點相對廣泛,并可酶切蘇氨酸殘基[13]。
當酶解至4 h時,水解度基本趨于平緩,中性蛋白酶、木瓜蛋白酶和堿性蛋白酶等對GMP的酶解程度分別為(11.82±0.58)%、(9.77±0.92)%和(9.01±0.58)%。該水解度低于已有的研究,如O’SULLIVAN等[14]采用堿性蛋白酶酶解酪蛋白,水解度可達(18.01±1.59)%,這是源于GMP獨特的氨基酸組成,其可供蛋白酶的作用位點較少。結果表明,中性蛋白酶對GMP的酶解程度較大。

圖1 蛋白酶種類對GMP酶解程度的影響Fig.1 Effects of protease type on enzymolysis degree of GMP
2.2 蛋白酶種類對GMP酶解產物自由基清除能力的影響

a-ABTS陽離子自由基;b-DPPH自由基;圖2 蛋白酶種類對GMP酶解產物清除自由基能力的影響Fig.2 Effects of protease type on free radical scavenging ability of GMP hydrolysate
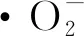
2.3 對H2O2誘導RAW 264.7細胞氧化損傷的保護作用
2.3.1 氧化模型的建立
H2O2進入細胞后可轉化為·OH,具有較強的氧化能力,故常用H2O2建立細胞氧化應激模型。H2O2處理對RAW 264.7細胞存活率的影響如圖3所示。結果表明,隨著H2O2濃度的增加,細胞存活率下降,說明其誘導了細胞的氧化損傷。其中400 μmol/L H2O2可降低細胞存活率降至(54.72±0.45)%,因此選擇400 μmol/L濃度進行實驗。

圖3 H2O2處理對RAW 264.7細胞存活率的影響Fig.3 Effect of H2O2 treatment on RAW 264.7 cell viability
2.3.2 N-GMPH對H2O2誘導RAW 264.7細胞存活率的影響
GMP經中性蛋白酶酶解4 h后,其酶解產物N-GMPH對RAW 264.7細胞存活率的影響如圖4所示。結果表明,GMP預處理對RAW267.4細胞存活率影響較弱,說明其對細胞氧化損傷基本無保護作用;而N-GMPH預處理可顯著提高RAW 264.7細胞存活率(P<0.05),這是因為:(1)與GMP相比,N-GMPH本身具有更高的自由基清除能力(圖2);(2)N-GMPH含有較多的小分子肽,其容易發生跨膜轉運進入細胞內,淬滅H2O2在細胞內經代謝產生的ROS[19],從而發揮抗氧化損傷作用。凌玉芳[20]亦發現,使用雙酶(胃蛋白酶-胰蛋白酶)對乳清蛋白進行酶解,其酶解產物顯著提高細胞存活率,可改善H2O2所致的PC12細胞氧化損傷。
此外,N-PMPH對RAW 267.4細胞氧化損傷的保護作用呈現濃度正相關;當酶解產物質量濃度為0.5和1 mg/mL時,可將RAW 267.4細胞存活率提高至(79.32±1.85)%和(80.70±1.23)%,二者之間無顯著性差異。因此,選用質量濃度為0.5 mg/mL N-GMPH進行后續實驗。

圖4 N-GMPH對H2O2誘導RAW 264.7細胞存活率的影響Fig.4 Effects of N-GMPH on H2O2-induced RAW 264.7 cells viability 注:不同小寫字母表示差異顯著(P<0.05)(下同)
2.3.3 N-GMPH對H2O2誘導RAW 264.7細胞內ROS生成量的影響
過量ROS會破壞細胞內氧化和抗氧化系統之間的平衡,導致氧化應激,從而進一步破壞細胞的結構和功能[21],所以ROS水平可用于反映細胞氧化損傷程度。GMP經中性蛋白酶酶解4 h后,其酶解產物N-GMPH對H2O2誘導RAW 264.7細胞內ROS生成量的影響如圖5所示。H2O2顯著提高了RAW 264.7細胞中ROS生成量,說明細胞氧化損傷主要源于ROS的大量增加。GMP可降低ROS生成量,但下降程度僅為(6.29±0.76)%,這在一定程度上可解釋GMP對細胞氧化損傷無保護作用(圖4);而N-GMPH顯著減少細胞中ROS生成量至(44.50±2.29)%,該結果驗證了其具有良好的抗氧化活性。
同時,熒光倒置顯微鏡可觀察到(圖6),對照組細胞呈現弱綠色熒光,H2O2處理后則顯示出強烈的綠色熒光,意味著細胞中ROS水平明顯增加,進一步證明H2O2誘導了細胞的氧化應激;與H2O2組相比,0.5 mg/mL GMP與N-GMPH預處理后細胞的綠色熒光強度均發生了不同程度的減弱,尤其是后者熒光強度顯著降低,該結果與細胞內ROS生成量(圖5)基本一致。杜夢霞[22]、馬萍等[23]亦發現,豆類蛋白酶解產物可顯著降低細胞內的ROS水平。由此推測,N-GMPH可通過消除細胞中ROS恢復胞內氧化還原平衡,從而減輕胞內脂質、蛋白質和DNA等生命物質的損傷,達到緩解H2O2誘導細胞氧化損傷的作用。

圖5 N-GMPH對 H2O2誘導RAW 264.7細胞內ROS生成量的影響Fig.5 Effects of N-GMPH on ROS production of H2O2-induced RAW 264.7 cells

a-空白組;b-H2O2組;c-GMP;d-N-GMPH圖6 N-GMPH對H2O2誘導RAW 264.7細胞內ROS水平的影響(200×)Fig.6 Effects of N-GMPH on ROS levels in H2O2-induced RAW 264.7 cells
3 結論